微生物絮凝剂研究进展及其在食品工业中的应用
林 杨,刘 淼,林 锋,张宿义,,霍丹群*,陈 飞,杨 艳,李德林,李嘉伟
(1.重庆大学 生物工程学院,重庆 400044;2.泸州老窖股份有限公司,四川 泸州 646000;3.国家固态酿造工程技术研究中心,四川 泸州 646000)
早在1876年,LOUIS PASTEUR就报道了酵母能够絮凝微生物的现象[3]。但直到1976年NAKAMURA等从214株菌株中,筛选出19种具有絮凝能力的微生物,微生物絮凝剂的研究工作才真正开始[4-5]。此后,不少研究者相继报道了关于微生物絮凝剂产生菌筛选、絮凝剂产生条件、作用机理以及分离纯化等方面的研究工作[6-8]。本文通过介绍微生物絮凝剂的化学组成、絮凝机理、絮凝剂产生菌的筛选、培养条件的优化以及微生物絮凝剂在食品工业领域的应用,对近几年微生物絮凝剂的研究工作进行总结,展望微生物絮凝剂的发展方向,以期使微生物絮凝剂能早日商业化,投入到实际应用之中。
1 微生物絮凝剂的化学组成
微生物絮凝剂种类繁多,组成性质各异。不同微生物产生的微生物絮凝剂化学组成各不相同,主要成分有多糖、蛋白质、脂类以及胞外脱氧核糖核酸(deoxyribonucleic acid,DNA)[9]。通过研究微生物絮凝剂化学组成,有利于阐明絮凝的机理,为改造和修饰微生物絮凝剂,提高絮凝性能提供理论依据。
1.1 多糖
多糖是微生物絮凝剂的主要成分,分为同多糖和杂多糖。同多糖一般为中性且仅由一种形式的单糖组成,每个糖单元间通过糖苷键相连。在微生物絮凝剂中,根据糖单元和糖苷键的不同,可以分为三类,其代表分别为由肠系膜明串珠菌(Leuconostoc mesenteroides)等产生的α-D-葡聚糖、由片球菌(Pediococcussp.)或链球菌(Streptococcussp.)等产生的β-D-葡聚糖和由唾液链球菌(Streptococcus salivarius)等产生的果聚糖[10]。
目前多糖类微生物絮凝剂大多由杂多糖组成[11-14],它是由两种或两种以上不同的单糖分子组成的多糖,大多与脂类或蛋白质结合,其理化性质主要由糖单元及其糖苷键和支链决定。如假单胞杆菌(Pseudomonasp.)代谢产生的藻酸盐,由甘露糖醛酸和古罗糖醛酸通过β-(1,4)糖苷键相连,有助于生物膜的形成[15]。由奥克西托克雷白杆菌(Klebsiella oxytoca)代谢产生的微生物絮凝剂,其主要成分多糖由鼠李糖和半乳糖糖单元通过糖苷键连接而成[16]。在絮凝过程中,多糖类微生物絮凝剂本身为大分子,可以通过电性中和或桥联作用与污水中的杂质颗粒结合,从而达到形成絮凝团,沉淀颗粒的作用[17]。
1.2 蛋白质
蛋白质也是微生物絮凝剂的一种重要成分。其相对分子质量大约在10~200kDa间,高分子质量可为与杂质颗粒结合提供大量的位点[18],如活性污泥里面的凝集素蛋白,主要作用为使微生物聚集和形成絮凝体[19]。除此之外,某些细菌分泌的酶蛋白作为一种高效的催化剂,可将污水中的有机物分解,从而达到降低化学需氧量(chemical oxygen demand,COD)的目的[20]。
1.3 其他物质
除了多糖和蛋白质外,脂类和胞外DNA等物质也广泛存在于微生物絮凝剂当中。脂类在微生物絮凝剂中主要和多糖结合,形成脂多糖。氧化亚铁硫杆菌(Thiobacillus ferrooxidans)代谢产生的鼠李糖脂和毛孢子菌(Trichosporon mycotoxinivorans)产生的脂多糖是微生物絮凝剂的有效成分,可为微生物絮凝剂提供疏水性的表面,促进微生物絮凝剂与一些如高岭土和木炭微粒等有疏水性表面的分子之间的反应[21]。
胞外DNA存在于许多微生物絮凝剂中,金黄色酿脓葡萄球菌(Staphylococcus aureus)产生的生物絮凝剂中,胞外DNA是主要成分。表皮葡萄球菌(Staphylococcus epidermidis)产生的微生物絮凝剂中,也发现了有少量的胞外DNA的存在[22]。据文献报道[23],胞外DNA可以使细胞聚集。MOSCOSO M等[24]将DNase I加入到肺炎链球菌(Streptococcus pneumoniae)的培养基中,发现该菌生长并未受到影响,但生物膜形成却受到了很大的影响,说明胞外DNA在生物膜的形成中发挥重要作用。
2 微生物絮凝剂的絮凝机理
絮凝剂的絮凝机理是一个复杂的物理化学过程,传统化学絮凝剂经典絮凝作用机理主要有双电层压缩作用、桥联作用、卷扫作用等。对于微生物絮凝剂来说,其种类众多,絮凝剂的组成和结构复杂,对于同一个作用体系,不同微生物絮凝剂的作用机理也不同。因此,研究人员提出了许多絮凝机理假说,主要有Butterfield的黏质假说、Grabtree的利用PHB(polyhy-β-droxybutyric acid)酯合学说、Friedman的菌体外纤维纤丝学说、茄膜学说、电性中和学说以及胞外聚合物桥联学说。其中,目前被学界广泛认可的为桥联学说、电性中和学说[25]。ALJUBOORI A H R等[26]发现由黄曲霉(Aspergillus flavusc)合成的微生物絮凝剂IH-7主要絮凝机理为电性中和,即在没有阳离子助凝剂存在的情况下,带正电荷的IH-7能打破负电荷微粒间的平衡,从而使微粒迅速聚集。HE J等[27]通过将盐单胞菌(Halomonassp.)产生的微生物絮凝剂HBF-3絮凝高岭土时发现桥联作用为其主要絮凝机理,即助凝剂CaCl2在微生物絮凝剂与高岭土之间起到了一个介导桥梁的作用,二价的Ca2+减小了微生物絮凝剂与高岭土之间的静电斥力,并缩短了它们之间的距离,使高岭土与絮凝剂的吸附位点结合。关于部分微生物絮凝剂絮凝机理的研究见表1。
确定分型面各位置的大致原则,务必保证塑件的各种性能、能更好的使塑件脱模和简化成形模具的结构,分型面同时会受到多种塑件在模具中的位置、灌注系统的制定、成件的结构性能及精度、嵌件的位置外形大小和推出的方案、模具成形的设计、排气、实施工艺等许多因素的协同作用,所以在挑选分型面时应该全面的分析和比较,通常可以根据以下几点进行筛选。
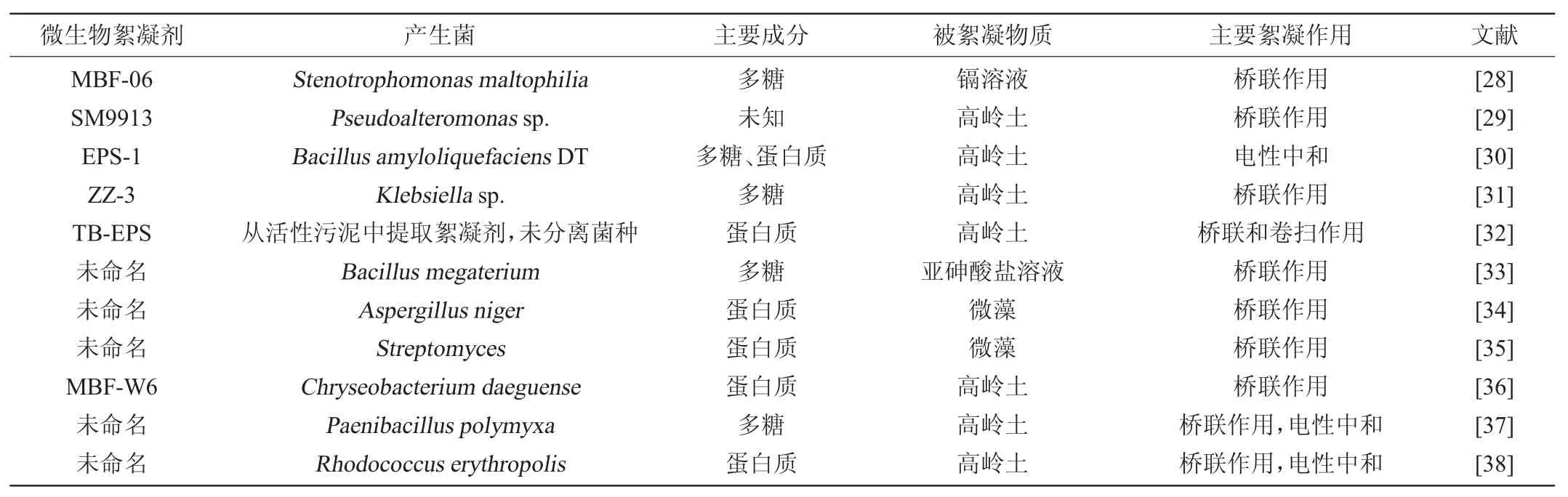
表1 微生物絮凝剂絮凝机理的研究Table 1 Research on flocculation mechanism of microbial flocculants
3 絮凝剂产生菌株的筛选以及培养条件的优化
3.1 微生物絮凝剂产生菌的筛选
具有分泌微生物絮凝剂能力的微生物统称为微生物絮凝剂产生菌,广泛分布于活性污泥、土壤、深海。CHEN H G等[39]从含酚的污泥中筛选出了一株嗜麦芽窄食单胞菌(Stenotrophomonas maltophilia),它可利用苯酚作为碳源,合成一种名为MBF-06的微生物絮凝剂。OKAIYETOK等[40]从海洋沉淀样本中筛选出能代谢出微生物絮凝剂REG-6的东洋芽孢肝菌(Bacillus toyonensis)。迄今为止,研究人员已发现17个种类的微生物具有产生微生物絮凝剂的能力,其中有霉菌、细菌、放线菌、酵母等[41],但对它们的研究大部分还仅限于筛选和培养阶段,未见大规模工业利用。关于产絮微生物及其筛选样本的研究见表2。
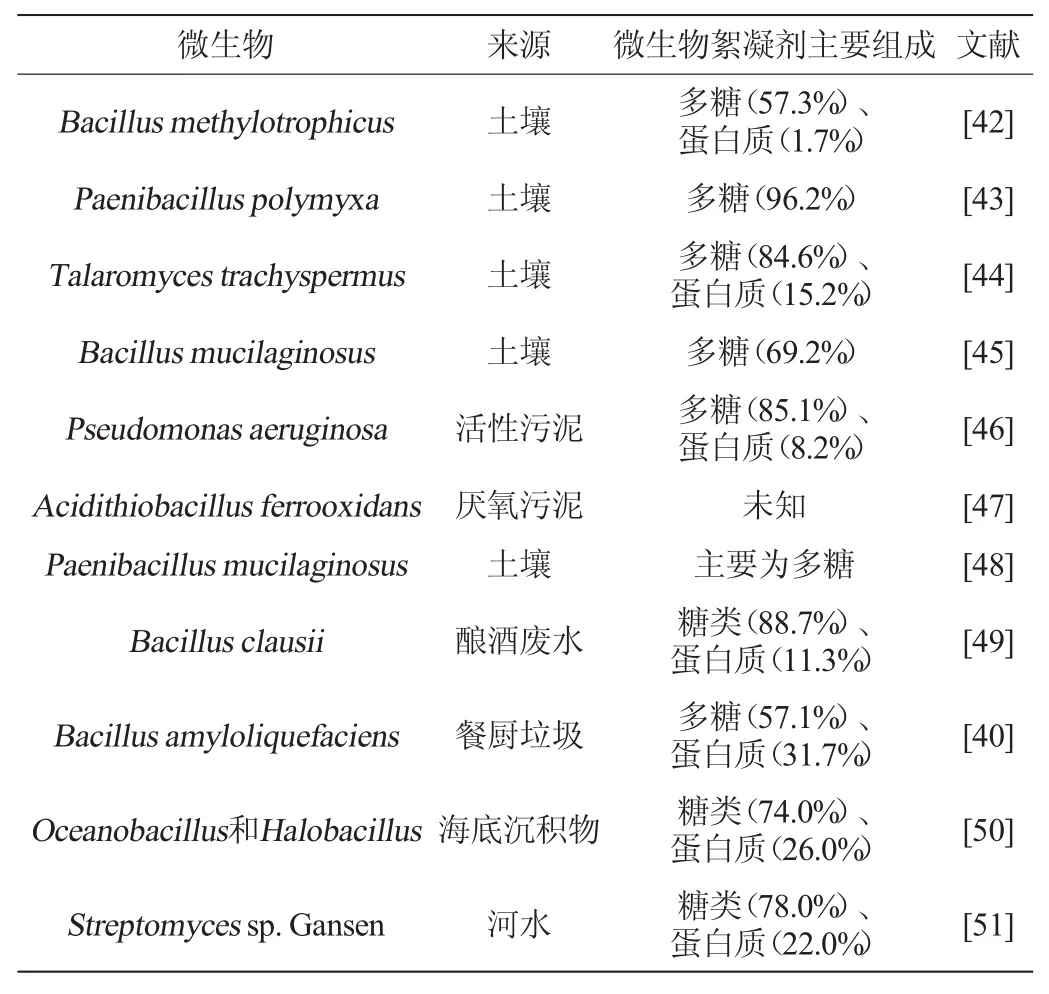
表2 絮凝剂生产菌株及其来源Table 2 Flocculant-producing strains and their sources
3.2 生物絮凝剂产生菌培养的影响因素
微生物的生长需要适宜的环境,环境的好坏直接影响了其代谢产物的合成。影响微生物生长和代谢的因素有很多,其中主要有培养基的碳源、氮源、碳氮比、初始pH、培养温度等。为了提高絮凝剂的产量与活性,必须对这些因素进行优化。
3.2.1 碳源、氮源以及碳氮比对微生物絮凝剂产量的影响
一般来说,营养越丰富的培养基越有利于微生物絮凝剂的产生,但不同产微生物絮凝剂菌株对碳源、氮源的要求差别大。常用的碳源有葡萄糖、果糖、蔗糖、乙醇等;常用的氮源有蛋白胨、尿素以及各种铵盐。有些碳源氮源可以促进微生物絮凝剂的产生,有些则会限制微生物絮凝剂的产量。如ALJUBOORI A H R等[52]发现当使用蔗糖作为碳源时,黄曲霉(Aspergillus flavus)的微生物絮凝剂产量最高,而将果糖、甘油作为碳源时,A.flavus的微生物絮凝剂产量却大大降低。LIU W J等[53]发现使用有机氮作为金黄杆菌(Chryseobacterium daeguense)W6产微生物絮凝剂氮源时,所得的微生物絮凝剂产量要明显高于无机氮。针对目前微生物絮凝剂生产成本高的缺点,ZHAO J等[54]利用含甲醛的污水作为碳源生产微生物絮凝剂MBF-79,在最适条件下,MBF-79的最大产量为8.97 g/L。LIU W J等[55]使用小麦秆、玉米棒等作为碳源生产微生物絮凝剂MBF-L804,实验结果表明,MBF-L804的产量为4.75 g/L。
对于微生物絮凝剂的生产,碳氮比至关重要。这是因为合适的碳氮比可以使微生物按比例均匀地吸收营养物,减少环境酸碱度的波动。研究表明,对于不同种类的微生物,最优碳氮比是不同的,没有定值[56]。LILX等[57]的研究表明,当使用放射型根瘤菌(Rhizobium radiobacter)F2和球形芽孢杆菌(Bacillus sphaericus)F6作为生物絮凝产生菌时,其最佳碳氮比为20。LIU C等[58]发现生产微生物絮凝剂MBF-C9的最佳碳氮比为1,其值过高或过低都会影响微生物絮凝剂的产量。除此之外,研究者还发现碳氮比的不同对微生物絮凝剂的组成也有影响,YE F X等[59]使用活性污泥混菌培养产絮菌株,最佳碳氮比为20,低于此值时微生物絮凝剂里的糖含量减少、蛋白质含量增加,而高于此值时微生物絮凝剂里糖含量增加、蛋白质含量减少。
3.2.2 pH对微生物絮凝剂产量的影响
培养基的初始pH对微生物絮凝剂的产量有较大影响。对于不同的微生物,其最适初始pH不同。研究者一般通过将同一种微生物在不同的pH条件下培养来探究最适产絮pH。GIRI S S等[60]研究表明,枯草芽孢杆菌(Bacillus subtilis)F9产微生物絮凝剂的最适pH值为7,在该pH值条件下,微生物絮凝剂的产量为2.32 g/L。CHEN H G等[28]发现嗜麦芽窄食单胞菌(Stenotrophomonas maltophilia)产微生物絮凝剂的最适pH值为6。TIWARI O N等[61]发现念珠藻(Nostocsp.)BTA97和鱼腥藻(Anabaenasp.)BTA990生产微生物絮凝剂的最适pH值为8。LEE J W等[62]的研究表明芽短梗霉菌(Aureobasidium pullulans)在酸性条件能代谢微生物絮凝剂。
3.2.3 温度对微生物絮凝剂产量的影响
温度是影响微生物絮凝剂产量的又一重要因素。培养基温度的变化会影响微生物的生长,从而影响微生物絮凝剂的代谢合成。根据文献报道[63],大多数微生物在30~35℃之间微生物絮凝剂产量最高。如黑曲霉(Aspergillus niger)产微生物絮凝剂的最适温度为35℃[64]。对于某一种微生物,其最适生长温度和产微生物絮凝剂代谢温度可能相同,但也可能不同。这可能是因为催化微生物生长途径和产微生物絮凝剂途径的酶的最适温度不同[65]。因此,找到一个合适的温度有利于微生物生长和微生物絮凝剂合成。
4 微生物絮凝剂在食品工业中的应用
微生物絮凝剂具有安全、无毒等特性,应用于食品工业中可大大提高污水副产物回收利用的安全性,如酒厂废水的副产物中的污泥可应用于生产人工窖泥,食品厂生产废水处理副产物可用作肥料[66]。GONG W X等[67]利用无花果沙雷氏菌(Serratia ficaria)产生的微生物絮凝剂处理酒厂、肉加工厂以及酱油厂所排放的废水,结果表明,对于酒厂、肉加工厂以及酱油厂所排放的废水,该微生物絮凝剂化学需氧量(chemical oxygen demand,COD)去除率分别为80.7%、76.3%和64.1%。PU S Y等[68]采用一种由根霉菌(Rhizopussp.)M9和根霉菌(Rhizopussp.)M17产生的微生物絮凝剂MBF917处理马铃薯淀粉废水,COD和浊度的去除率分别为54.09%和92.11%。陈烨等[69]将微生物絮凝剂处理啤酒厂废水,结果表明,废水悬浮物、生物需氧量(biochemical oxygen demand,BOD)、COD的去除率分别为93.59%、77.40%、70.52%,LUO Y等[70]将微生物絮凝剂与聚丙烯酰胺复配之后处理蔗糖混合汁,澄清效果要明显优于单独使用聚丙烯酰胺的效果。除此之外,微生物絮凝剂还广泛应用于发酵制品的固液分离、发酵液中培养基残余菌体的去除等领域[71]。
5 结论与展望
作为一种安全、可降解的絮凝剂,微生物絮凝剂受到了广泛的关注。近年来,生物技术不断发展,新的技术也不断用于微生物絮凝剂的研究,微生物絮凝剂的发展已进入一个新的历史阶段。目前研究可以看出,微生物絮凝剂主要组成成分为多糖和蛋白质,脂类和胞外DNA等物质也在生物絮凝剂中发挥了重要的作用。相对于其他学说,桥联和电性中和学说是目前国内外较为普遍接受的微生物絮凝剂絮凝机理学说。但目前来说,对于微生物絮凝剂絮凝机理的研究还不充分,研究工作主要还是通过zeta电位仪进行,希望未来有更先进的仪器用于微生物絮凝剂絮凝机理的研究。微生物絮凝剂产生菌主要分为四类:细菌、真菌、放线菌、酵母等,它们广泛分布于性污泥、土壤、深海等地方,目前大多数产絮凝菌株也是从这些地方筛选而来的。影响生物絮凝剂产量的主要因素包括:碳源、氮源、碳氮比、培养基初始pH以及培养温度,通过单因素或响应面的方法对这些因素进行优化,可进一步提高生物絮凝剂的产量。
虽然微生物絮凝剂有诸多优点,但其产量小,生产成本高,对絮凝条件要求较高,在极端的环境中容易失活。因此,目前提高产量,降低生产成本,研究微生物絮凝剂絮凝特性成为其商品化的关键所在。今后微生物絮凝剂的重点研究方向主要有以下几个方面:
(1)继续深入的研究微生物絮凝剂合成的代谢机制、絮凝机理、影响絮凝剂活性的因素,深化微生物絮凝剂的基础理论研究。在此基础上,对微生物絮凝剂进行结构改造,如氨基酸修饰的壳聚糖,将色氨酸和酪氨酸与壳聚糖相连[72],进而提高微生物絮凝剂的絮凝效率。
(2)产絮凝剂微生物的培养基原材料价格昂贵,应继续寻找更为廉价的碳源、氮源,探索更为合适产絮菌株培养条件以降低微生物絮凝剂的生产成本,为早日实现微生物絮凝剂的商品化奠定基础。
(3)将新的现代生物学技术应用于微生物絮凝剂的研究,如运用原生质体融合和基因工程技术创造出新的高产絮凝剂菌株。同时,运用代谢工程技术研究微生物絮凝剂的代谢调节机制,进而提高微生物絮凝剂产量。
[1]NTOZONKE N,OKAIYETO K,OKOLI A S,et al.A marine bacterium,Bacillussp.isolated from the sediment samples of Algoa Bay in South Africa produces a polysaccharide-bioflocculant[J].Int J Environ Res Public Health,2017,14(10):1149-1161.
[2]AGUNBIADE M O,HEERDEN E V,POHL C H,et al.Flocculating performance ofa bioflocculant produced byArthrobacter humicolain sewage waste water treatment[J].Bmc Biotechnol,2017,17(1):51-59.
[3]盛艳玲,张 强,王化军.微生物絮凝剂絮凝机理的初步研究[J].矿产综合利用,2007(2):16-19.
[4]朱晓江,尹双凤,桑军强.微生物絮凝剂的研究和应用[J].中国给水排水,2001,117(6):19-22.
[5]胡勇有.微生物絮凝剂[M].北京:化学工业出版社,2006:4.
[6]BATTA N,SUBUDHI S,LA B,et al.Isolation of a lead tolerant novel bacterial species,Achromobactersp.TL-3:assessment of bioflocculant activity[J].Indian J Exp Biol,2013,51(11):1004-1011.
[7]YE F,YE Y,LI Y,et al.Effect of C/N ratio on extracellular polymeric substances(EPS)and physicochemical properties of activated sludge flocs[J].J Hazard Mater,2011,188(1-3):37-43.
[8]ZENG D,HU D,CHENG J,et al.Preparation and study of a composite flocculant for papermaking wastewater treatment[J].J Environ Protect,2011,2(10):1370-1374.
[9]MARVASI M,VISSCHER P T,CASILLAS M L,et al.Exopolymeric substances(EPS)fromBacillussubtilis:polymersandgenesencodingtheir synthesis[J].FEMS Microbiol Lett,2010,313:1-9.
[10]CZACZYK K,MYSZKA K.Biosynthesis of extracellular polymeric substances(EPS)and its role in microbial biofilm formation[J].Polish J Environ Stud,2007,16(6):799-806.
[11]PATHAK M,SARMA H K,BHATTACHARYYA K G,et al.Characterization of a novel polymeric bioflocculant produced from bacterial utilization of n-hexadecane and its application in removal of heavy metals[J].Front Microbiol,2017,8(826):170-184.
[12]SUH H H,KWON G S,LEE C H,et al.Characterization of bioflocculantproducedbyBacillussp.DP-152[J].J Ferment Bioeng,1997,84(2):108-112.
[13]LIU J,MA J,LIU Y,et al.Optimized production of a novel bioflocculant M-C11 byKlebsiellasp.and its application in sludge dewatering[J].Environ Sci,26,2076-2083.
[14]ZHANG C,WANG X,WANG Y,et al.Synergistic effect and mecha-nismsofcompoundbioflocculantandAlCl 3saltsonenhancingChlorella regularisharvesting[J].Appl Microbiol Biotechnol,2016,100(12):5653-5660.
[15]SUTHERLAND I W.Microbial polysaccharides from Gram-negative bacteria[J].Int Dairy J,2001,11:663-674.
[16]YU L,TANG Q W,ZHANG Y J,et al.A novel Fe(III)dependent bioflocculant fromKlebsiella oxytocaGS-4-08:culture conditions optimization and flocculation mechanism[J].Sci Rep,2016,6(349):1-11.
[17]GUO J,YANG C,PENG L.Preparation and characteristics of bacterial polymer using pre-treated sludge from swine wastewater treatment plant[J].Bioresource Technol,2014,152(152C):490-498.
[18]FLEMMING H C,SCHMITT K C,MARSHALL J.Sorption properties of biofilms[J].Water Sci Technol,1996,37(4-5):207-210.
[19]PARKARK C,NOVAKOVAK J T.Characterization of lectins and bacterial adhesions in activated sludge flocs[J].Water Environ Res,2009,81(8):755-764.
[20]MORE T T,YADAV J S,YAN S,et al.Extracellular polymeric substances of bacteria and their potential environmental applications[J].J Environl Management,2014,144(144):1-25.
[21]DOMINGUES V S,MONTEIRO A S,FERREIRA G F.Solid flocculation and emulsifying activities of the lipopolysaccharide produced by Trichosporon mycotoxinivoransCLA2[J].Appl Biochem Biotechnol,2016,182:367-381.
[22]FLEMMING H C,WINGENDER J.The biofilm matrix[J].Nat Rev Microbiol,2010,8(9):623-633.
[23]刘茴茴,陈 萍,沈 萍,等.胞外DNA对细菌的聚集起重要作用[C].武汉:湖北省遗传学会代表大会暨学术讨论会,2004.
[24]MOSCOSO M,GARCÍA R,LÓPEZ E.Biofilm formation by streptococcus pneumoniae:role of choline,extracellular DNA,and capsular polysaccharide in microbial accretion[J].J Bacteriol,2006,188(22):7785-7795.
[25]胡勇有.微生物絮凝剂[M].北京:化学工业出版社,2006:81.
[26]ALJUBOORI A H R,IDRIS A,UEMURA Y,et al.Flocculation behavior and mechanism of bioflocculant produced byAspergillus flavus[J].J Environ Management,2015,150:466-471.
[27]HE J,ZOU J,SHAO Z Z,et al.Characteristics and flocculating mechanism of a novel bioflocculant HBF-3 produced by deep-sea bacterium mutantHalomonassp.V3a[J].World J Microbiol Biotechnol,2009,26:1135-1141.
[28]CHEN H G,ZHONG C Y,BERKHOUSE H,et al.Removal of cadmium by bioflocculant produced byStenotrophomonas maltophiliausing phenol-containing wastewater[J].Chemosphere,2016,155:163-169.
[29]LI W W,ZHOU W Z,ZHANG Y Z,et al.Flocculation behavior and mechanism of an exopolysaccharide from the deep-sea psychrophilic bacteriumPseudoalteromonassp.SM9913[J].Bioresource Technol,2008,99(15):6893-6899.
[30]SUN P F,HUI C,BAI N L,et al.Revealing the characteristics of a novel bioflocculant and its flocculation performance inMicrocystis aeruginosa removal[J].Sci Rep,2015,5:1-12.
[31]YIN Y J,TIAN Z M,TANG W,et al.Production and characterization of highefficiencybioflocculantisolatedfromKlebsiellasp.ZZ-3[J].Bioresource Technol,2014,171:336-342.
[32]YU G H,HE P J,SHAO L M.Characteristics of extracellular polymeric substances(EPS)fractions from excess sludges and their effects on bioflocculability[J].Bioresource Technol,2009,100(13):3193-3198.
[33]GUO J,CHEN C.Removal of arsenite by a microbial bioflocculant produced from swine wastewater[J].Chemosphere,2017,181:759-766.
[34]LI Y,XU Y,LIU L,et al.Flocculation mechanism ofAspergillus niger on harvestingofChlorella vulgarisbiomass[J].Algal Res,2017,25:402-412.
[35]LI Y,XU Y,Zheng T,et al.Flocculation mechanism of the actinomyceteStreptomycessp.hsn06 onChlorella vulgaris[J].Bioresource Technol,2017,239:137-143.
[36]LIU W,LIU C,YUAN H,et al.The mechanism of kaolin clay flocculation by a cation-independent bioflocculant produced byChryseobacterium daeguenseW6[J].Aims Environ Sci,2015,2(2):169-179.
[37]GUO J,LAU A K,ZHANG Y,et al.Characterization and flocculation mechanism of a bioflocculant from potato starch wastewater[J].Appl Microbiol Biotechnol,2015,99(14):1-7.
[38]GUO J,YU J,XIN X,et al.Characterization and flocculation mechanism of a bioflocculant from hydrolyzate of rice stover[J].Bioresour Technol,2015,177:393-397.
[39]CHEN H G,ZHONG C Y,BERKHOUSE H,et al.Removal of cadmium by bioflocculant produced byStenotrophomonas maltophiliausing phenol-containing wastewater[J].Chemosphere,2016,155:163-169.
[40]OKAIYETO K,NWODO U U.Bacillus toyonensisstrain AEMREG6,a bacterium isolated from South African Marine environment sediment samples produces a glycoprotein bioflocculant[J].Molecules,2015,20(3):5239-5259.
[41]郑怀礼.生物絮凝剂与絮凝技术[M].北京:化学工业出版社,2004:10.
[42]LI T,WANG J,WEI X L,et al.Identification and characterization of a Bacillus methylotrophicusstrain with high flocculating activity[J].Rsc Adv,2015,5(111):91766-91775.
[43]GUO J Y,LAU A K,ZHANG Y Z,et al.Characterization and flocculation mechanism of a bioflocculant from potato starch wastewater[J].Appl Microbiol Biotechnol,2015,99(14):5855-5861.
[44]FANG D,SHI C C.Characterization and flocculability of a novel proteoglycan produced byTalaromyces trachyspermusOU5[J].J Biosci Bioeng,2016,120(1):52-56.
[45]DENG S B,BAI R B,HU X M,et al.Characteristics of a bioflocculant produced byBacillus mucilaginosusand its use in starch wastewater treatment[J].Appl Microbiol Biotechnol,2003,60(5):588-593.
[46]PATHAK M,DEVI A,BHATTACHARYYA K G,et al.Production of a non-cytotoxic bioflocculant by a bacterium utilizing a petroleum hydrocarbon source and its application in heavy metal removal[J].Rsc Adv,2015,5(81):143-149.
[47]KURADE M B,MURUGESAN K,SELVAM A,et al.Sludge conditioning using biogenic flocculant produced byAcidithiobacillus ferrooxidansfor enhancement in dewaterability[J].Bioresource Technol,2016,217:179-185.
[48]TANG J,QI S,LI Z,et al.Production,purification and application of polysaccharide-based bioflocculant byPaenibacillus mucilaginosus[J].Carbohyd Polym,2014,113:463-470.
[49]ADEBAYO-TAYO B,ADEBAMI G E.Production and characterization of bioflocculant produced byBacillus clausII NB2[J].Inn Romann Food Biotechnol,2014,14:13-21.
[50]COSA S,OKOH A.Bioflocculant production by a consortium of two bacterial species and its potential application in industrial wastewater and river water treatment[J].Polish J Environ Stud,2014,23(3):689-696.
[51]NWODO U U,AGUNBIADE M O,GREEN E,et al.A freshwater streptomyces,isolated from Tyume River,produces a predominantly extracellular glycoprotein bioflocculant[J].Int J Mol Sci,2012,13(7):8679-8695.
[52]ALJUBOORI A H R,IDRIS A,ABDULLAH N,et al.Production and characterization of a bioflocculant produced byAspergillus flavus[J].Bioresource Technol,2013,127(1):489-493.
[53]LIU W J,WANG K,LI B Z,et al.Production and characterization of an intracellular bioflocculant byChryseobacterium daeguenseW6 cultured in low nutrition medium[J].Bioresource Technol,2010,101(3):1044-1048.
[54]ZHAO H J,ZHONG C Y,CHEN H G,et al.Production of bioflocculants prepared from formaldehyde wastewater for the potential removal of arsenic[J].J Environl Manage,2016,172(1):71-76.
[55]LIU W J,ZHAO C C,JIANG J H,et al.Bioflocculant production from untreated corn stover usingCellulosimicrobium cellulansL804 isolate and its application to harvesting microalgae[J].Biotechnol Biofuels,2015,170(8):1-12.
[56]PARKark C,NOVAKOVAK J T.Characterization of Lectins and Bacterial adhesins in Activated Sludge Flocs[J].Water Environment Research,2009,81(8):755-764.
[57]LI L X,MA F,ZUO H M,et al.Production of a novel bioflocculant and its flocculation performance in aluminum removal[J].Bioengineered,2016,7(2):98-105.
[58]LIU C,WANG K,JIANG J H,et al.A novel bioflocculant produced by a salt-tolerant,alkaliphilic and biofilm-forming strainBacillus agaradhaerensC9 and its application in harvestingChlorella minutissima UTEX2341[J].Biochem Eng J,2015,93:166-172.
[59]YE F X,YE Y F,LI Y.Effect of C/N ratio on extracellular polymeric substances(EPS)and physicochemical properties of activated sludge flocs[J].J Hazardous Material,2011,188(1-3):37-43.
[60]GIRI S S,HARSHINYA M,SEN S S,et al.Production and characterization of a thermostable bioflocculant fromBacillus subtilisF9,isolated from wastewater sludge[J].Ecotoxicol Environ Safety,2015,121:45-50.
[61]TIWARI O N,KHANGEMBAM R,SHAMJETSHABAM M,et al.Characterization and optimization of bioflocculant exopolysaccharide production byCyanobacteria nostocsp.BTA97 andAnabaenasp.BTA990 in culture conditions[J].Appl Biochem Biotechnol,2015,176(7):1-14.
[62]LEE J W,YEOMANS W G,ALLEN A L,et al.Biosynthesis of novel exopolymersbyAureobasidiumpullulans[J].Am Socr Microbiol,1999,65(12):5265-5271.
[63]OKAIYETO K,NWODO U U,OKOLI S A,et al.Implications for public health demands alternatives to inorganic and synthetic flocculants:bioflocculantsasimportantcandidates[J].Microbiologyopen,2016,5(2):177-211.
[64]ALJUBOORI A H R,UEMURA Y,OSMAN N B,et al.Production of a bioflocculant fromAspergillus nigerusing palm oil mill effluent as carbon source[J].Bioresource Technol,2014,171:66-70.
[65]SUTHERLAND I W.Microbial polysaccharides from gram-negative bacteria[J].Int Dairy J,2001,11(9):663-674.
[66]段军收,刘 军.以啤酒废水处理污泥为原料发酵生产微生物肥料的研究[J].中国酿造,2012,31(7):132-136
[67]GONG W X,WANG S G,SUN X F,et al.Bioflocculant production by culture ofSerratia ficariaand its application in wastewater treatment[J].Bioresource Technol,2008,99(11):4668-4674.
[68]PU S Y,QIN L L,CHE J P,et al.Preparation and application of a novel bioflocculant by two strains ofRhizopussp.using potato starch wastewater as nutrilite[J].Bioresource Technol,2014,162(6):184-191.
[69]陈 烨,陈勤怡,连 宾.啤酒厂废水的生物处理[J].食品科学,2004,25(10):41-45.
[70]LUO Y,LI C,ABBASI A M,et al.Screening of bioflocculant-producing bacteria and its application in clarification process of sugarcane juice[J].Int Sugar J,2016,118(1405):34-40.
[71]张 晶,王战勇,苏婷婷,等.微生物絮凝剂的研究及应用前景[J].环境保护科学,2006,32(4):17-20.
[72]JIA S Y,YANG Z,REN K X,et al.Removal of antibiotics from water in the coexistence of suspended particles and natural organic matters using amino-acid-modified-chitosan flocculants:A combined experimental and theoretical study[J].J Hazard Mater,2016,317:570-578.

