重症肝病患者病原菌感染分布及耐药性分析
陈茜,廖完敏,龚凤云,徐敏,熊薇,赖晓全
感染是终末期肝病常见而严重的并发症,是导致急慢性肝衰竭的重要原因[1],同时也是肝硬化失代偿期患者死亡的重要原因[2-5]。世界卫生组织报道,全球约有20亿乙型肝炎患者,其中超过3.5亿患者伴发病原菌感染[6-9]。有25%~30%的住院肝硬化患者在入院时或住院期间发生感染[10-11]。近年流行病学调查发现,肝硬化患者感染的病原菌发生了明显改变,多重耐药菌在欧洲、美国、韩国等均有出现,传统的三代头孢类抗生素针对社区感染治疗仍然有效,但对医院感染的失败率明显增加[12]。尽管在发病机制、预防和管理等方面均取得了进展,但细菌感染仍然是重症肝病患者入院和死亡的重要原因。由于重症肝病患者住院时间较长,且免疫力低下,极易发生医院感染,导致病情恶化甚至发生肝衰竭,及时有效治疗感染对肝病患者意义重大。本研究回顾性分析2014年8月-2016年11月我院感染科病房收治的重症肝病患者的临床资料、微生物培养结果等,并对其病原菌分布和药敏结果进行分析。
1 资料与方法
1.1 临床资料 回顾性分析2014年8月-2016年11月我院感染科病房收治的73例重症肝病患者,男48例,女25例,平均年龄52.5(23~84)岁,平均病程3.5(1~11)年;重型肝炎10例,肝炎12例,肝硬化36例,肝癌4例,肝硬化合并肝癌11例。
1.2 纳入及排除标准 纳入标准:①患者符合原卫生部颁发的《医院感染诊断标准》对医院感染病例的诊断;②诊断符合中华医学会《病毒性肝炎防治方案》标准;③符合医学伦理学要求。排除心功能不全及肝、肾功能障碍者。
1.3 方法 取患者各类临床标本,按常规方法分离培养细菌。菌种鉴定采用VITEK微生物全自动分析仪。药物敏感试验培养基为Mueller-Hinton琼脂培养基,抗菌药物纸片为Oxoid公司产品。血液标本采用700603型全自动血培养仪(BD公司)进行培养。采用CLSI推荐的纸片扩散法(Kirby-Bauer)进行抗菌药物检测。按照CLSI 2012年版标准判读药敏试验结果。质控菌株采用金黄色葡萄球菌ATCC 25923,大肠埃希菌ATCC 25922、35218,肺炎克雷伯杆菌ATCC700603,铜绿假单胞菌ATCC27853和白色念珠菌ATCC90028。
2 结 果
2.1 感染情况 73例重症肝病患者中,自发性腹膜炎患者33例,占45.2%(33/73),医院感染17例,占23.3%(17/73),以下依次为肺部感染、败血症及泌尿系感染。腹水中检出细菌总数13株,主要是多重耐药的革兰阳性(G+)球菌,占53.8%(7/13);引流液主要为腹腔引流液,所分离出的病原菌以多重耐药的革兰阴性(G–)杆菌为主(鲍曼不动杆菌和大肠埃希菌居多),占60.0%(9/15)。3例死亡,6例未愈,64例好转。
2.2 病原菌分布 73例重症肝病患者共分离出104株病原菌,其中多重耐药菌78株(75.0%)。104株病原菌中革兰阳性球菌28株(26.9%),以肠球菌(13株)、金黄色葡萄球菌(11株)为主;革兰阴性杆菌58株(55.8)%,以大肠埃希菌(23株)、鲍曼不动杆菌(12株)及肺炎克雷伯杆菌(10株)为主;真菌18株(17.3%)。具体情况如表1所示。
2.3 标本来源分布 标本来源如图1所示。前6位分别为痰液(20.2%,21/104)、引流液(14.4%,15/104)、血液(13.5%,14/104)、腹水(12.5%,13/104)、尿液(11.5%,12/104)、胆汁(10.6%,11/104)。

表1 分离的104株病原菌的分布及构成比Tab.1 Distribution and constituent ratio of 104 strains of pathogenic bacteria

图1 标本来源分布及构成比Fig.1 Distribution and constituent ratio of samples
2.4 临床主要分离菌对常用抗菌药物的敏感性
2.4.1 G+菌 耐甲氧西林金黄色葡萄球菌(methicillinresistantStaphylococcus aureus,MRSA)主要来源为痰和腹腔引流液标本,检出率为39.3%。MRSA株对庆大霉素、妥布霉素、利福平和左氧氟沙星的耐药率均为100%,对万古霉素、替考拉宁、替加环素比较敏感,未发现对替考拉宁和万古霉素耐药的菌株。其中1株MRSA对替加环素耐药(表2)。
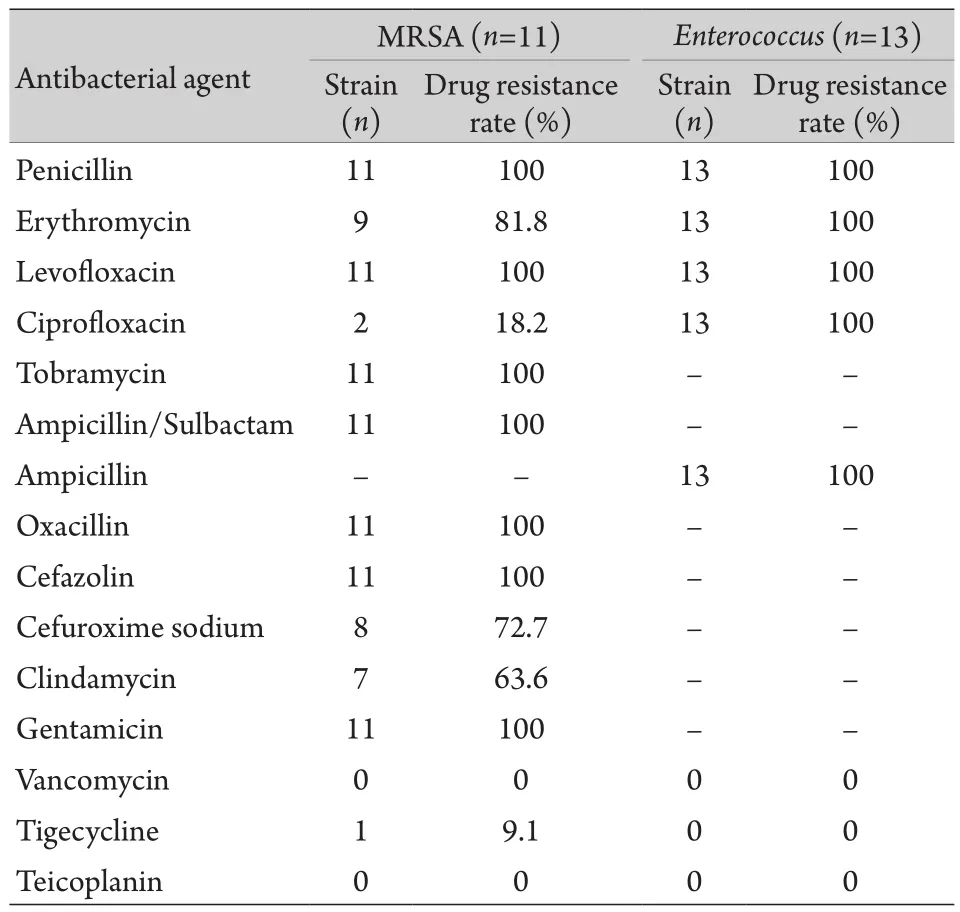
表2 革兰阳性菌对常用抗菌药物的耐药率比较Tab.2 Drug resistance rate of the main gram-positive bacteria to common antibacterial drugs
2.4.2 G–菌 G–杆菌中大肠埃希菌及肺炎克雷伯杆菌对哌拉西林、氨苄西林、头孢唑啉的耐药率较高,对替加环素、阿米卡星、亚胺培南及美罗培南的敏感性较高。鲍曼不动杆菌对常用测试药物的耐药率均在90.0%以上,对亚胺培南和美洛培南的耐药率为100%。对碳青霉烯类药物耐药G–菌20株,包括12株鲍曼不动杆菌、4株肺炎克雷伯杆菌、2株铜绿假单胞菌、1株假单胞菌属、1株不动杆菌。有4株鲍曼不动杆菌对替加环素耐药。有4株对亚胺培南和美洛培南耐药的肺炎克雷伯菌(表3)。
3 讨 论
重症肝病患者胃肠道功能出现紊乱,导致吸收不良、内分泌失调及贫血等,且通常伴有程度不同的肝肾综合征和肝性脑病,自身免疫功能较低,一旦病原菌入侵,极易发生感染。细菌性感染是肝硬化失代偿的重要原因,也是影响肝脏疾病预后的重要因素,无论肝脏疾病严重程度如何都会引起不良结局[13]。
本研究分离菌株的标本来源中痰液居首位(占20.2%),其次是引流液(占14.4%)和血液、腹水、胆汁、尿液等。引流液及腹水对诊断感染性疾病非常重要,特别是在感染科病房,可用于指导临床用药,从而改善患者预后。
本研究73例重症肝病患者共分离出104株病原菌,其中多重耐药菌78株(75.0%),提示肝病患者极易发生病原菌感染,尤其是肝硬化患者,常发生自发性细菌性腹膜炎,与Nousbaum[14]的报道一致,这可能与肝病患者体内致病菌移位或产生毒性物质,继而引起肠蠕动减慢,导致肠道致病菌过度生长,肠道相关淋巴组织免疫功能受损,肠系膜屏障功能降低有关[15-17]。本研究中自发性腹膜炎患者33例,占45.2%,腹水中检出细菌13株,主要为多重耐药的G+球菌,占53.8%(7/13),与Fiore等[18]的研究一致。文献报道,自发性腹膜炎在有腹水的慢性肝病患者中比较常见,有10%~30%的腹水患者可发展为自发性腹膜炎[19]。
近年来在欧洲G+菌感染率高达48%~62%,且导致自发性腹膜炎的微生物谱发生了明显改变,多重耐药菌比例占到22%~73%,使用第三代头孢或阿莫西林/克拉维酸经验性治疗疗效欠佳,不再被认为是治疗的金标准[18]。G+球菌和多重耐药菌是引起自发性腹膜炎的常见病原体,院内或非院内自发性腹膜炎都应引起高度重视,选择抗生素时应考虑全覆盖,抗生素级别也应有所提高[20-21]。近年来国外研究证实,对多重耐药菌感染高危人群需要使用广谱抗生素如碳青霉烯类或替加环素,以及针对特定病原菌的药物(糖肽类、利奈唑胺、达托霉素、阿米卡星及多黏菌素);对于肝硬化患者,建议早期降阶梯治疗,防止多重耐药菌的传播[22]。
对肝病患者如何有效进行抗感染治疗是医务人员面临的一大难题。重症肝病患者发生感染时往往病情较重,需要及时准确的经验性抗菌治疗。由于多重耐药的出现,目前β-内酰胺类和喹诺酮类药物在院内及医疗相关感染的治疗中通常是无效的。本研究结果显示,占全部菌株27.0%的G+菌(主要为肠球菌及金黄色葡萄球菌)对常用抗菌药物如β-内酰胺类、氟喹诺酮类也呈高度耐药,针对G+菌的经验性抗菌治疗可首选万古霉素或替考拉宁。G+菌引起的感染日趋增长,本组资料显示金黄色葡萄球菌引起的感染增多,成为较难控制的病原菌,这与大量头孢菌素和三代头孢的应用有一定关系。近年来已有耐万古霉素MRSA的报道。在本研究中检测到2株MRSA,其中1株合并替加环素耐药,此例患者为女性肝硬化合并肝癌患者,伴有自发性腹膜炎及腹腔感染,由腹腔引流液检出,考虑为万古霉素的广泛应用所致。因此,合理使用抗菌药物对降低院内感染至关重要。

表3 革兰阴性菌对常用抗菌药物的耐药率比较Tab.3 Drug resistance rate of the main gram-negative bacteria to common antibacterial drugs (%)
本研究73例患者中,肝硬化患者47例(64.4%),引流液主要为腹腔引流液,分离出的病原菌以多重耐药的G–杆菌为主(鲍曼不动杆菌和大肠埃希菌居多),占60.0%(9/15)。大肠埃希菌(占22.0%)对氨苄西林、氨苄西林/舒巴坦、磺胺唑/甲氧苄啶、头孢噻肟和哌拉西林、环丙沙星等抗菌药物的耐药率均>60.0%。G–菌中分离数排2、3位的鲍曼不动杆菌及肺炎克雷伯杆菌对常用抗菌药物也呈现出高度耐药。因此,针对G–菌(大肠埃希菌、肺炎克雷伯杆菌)的经验性抗菌治疗可采取降阶梯方案,选用碳青霉烯类、替加环素等药物,待药敏结果出来后再调整用药。
本研究共分离出碳青霉烯耐药G–菌20株,包括12株鲍曼不动杆菌、4株肺炎克雷伯杆菌、2株铜绿假单胞菌、1株假单胞菌属、1株不动杆菌。对替加环素耐药的G–菌包括4株鲍曼不动杆菌。此外,还发现4株对亚胺培南和美洛培南耐药的肺炎克雷伯菌,应引起临床的高度重视。研究显示,肝硬化患者感染的病原菌谱主要是多重耐药菌,其中G–的大肠埃希菌占大多数,传统的抗生素治疗对肝硬化患者无效,由多重耐药菌导致的肝病患者死亡发生率明显增加[23]。
鲍曼不动杆菌广泛分布于水、土壤等环境以及医院和人体皮肤表面,可长期存活,引起各种院内感染,包括肺炎、菌血症、伤口感染、脑膜炎等。本次调查显示,我院鲍曼不动杆菌的分离率已超过肺炎克雷伯杆菌,且耐药率明显增加,对所测试抗菌药物的耐药率已达到91.0%以上。
本研究分离出真菌18株,占总检出菌株的17.3%,主要为白色假丝酵母菌。重症肝病患者在发生真菌感染前常伴细菌性感染,且抗菌药物使用时间往往在2周以上,感染部位主要为口腔和肺部。机体对真菌的易感性与宿主防御功能有关,本组患者大部分为危重症患者,容易发生感染,导致机体免疫力下降,体内正常菌群失调,进而为真菌感染提供了机会。对该类患者尤其应注意口腔和肺部的监护,及时合理应用抗真菌药物,降低口腔和肺部感染的概率。
此外,抗生素的使用会增加多重耐药菌感染的风险,早期的抗生素治疗应根据多重耐药菌的存在与否、感染的严重程度并结合当地流行病学情况进行调整。密切监测感染科肝病患者的细菌耐药性,了解感染的常见致病菌以及其对抗生素的敏感性,对指导临床合理使用抗生素、预防双重感染和防止细菌耐药性的产生有重要价值。
[1]Sun L, Gao HB, Zhao P. Research progress in metabolic activity of natural killer cells in patients with chronic hepatitis B virus infection[J]. Med J Chin PLA, 2017, 42(7): 656-660. [孙丽, 高会斌, 赵平. 慢性乙型肝炎患者自然杀伤细胞代谢活性研究进展[J]. 解放军医学杂志, 2017, 42(7): 656-660.]
[2]Rossitto G, Piano S, Rosi S,et al. Life-threatening coagulopathy and hypofibrinogenaemia induced by tigecycline in a patient with advanced liver cirrhosis[J]. Eur J Gastroenterol Hepatol,2014, 26(6): 681-684.
[3]Jalan R, Yurdaydin C, Bajaj JS,et al. Toward an improved definition of acute-on-chronic liver failure[J]. Gastroenterology,2014, 147(1): 4-10.
[4]Chen L, Yuan H, Zhu LD,et al. Influence of second infection in risk of death of hospitalized patients with cirrhosis[J]. J Jilin Univ (Med Ed), 2015, 41(4): 820-824. [陈琳, 袁宏, 朱陇东,等. 院内二次感染对肝硬化患者死亡风险水平的影响[J].吉林大学学报(医学版), 2015, 41(4): 820-824.]
[5]Salerno F, Borzio M, Pedicino C,et al. The impact of infection by multidrug-resistant agents in patients with cirrhosis. A multicenter prospective study[J]. Liver Int, 2017, 37(1): 71-79.
[6]Abeje G, Azage M. Hepatitis B vaccine knowledge and vaccination status among health care workers of Bahir Dar City Administration, Northwest Ethiopia: a cross sectional study[J].BMC Infect Dis, 2015, 15: 30.
[7]Adekanle O, Ndububa DA, Olowookere SA,et al. Knowledge of hepatitis B virus infection, immunization with hepatitis B vaccine, risk perception, and challenges to control hepatitis among hospital workers in a Nigerian Tertiary Hospital[J].Hepat Res Treat, 2015, 2015: 439867.
[8]Chen HT, Yang Z, Wu SP. Expression levels of IL-22 mRNA in PBMCs of patients at different HBV infection phases and their significances[J]. J Jilin Univ (Med Ed), 2016, 42(3): 551-555.[陈洪涛, 杨智, 吴诗品. 慢性乙肝病毒感染各阶段患者外周血单个核细胞中IL-22 mRNA的表达水平及其临床意义[J].吉林大学学报(医学版), 2016, 42(3): 551-555.]
[9]Hamissi J, Tabari ZA, Najafi K,et al. Knowledge, attitudes and practice of hepatitis B vaccination among Iranian dentists[J]. Int J Collab Res Intern Med Public Health, 2014, 6(7): 199-206.
[10]Fernandez J, Arroyo V. Bacterial infections in cirrhosis: A growing problem with significant implications[J]. Clinical Liver Dis, 2013, 2(3): 102-105.
[11]Bartoletti M, Giannella M, Lewis RE,et al. Bloodstream infections in patients with liver cirrhosis[J]. Virulence, 2016,7(3): 309-319.
[12]Acevedo J. Multiresistant bacterial infections in liver cirrhosis:Clinical impact and new empirical antibiotic treatment policies[J]. World J Hepatol, 2015, 7(7): 916-921.
[13]Dionigi E, Garcovich M, Borzio M,et al. Bacterial infections change natural history of cirrhosis irrespective of liver disease severity[J]. Am J Gastroenterol, 2017, 112(4): 588-596.
[14]Nousbaum JB. Spontaneous bacterial peritonitis in patients with cirrhosis[J]. Presse Med, 2015, 44(12): 1235-1242.
[15]Velkey B, Vitalis E, Vitalis Z. Spontaneous bacterial peritonitis[J]. Orv Hetil, 2017, 158(2): 50-57.
[16]Wiest R, Lawson M, Geuking M. Pathological bacterial translocation in liver cirrhosis[J]. J Hepatol, 2014, 60(1): 197-209.
[17]Pericleous M, Sarnowski A, Moore A,et al. The clinical management of abdominal ascites, spontaneous bacterial peritonitis and hepatorenal syndrome: a review of current guidelines and recommendations[J]. Eur J Gastroenterol Hepatol, 2016, 28(3): e8-e10.
[18]Fiore M, Maraolo AE, Gentile I,et al. Current concepts and future strategies in the antimicrobial therapy of emerging Grampositive spontaneous bacterial peritonitis[J]. World J Hepatol,2017, 9(30): 1166-1175.
[19]Sola E, Sole C, Gines P. Management of uninfected and infected ascites in cirrhosis[J]. Liver Int, 2016, 36 (Suppl 1):109-115.
[20]Dever JB, Sheikh MY. Review article: spontaneous bacterial peritonitis--bacteriology, diagnosis, treatment, risk factors and prevention[J]. Aliment Pharmacol Ther, 2015, 41(11): 1116-1131.
[21]Oliveira AM, Branco JC, Barosa R,et al. Clinical and microbiological characteristics associated with mortality in spontaneous bacterial peritonitis: a multicenter cohort study[J].Eur J Gastroenterol Hepatol, 2016, 28(10): 1216-1222.
[22]Fernandez J, Acevedo J. New antibiotic strategies in patients with cirrhosis and bacterial infection[J]. Expert Rev Gastroenterol Hepatol, 2015, 9(12): 1495-1500.
[23]Klimova K, Padilla C, Avila JC,et al. Epidemiology of bacterial infections in patients with liver cirrhosis. Experience in a Spanish tertiary health center[J]. Biomedica, 2016, 36(1): 121-132.

