非酒精性脂肪性肝病不伴糖尿病患者铁负荷与病情的相关性研究 吴县斌1* 苏东星1*
梁艺 庞丽兴 梁肖兰 陆才金


[摘要] 目的 探讨非糖尿病患者其铁负荷水平与非酒精性脂肪性肝病(NAFLD)的相关性。 方法 选取2016年1月~2017年12月广西医科大学第三附属医院(以下简称“我院”)募集的不伴糖尿病的NAFLD患者152例为观察组;选取同期我院体检健康者80名为对照组。记录或检测两组一般资料、生化指标、血清铁蛋白(SF)、血清铁(SI)、血清铁调素(HEPC)水平,并通过氢质子磁共振波谱测定肝脏脂肪含量(LFC);分析铁负荷指标与其他指标的关系。 结果 观察组SF、SI明显高于对照组,HEPC明显低于对照组,差异有统计学意义(P < 0.05)。校正年龄、性别后,SF、SI均与LFC呈正相关(r = 0.461,P < 0.001;r = 0.275,P = 0.001),HEPC与LFC呈显著负相关(r = -0.479,P < 0.001)。SI升高是肝功能损伤的独立危险因素(OR = 1.074,P < 0.05,95%CI:1.022~1.130)。SF、SI及HEPC与NAFLD活动度积分呈弱相关(r = 0.172,P = 0.036;r = 0.192,P = 0.019;r = -0.236,P = 0.004),但上述相关系数均较低,缺乏临床实际意义。 结论 非糖尿病患者铁负荷水平上升与LFC增加、肝功能损伤有关,但其与患者肝脏炎症程度无明显相关性。
[关键词] 非酒精性脂肪性肝病;铁负荷;肝功能;铁蛋白质类
[中图分类号] R575.5 [文献标识码] A [文章编号] 1673-7210(2018)12(a)-0097-05
近年来,非酒精性脂肪性肝病(NAFLD)发病率提升迅速,且呈低龄化发病趋势,其发病与多种因素相关[1-3]。铁主要以血清铁蛋白(SF)的形式存储。SF不仅是调节铁代谢的重要媒介,也是一种急性期蛋白,可因炎性反应而上升[4]。多项研究[5-6]发现NAFLD患者多存在SF升高,但SF升高与NAFLD病情发展程度的关系却并不明确。部分报道认为铁超载可加速肝脂肪变性[7],亦有报道[8]提示SF对诊断肝脏纤维化价值有限。因此,本研究重点探讨了中国成年非糖尿病患者铁负荷与NAFLD的相关性。
1 资料与方法
1.1 一般资料
选取2016年1月~2017年12月于广西医科大学第三附属医院(以下简称“我院”)募集的152例成年NAFLD患者为观察组;选取同期我院健康体检者80名为对照组。本研究经医院医学伦理委员会批准,患者或家属均知情并签署同意书。观察组纳入标准:①参考《非酒精性脂肪性肝病诊疗指南》[9]确诊为NAFLD;②自愿参与本研究,依从性高,能够有效获取各项观察指标;③年龄>18岁;④血压正常,无高血压史。观察组排除标准:①其他类型肝病患者;②伴糖尿病患者;③近期接受保肝降酶治疗的患者;④近期输血、应用铁剂或感染者;⑤其他明确的急慢性炎症者。对照组纳入标准:①年龄及性别与观察组匹配;②身体健康,无慢性病史;③研究依从性高。对照组不另设排除标准。观察组中男97例,女55例;年龄28~89岁,平均(58.38±13.59)岁,其中<40岁者14例,40~49岁者27例,>49~59岁者36例,>59~69岁者42例,>69岁者33例。对照组中男52名,女28名;年龄33~85岁,平均(57.28±11.59)岁,其中<40歲者5名,40~49岁者15名,>49~59岁者24名,>59~69岁者26名,>69岁者10名。两组性别构成、年龄比较,差异无统计学意义(P > 0.05),具有可比性。
1.2 观察指标与检测方法
1.2.1 一般资料 统计所有对象性别、年龄、病史、体重指数(BMI)、腰围、血压等。
1.2.2 生化指标 所有对象禁食10 h以上,取晨起空腹静脉血,以AU680全自动生化分析仪及配套生化试剂(美国Beckman Coulter )检测总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、谷草转氨酶(AST)、谷丙转氨酶(ALT)、γ-谷氨酰转移酶(GGT)水平。采用酶联免疫吸附试验(ELISA)检测SF和、血清铁调素(HEPC)水平,SF检测试剂盒购自上海德波生物技术有限公司,HEPC检测试剂盒购自美国R&D;。采用亚铁嗪比色法检测血清铁(SI)水平,检测试剂盒购自上海丰汇医学科技有限公司。采用葡萄糖氧化酶法检测空腹血糖(FPG)水平,检测试剂盒购自北京普利莱基因技术有限公司。采用放射免疫法检测空腹胰岛素(FINS)水平,检测试剂盒购自北京北方生物技术研究所。采用稳态模型计算胰岛素抵抗指数(HOMA-IR),HOMA-IR=FPG×FINS/22.5。
1.2.3 观察组肝脏脂肪含量 采用氢质子磁共振波谱测量肝脏脂肪含量(LFC),LFC=脂肪峰下面积/(脂肪峰下面积+水峰下面积)×100%,该方案诊断脂肪肝切点为LFC≥5.56%[10],主要检测仪器为Propeller 1.5T HD MR扫描仪(美国GE)。
1.2.4 观察组肝脏病理学检查结果 统计患者NAFLD活动度积分(NAS)[11]。
1.3 统计学方法
采用SPSS 19.0统计学软件进行数据分析,计量资料符合正态分布用均数±标准差(x±s)表示,两组间比较采用t检验;偏态分布计量资料采用中位数(M)或四分位数间距(P25,P75)表示,两组间比较采用秩和检验。计数资料用率表示,组间比较采用χ2检验;铁负荷指标与其他指标的相关性采用双变量相关性分析、偏相关分析及多重线性相关分析;肝功能损伤的影响因素采用Logistic回归分析,以P < 0.05为差异有统计学意义。
2 结果
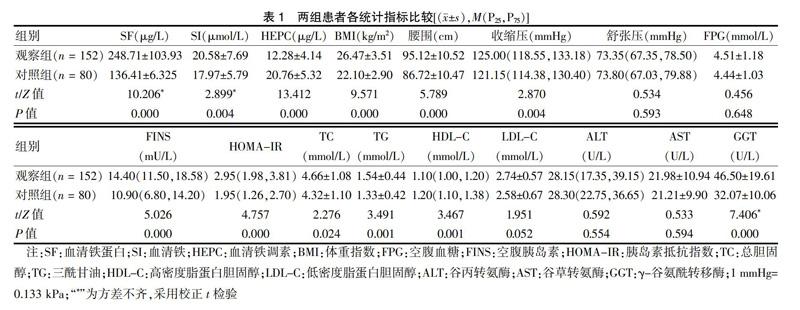
2.1 两组患者各统计指标比较
觀察组SF、SI、BMI、腰围、收缩压、FINS、HOMA-IR、TC、TG、GGT明显高于对照组,HEPC、HDL-C明显低于对照组,差异有统计学意义(P < 0.05)。见表1。
2.2 观察组患者铁负荷指标与LFC相关性分析
Pearson相关分析提示,SF、SI均与LFC呈正相关(r = 0.461,P < 0.001;r = 0.275,P =0.001),HEPC与LFC呈负相关(r = -0.479,P < 0.001)。分别以SF、SI及LFC为因变量,以BMI、腰围、血压、FPG、FINS、HOMA-IR、TC、TG、HDL-C、LDL-C、ALT、AST、GGT、LFC为自变量,矫正性别、年龄后,SF、SI及HEPC均仍与LFC呈明显的线性相关(P < 0.05)。见表2~4。
2.3 观察组患者铁负荷指标与肝功能损伤的关系
ALT、AST、GGT中任一项超标均判定为肝功能损伤。152例患者中81例(53.29%)出现肝功能损伤,肝功能损伤患者SF、SI明显高于肝功能正常患者,HEPC明显低于肝功能正常患者,见表5。以是否伴肝功能损伤(是=1,否=0)为因变量,铁负荷指标为自变量(按连续变量赋值),矫正年龄、性别等其他观察指标,经Logistic回归分析,发现SI、FINS是肝功能损伤的独立危险因素(P < 0.05)。经Hosmer-Lemeshow检验,该回归模型有较良好的拟合效能(χ2 = 7.444,P = 0.490),见表6。
2.4 观察组患者铁代谢指标与肝脏病理学检查结果的相关性
病理检测有13例患者NAS积分≥5分,18例NAS积分3~4分,其余90例NAS积分均<3分。经Spearman相关性分析,SF、SI与NAS呈正相关(r = 0.261,P = 0.001;r = 0.289,P < 0.001),HEPC与NAS呈负相关(r = -0.286,P < 0.001)。矫正性别、年龄,行偏相关分析,SF、SI与NAS仍呈正相关(r = 0.172,P = 0.036;r = 0.192,P = 0.019),HEPC与NAS仍呈负相关(r = -0.236,P = 0.004),但相关系数普遍较低,其临床意义可能较小。
3 讨论
NAFLD近年来发病率呈上升趋势,且有年轻化的趋势[12]。目前尚未完全探明其发病机制,但已明确胰岛素抵抗与其密不可分,两者互为因果关系,相互作用诱发炎性反应和氧化应激[13-18]。有报道指出胰岛素抵抗与血清SF有关[19]。本研究虽未直接观察到SF与HOMA-IR的相关性,但SF、HEPC均与FINS呈线性相关;同时刘志平等[20]直接观察到SF是HOMA-IR的独立危险因素。这均提示SF可能也与NAFLD的发生及发展有关。
本研究观察组SF、SI明显高于对照组,而HEPC明显低于对照组,与欧强等[21]报道一致,提示NAFLD患者普遍存在铁超载现象。铁含量升高可启动和催化Fenton型Haber-weiss反应,导致脂质过氧化。肝脏是铁在人体的主要存储器官,故铁超载的主要损伤靶器官,过量的铁可损伤肝细胞、加重脂肪肝。同时,受损的肝细胞中存储的铁又会释放入血,导致SF进一步升高,加重铁超载,形成恶性循环。本研究发现NAFLD患者SF、SI均与LFC呈线性正相关,HEPC与LFC呈线性负相关,与张林杉等[22]针对2型糖尿病伴NAFLD的报道结论一致,提示铁过载与肝脏脂肪沉积有关。肝脏脂肪沉积可直接导致肝功能损伤。本研究中SI是肝功能损伤的独立危险因素,SF、HEPC被多元回归分析排除,可能与各因素存在相互影响,从而导致SF、HEPC的影响作用被掩盖有关。
有研究[23]发现SF与NAFLD患者肝脏病理组织学损伤及纤维化程度有关,但本研究并不支持此结论。本研究发现SF、SI及HEPC仅与NAS呈较低的相关性,可能并不具备临床实际意义。推测可能是因为SF等指标反映的是机体的整体铁负荷,但肝脏铁其沉积的形式与NAFLD不同病理特征有关。报道[24-25]显示,与肝细胞相比,网状细胞内的铁沉积更容易导致炎症及进展性纤维化,而SF等指标难以特异性反映网状细胞内的铁沉积,故与NAS的相关性较低。但亦有国内报道[3]显示,SF与NAFLD病理改变严重程度密切相关,这种差异可能与因纳入样本量不足所导致的偏倚有关,提示临床需开展更大规模的对照研究,深入分析铁负荷与NAFLD的相关性。
综上所述,对不伴糖尿病的NAFLD患者,铁负荷与肝脏脂肪沉积水平及肝脏功能损伤程度密切相关,提示限制铁摄入量可能有助于改善脂肪肝。患者铁负荷与NAS评分无关,提示铁负荷与患者肝脏炎性反应程度无关,但该结论需要进一步论证。
[参考文献]
[1] Rinella ME. Nonalcoholic fatty liver disease:a systematic review [J]. JAMA,2015,313(22):2263-2273.
[2] 卢慧芳,冯仲成.广宁地区非酒精性脂肪肝相关危险因素的Logistic回归分析[J].中国医学创新,2016,13(28):67-70.
[3] 郑乐群,卢翔,张特.初诊2型糖尿病合并非酒精性脂肪肝脂肪含量的相关因素研究[J].中国现代医生,2017,55(9):20-22,27.
[4] Park SK,Choi WJ,Oh CM,et al. Association between serum ferritin levels and the incidence of obesity in Korean men:a prospective cohort study [J]. Endocr J,2014,61(3):215-224.
[5] 张闻平,吴静,任美杰,等.非酒精性脂肪肝病与血清铁及铁蛋白的相关性研究[J].首都医科大学学报,2015,36(5):778-781.
[6] Utzschneider KM,Largajolli A,Bertoldo A,et al. Serum ferritin is associated with non-alcoholic fatty liver disease and decreased Β-cell function in non-diabetic men and women [J]. J Diabetes Complications,2014,28(2):177-184.
[7] Parikh P,Patel J,Ingle M,et al. Serum ferritin levels predict histological severity in patients with nonalcoholic fatty liver disease in India [J]. Indian J Gastroenterol,2015,34(3):200-208.
[8] Angulo P,George J,Day CP,et al. Serum ferritin levels lack diagnostic accuracy for liver fibrosis in patients with nonalcoholic fatty liver disease [J]. Clin Gastroenterol Hepatol,2014,12(7):1163-1169.
[9] 中华医学会肝病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊疗指南(2010年修订版)[J].中华肝脏病杂志,2010,18(3):163-166.
[10] 瞿欢佳,王磊,金沛桦,等.氢质子磁共振波谱在脂肪性肝病肝脏甘油三酯含量测定中的价值及其影响因素[J].中华肝脏病杂志,2017,25(11):858-863.
[11] European Association for the Study of the Liver (EASL),European Association for the Study of Diabetes (EASD),European Association for the Study of Obesity (EASO). EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease [J]. J Hepatol,2016,59(6):1121-1140.
[12] 罗春华,李国静,周军,等.宜昌市职业人群非酒精性脂肪性肝病流行病学调查及其与代谢综合征相关性研究[J].重庆医学,2016,45(3):390-392.
[13] 曹一显,李良平.非酒精性脂肪性肝炎与内皮功能异常和动脉粥样硬化的关系[J].中华肝脏病杂志,2014,22(3):205-208.
[14] 吴玉梅.上海市某疗养院体检人群体重指数与血脂水平及非酒精性脂肪肝关系的调查研究[J].中国现代医生,2017,55(30):121-123,130.
[15] 张富春,曾庆新.非酒精性脂肪肝患者血浆Fetuin-A表达对动脉粥样硬化与心血管事件发生的影响研究[J].中国医学创新,2017,14(31):44-47.
[16] 梅歆.2型糖尿病合并非酒精性脂肪肝与颈动脉粥样硬化关系的研究[J].中国医学创新,2016,13(26):112-115.
[17] 张梅,薛亚妮,冯旭霞.胰岛素与胰岛素促泌剂对2型糖尿病合并非酒精性脂肪肝的影响[J].中国医药导报,2016,13(11):138-141.
[18] 莫小庆,黄春,宋青青,等.2型糖尿病伴非酒精性脂肪肝患者胱抑素C与胰岛素抵抗的相关性研究[J].中国医药导报,2017,14(24):78-80.
[19] Li J,Cao Y. Serum ferritin as a biomarker for diabetes and insulin resistance:a further study [J]. Acta Diabetol,2015,52(2):417-419.
[20] 刘志平,张金华.非酒精性脂肪性肝病患者胰岛素抵抗与血清铁蛋白、γ-谷氨酰转肽酶的关系[J].胃肠病学和肝病学杂志,2015,24(8):917-919.
[21] 欧强,王洋,徐燕华,等.非酒精性脂肪性肝病患者血清铁代谢指标的变化及临床意义[J].临床肝胆病杂志,2016,32(12):2360-2363.
[22] 张林杉,卞华,颜红梅,等.2型糖尿病患者铁负荷与非酒精性脂肪性肝病的相关性研究[J].中华内分泌代谢杂志,2014,30(1):8-12.
[23] Kowdley KV,Belt P,Wilson LA,et al. Serum ferritin is an independent predictor of histologic severity and advanced fibrosis in patients with nonalcoholic fatty liver disease [J]. Hepatology,2012,55(1):77-85.
[24] Nelson JE,Wilson L,Brunt EM,et al. Relationship between the pattern of hepatic iron deposition and histological severity in nonalcoholic fatty liver disease [J]. Hepatology,2011,53(2):448-457.
[25] 沈潔,蔡静明,孙梦云,等.铁超载对非酒精性脂肪肝病HepG2细胞模型中Hepcidin和 Fpn-1的影响[J].癌变·畸变·突变,2017,29(3):184-188.
(收稿时间:2018-03-26 本文编辑:王 蕾)

