双指标优化黑曲霉液态发酵条件及降解棉秆效果
郭 凯,侯 敏,包慧芳,王 宁,詹发强,杨 蓉,杨文绮,龙宣杞,崔卫东
(1.新疆大学生命科学与技术学院,乌鲁木齐 830052;2.新疆农业科学院微生物应用研究所/新疆特殊环境微生物实验室,乌鲁木齐 830091)
0 引 言
【研究意义】纤维素酶是一类能降解纤维素ß-1,4一葡萄糖苷键,将纤维素分解成纤维寡糖,纤维二糖和葡萄糖等多组分的总称[1-2]。根据纤维素酶的结构特性和各组分功能,可以将其划分为三大类[3-5]:外切葡聚糖酶,内切葡聚糖酶和ß-葡萄糖苷酶。测定纤维素酶活力时,一般通过测定内切葡聚糖(羧甲基纤维素酶)来表征纤维素酶样品的糖化能力,但是其不能代表总纤维素酶活力高低。总酶活是以不溶性纤维素滤纸为底物来测定。滤纸酶活力可表征菌株分解纤维的能力及其纤维素酶系3类酶组分的协同作用[6-7]。1987 年,国际纯粹与应用化学联合会(IUPAC)确认并公布 FPase 力测定法为标准方法[8-10]。【前人研究进展】响应面方法(Responsesurfacemethodology)是利用合理的试验设计,通过试验所得出的数据,采用多元二次回归方程来建立因素与响应值之间的函数关系,通过分析来寻找最优参数,能充分考虑各因素之间的交互作用。因而,将响应面法应用于微生物培养基的优化工作有重要的意义[11-12]。【本研究切入点】目前有很多关于黑曲霉产纤维素酶液体发酵条件研究,但大多以CMCase为指标,不能完全说明黑曲霉总的酶活力[13-14]。研究借助Desigin-Expert软件,以FPAase和CMCase为指标,对黑曲霉产纤维素酶液体发酵条件进行优化。【拟解决的关键问题】通过双指标利用响应面法优化黑曲霉液体发酵的产酶能力,分析黑曲霉产纤维素酶能力,提高黑曲霉对棉花秸秆降解作用。
1 材料与方法
1.1 材 料
1.1.1 菌种
黑曲霉ZD由新疆农业科学院微生物应用研究所分离,现保藏于新疆农业科学院微生物应用研究所菌种室。
滤纸:滤纸为双星滤纸,将滤纸剪成1 cm×6 cm,质量为(50±0.5) mg的小条,用1%醋酸浸泡24 h,用碘液检查确定无淀粉后,用2%碳酸氢钠洗至中性,晾干备用。
葡萄糖标准液:称取无水葡萄糖1 g(精确至0.001),加柠檬酸盐缓冲液溶解,定容至100 mL。
1.1.2 培养基
PDA培养基[15-16]:马铃薯200 g、琼脂15~20 g、葡萄糖20 g,水1 000 mL,pH值自然。马铃薯去皮,切成块煮沸0.5 h,然后用纱布过滤,再加糖,融化后补足水至1 000 mL。121 ℃、30 min灭菌(液体培养基不用加琼脂)。
斜面培养基:PDA培养基。
种子培养基:PDA液体培养基;
产酶初始液体培养基[17]: CMCNa 1 g/100 L,蛋白胨0.5 g/100 mL,硫酸镁0.05 g/100 mL,磷酸氢二钾0.1 g/100 mL。
1.2 方 法
1.2.1 培养
将菌株接种于PDA培养基上,28℃培养96 h后,用接种环刮取表面孢子获得孢子一环并接入100 mL种子培养基(250 mL三角瓶)中,30℃、150 r/min培养48 h后得种子液,再将种子液以5%的接种量接入液体产酶培养基(250 mL摇瓶),30℃、150 r/min培养168 h[18]。
1.2.2 标准曲线制备
量取葡萄糖标准液0、2、3、4、6、8、10 mL,用柠檬酸盐缓冲液定容至50 mL,配成浓度为0~2 mg/mL系列。
分别吸取葡萄糖标准系列溶液各1 mL于25 mL容量瓶中,各加2 mL水和3 mL DNS试剂,沸水浴5 min,冷却至室温,用水定容至25 mL,在540 nm波长下测光密度值(OD值),并用葡萄糖含量(mg)与测定值(OD)作图,即为标准曲线y=0.009 6x-0.029 4(R2=0.992 7),式中:y为葡萄糖含量(mg/mL),x为酶解反应产物溶液经显色后所测的OD540nm值。R2=0.992 7说明在葡萄糖质量浓度和吸光度值在一定范围内线性关系较好[19-20]
1.2.3 酶活力
将酶相对比活力较高的菌株制备菌悬液,取 10 mL,12 000 r/min,离心10 min,上清液即为粗酶液。
羧甲基纤维素酶活力测定:取 2 mL羧甲基纤维素溶液于 25 mL刻度试管中,加 0.5 mL粗酶液,混合均匀,50℃,水浴30 min后,再加入 3 mL DNS试剂,沸水浴5 min,定容25 mL,在540 nm 下测定其吸光值(A540)。酶活力计算:以每1 min产生1 μmoL还原糖定义为1个酶活力单位(U)。对照组为 100℃水浴灭活 5 min的粗酶液。
羧甲基纤维素钠酶活力(U/mL)=葡萄糖含量(mg)×5.56/反应液中酶的添加量(mL)×时间(h)。
式中:5.56代表1 mg葡萄糖物质的量。
滤纸酶活力测定[21]:取4支洗净烘干的25 mL具塞刻度试管(一支空白管,三支样品管),编号后将滤纸条卷成小卷,分别放入四支试管的底部,分别向四支管中各加入质量分数为1%的柠檬酸盐缓冲液1.5 mL,分别准确加入稀释好的待测酶液0.5 mL于三支样品管中(空白管不加),使管内溶液浸没滤纸,盖塞。将四支试管同时置于(50±0.1)℃水浴中,准确计时,反应60 min,取出。反应完毕后迅速、准确地向各管中加入DNS试剂2 mL,于空白管中准确加入稀释好的待测酶液0.5 mL,摇匀。将四支管同时放入沸水浴中,准确计时,加热5 min,取出,迅速冷却至室温,用水定容至25 mL。以空白管 (对照液)调仪器零点,在分光光度计波长540 nm下,分别测量三支样品管中样液的吸光度,取平均值。通过查标准曲线或用线性回归方程求出还原糖的含量。酶活力单位定义为1 h水解生成1 mg的酶量定义为1个酶活单位。
滤纸酶活力(U/mL)=葡萄糖含量(mg)×5.56/反应中酶液的添加量(mL)×反应时间(h)
公式中5.56代表1 mg葡萄糖物质的量。
1.2.4 液体发酵条件下棉秆纤维素和半纤维素
将最优条件下获得的黑曲霉菌液,以10%接种量接入含有棉花秸秆作为唯一碳源的液体培养基,测定其第3、5、7、10、15、20、30 d的纤维素(Cellulose,C)含量和半纤维素(Hemicellulose,HC)含量,并计算降解率。按照Van Soeat法测定纤维素和半纤维素含量[22-23]。
1.2 方 法
1.2.1 试验设计
1.2.1.1 单因素试验
分别对碳源1%(CMCNa、蔗糖、葡萄糖、微晶纤维素、淀粉)、氮源0.5%(酵母粉、牛肉膏、硫酸铵、硝酸钠、蛋白胨)、无机盐0.1%(K2HPO4、KH2PO4、NaH2PO4、Na2HPO4)、培养时间(72、96、120、144、168、196 h)、温度(25、30、35℃)、转速(125、150、175、200 r/min)、接种量(3、5、7、9、11%)进行单因素试验。在初始pH 7.0、30℃、150 r/min,144 h的培养条件下,进行单因素试验的初步优化。
1.2.1.2 Plackett-Burman(PB)设计
分别选取以上7个因素的高低2个水平,通过Design-Expert软件选用Factors=7,Runs=12的PB设计,以CMCase和FPAase为响应值。通过比较各因素的显著性水平,筛选出对产酶影响较为显著的因素[24-25]。
1.2.1.3 Box-Benhken中心组合设计
用中心组合设计进行响应面试验,通过试验数据拟合响应面模型,得到二次多项式,并确定最佳发酵条件。二次多项式为描述响应量(应变量)和自变量关系的经验模型。
1.3 数据处理
所有处理做3个重复,用Origin做试验数据的误差分析,用Design-Expert对PB试验和中心组和设计进行数据分析。
2 结果与分析
2.1 葡萄糖标准曲线
研究表明,得到线性回归曲线为:y=0.009 6x-0.029 4,R2=0.992 7,说明曲线可信度较高,可以应用。不同浓度的葡萄糖溶液在540 nm处测定的吸光度值为,当葡萄糖含量0、20、30、40、60、80和100 mg/mL时,OD值为0、0.152、0.243、0.342、0.524、0.794和0.921。图1
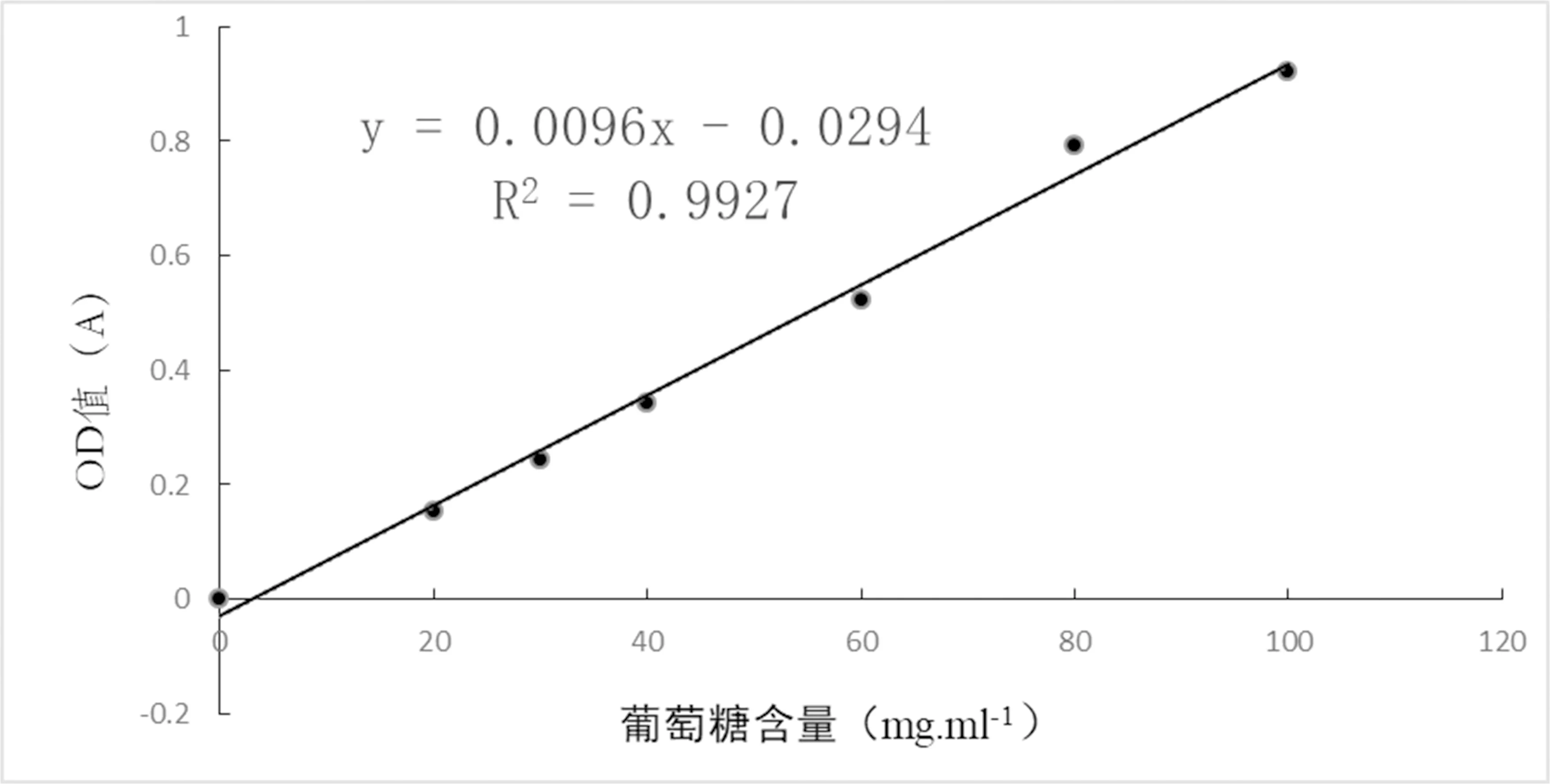
图1 葡萄糖标准曲线
Fig.1 Glucose standard curve
2.2 单因素试验筛选结果
研究表明,在碳源为淀粉、氮源为蛋白胨、无机盐K2HPO4、培养时间168 h、接种量7%、转速150 r/min和温度30℃时,黑曲霉ZD分别产纤维素酶的能力较优,对筛选出来的水平进行PB设计。图2
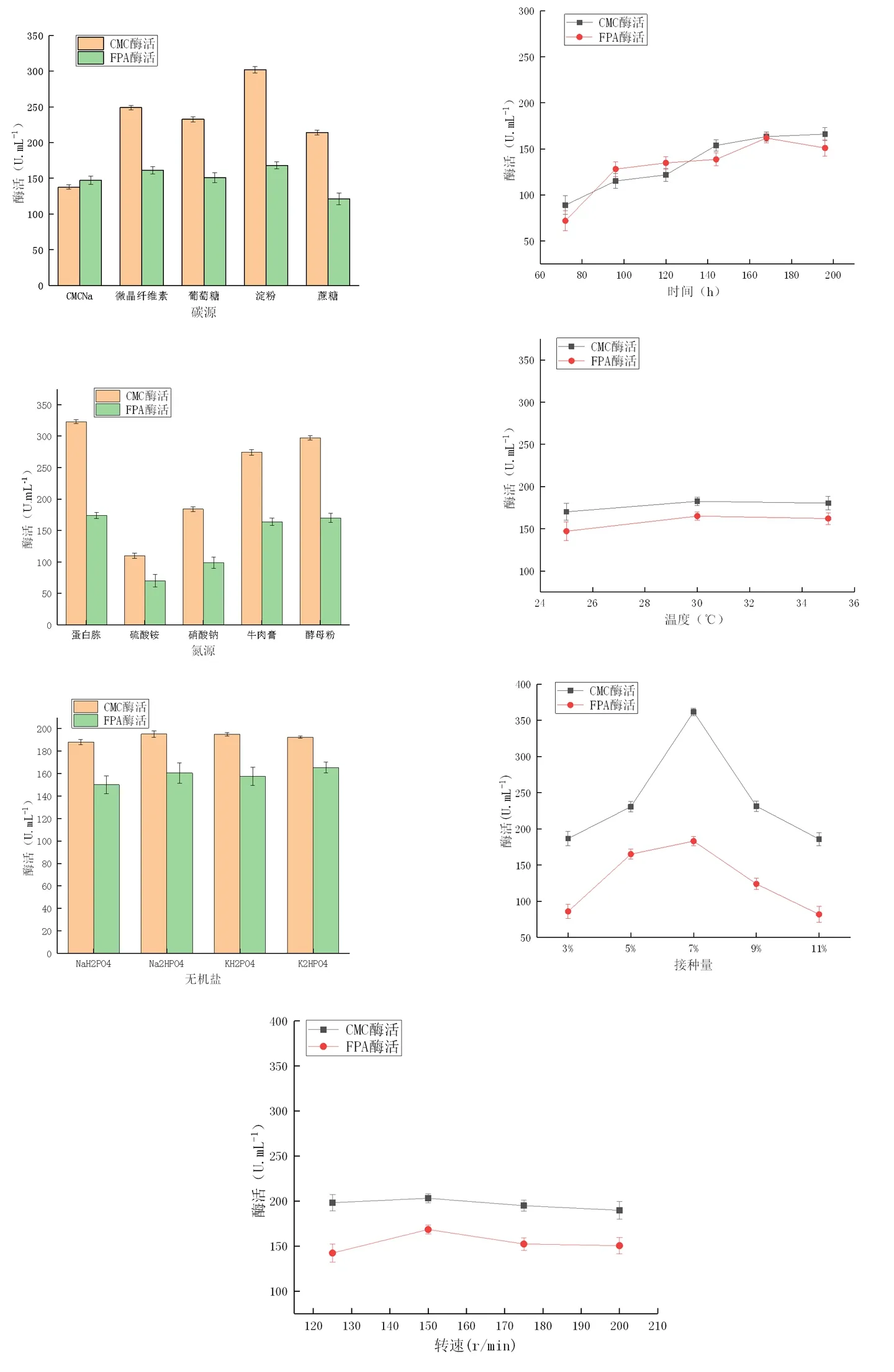
图2 各因素下黑曲霉ZD产酶变化
Fig.2 Effects of medium composition and fermentation conditions on cellulase production
2.3 PB试验设计及优化
研究表明,模型的P值为0.043 2<0.05,模型选择正确。由变量显著性P值显著性大小可知,蛋白胨质量浓度(P=0.022 3),转速(0.040 2),接种量(P=0.007 7),P值均小于0.05,对CMC酶活力影响显著,且接种量>蛋白胨质量浓度>转速。其他因素对CMC酶活影响不显著;模型的P值为0.010 9<0.05,模型选择正确,由变量显著性可知,淀粉质量浓度(P=0.009)和接种量(P=0.020 6),P值均小于0.05,对FPA酶活影响显著,且淀粉质量浓度>接种量。由以上对CMC酶活和FPA酶活的PB试验方差分析,选择淀粉质量浓度、蛋白胨质量浓度、接种量和转速进行下一步的优化。表1~4
表1 Plackett-Burman试验因素水平
Table 1 Factors and levels of Plackett-Burman design

因素Factor水平 Level-11淀粉质量浓度X1(g/100 mL) Starch mass concentration11.5蛋白胨质量浓度X2(g/100 mL) Peptone mass concentration0.50.75K2HPO4质量浓度X3(g/100 mL) K2HPO4 mass concentration0.10.15培养时间X4(h) Training time168252转速X5(r/min) Speed150175温度X6(℃) Temperature3037接种量X7(%) Inoculum size710
表2 PB试验设计及其结果
Table 2 Experimental design and responses of Plackett-Burman design
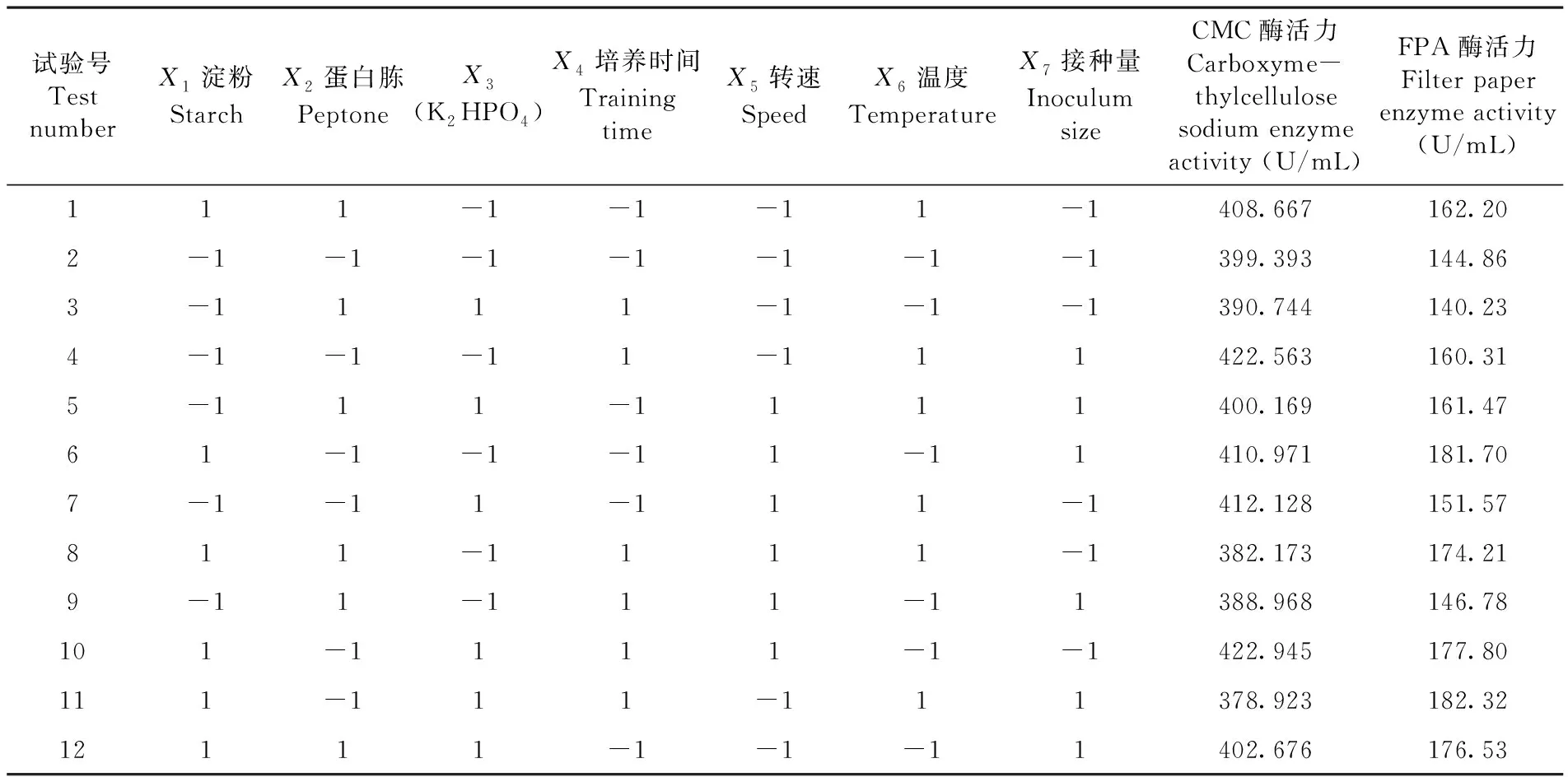
试验号Test numberX1淀粉StarchX2蛋白胨PeptoneX3(K2HPO4)X4培养时间Training timeX5转速SpeedX6温度TemperatureX7接种量Inoculum sizeCMC酶活力Carboxyme-thylcellulose sodium enzyme activity (U/mL)FPA酶活力Filter paper enzyme activity(U/mL)111-1-1-11-1408.667162.202-1-1-1-1-1-1-1399.393144.863-1111-1-1-1390.744140.234-1-1-11-111422.563160.315-111-1111400.169161.4761-1-1-11-11410.971181.707-1-11-111-1412.128151.57811-1111-1382.173174.219-11-111-11388.968146.78101-1111-1-1422.945177.80111-111-111378.923182.3212111-1-1-11402.676176.53
表3 CMC酶活PB试验方差
Table 3 ANOVA analysis for PB experimentation

方差来源Source平方和Sum of square自由度df均方Mean squareF值F valueP值p-value模型 Model225.72732.256.640.043 2A-淀粉质量浓度 Starch mass concentration0.02110.0214.41E-030.950 2B-蛋白胨质量浓度 Peptone mass concentration63.68163.6813.110.022 3C-K2HPO4质量浓度 K2HPO4 mass concentration0.1410.140.0280.874 7D-培养时间 Training time119.11119.124.520.773 3E-转速 Speed42.27142.278.70.042F-温度 Temperature0.05210.0520.0110.922 3G-接种量 Inoculum size0.4610.460.0950.007 7残差 Residual19.4344.86总值 Total245.1411
表4 FPA酶活PB试验方差
Table 4 ANOVA analysis for PB experimentation
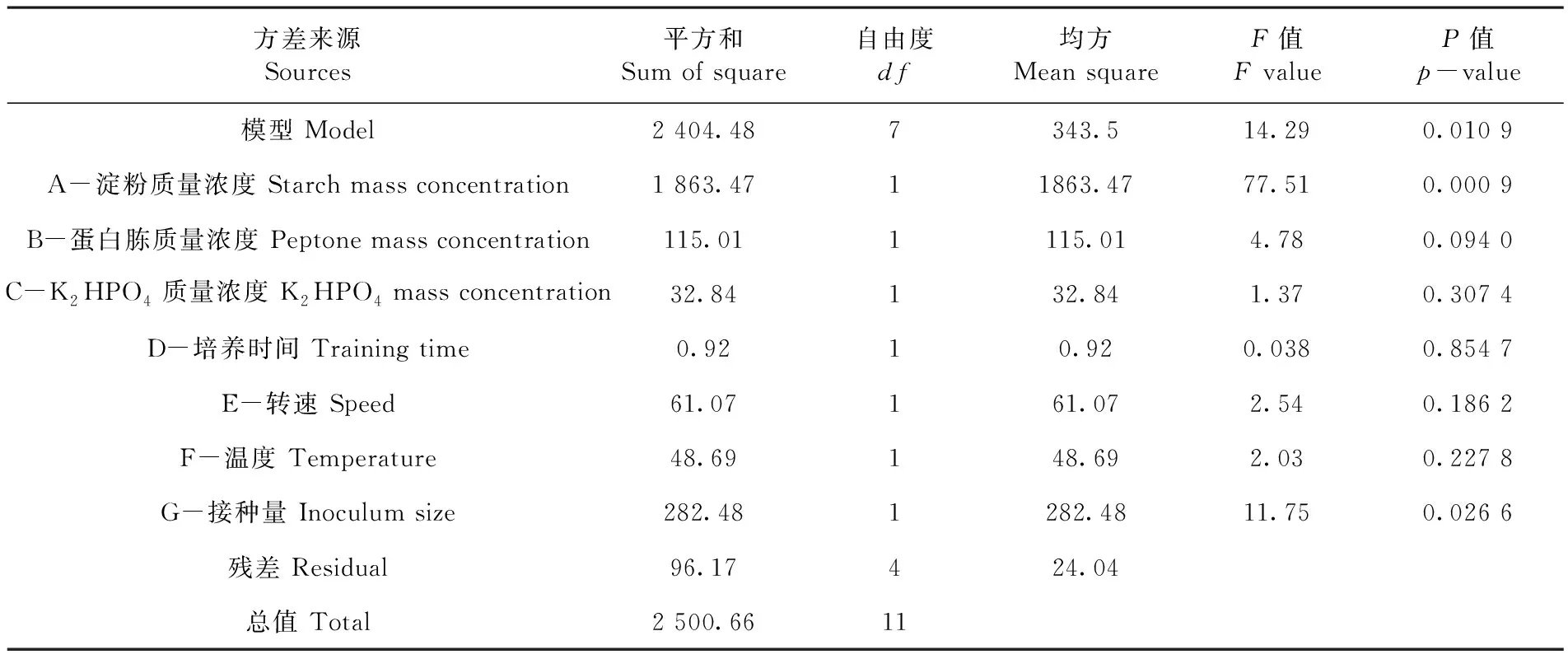
方差来源Sources平方和Sum of square自由度df均方Mean squareF值F valueP值p-value模型 Model2 404.487343.514.290.010 9A-淀粉质量浓度 Starch mass concentration1 863.4711863.4777.510.000 9B-蛋白胨质量浓度 Peptone mass concentration115.011115.014.780.094 0C-K2HPO4质量浓度 K2HPO4 mass concentration32.84132.841.370.307 4D-培养时间 Training time0.9210.920.0380.854 7E-转速 Speed61.07161.072.540.186 2F-温度 Temperature48.69148.692.030.227 8G-接种量 Inoculum size282.481282.4811.750.026 6残差 Residual96.17424.04总值 Total2 500.6611
2.4 Box-behnken组合设计
采用Box-behnken组合设计建立数学模型,以淀粉质量浓度,蛋白胨浓度、接种量和转速作自变量,以-1、0和1分别代表低、中和高水平,测定CMC酶活和FPA酶活,采用加权评分法,以加权综合评分为响应值,以CMC酶活最大值430.543,FPA酶活最大值179.989为参照,综合评分=(CMC酶活/430.543)×50+(FPA酶活/179.989)×50。利用Desigin-expert对试验结果进行回归分析,得回归方程为:综合评分=96.399 34+1.320 17×X1+0.113 13×X5+0.690 86×X7+4.191 98×X1X7-3.329 32X12+1.715 73×X52-3.145 26×X72。
通过Design-Expert软件试验数据和模型进行分析,所选模型P值<0.000 1,小于0.01,极显著,方程拟合度较好;失拟项反应的是试验数据与模型不相符的情况,失拟项P值=0.499 0,大于0.05,不显著,模型选择正确,可以预测试验结果。相关系数R2=0.810 2,校正决定系数R2=0.982 4,可以解释81.02%的变量,回归方程可以较好解释各因素与响应值的关系。变异系数CV=1.79,数值较低,说明试验精确度较高,操作可信。信噪比=15.55>4,说明有效值远远大于无效值。表5~6
表5 Box-Behnken组和设计方案及结果
Table 5 Experimental design and response of Box-Behnken design

试验号Testnumber因素X1淀粉质量浓度Starch mass concentration(g/100 mL)X2蛋白胨质量浓度Peptone mass concentration(g/100mL)X5转速Speed(r/min)X7接种量Inoculum sizeCMC酶活Carboxyme-thylcellulose sodium enzyme activity (U/mL)FPA酶活Filter paper enzyme activity(U/mL)综合评分Overall rating11(1.5)0(0.5)-1(130)0(7%)430.543171.56397.6620(1)00(150)0380.504175.34492.90301(0.75)0-1(5%)425.551179.98999.4240-1(0.25)-10(9%)389.098169.39892.255101(170)0421.297168.38495.7060000423.982165.56895.237-1(0.5)010383.253143.99184.5180-101432.290178.93199.919-100-1403.937160.23691.42101001426.234177.29498.75111-100408.495176.30996.4212001-1429.881164.26295.55130-10-1425.347178.39698.9514-1-100410.004159.33291.88150101428.596178.95399.26160110425.045158.29793.34170000382.152178.98096.10180000392.243175.65494.351901-10426.240169.26896.52200011384.339173.68092.8821100-1413.332162.22693.07221100403.225165.88392.912300-1-1382.290177.59293.7324-1001395.880172.19493.81250-110415.478166.33994.46260000423.432174.65297.6927-10-10403.943161.11691.672800-11411.596163.69193.2729-1100387.286175.79393.81
表6 回归方程方差
Table 6 ANOVA analysis for regression equation

来源Source平方和Sum of square自由度df均方Mean squareF值F valueP值p-value模型 Model235.499 3926.166 599.115 499< 0.000 1A-淀粉质量浓度 Starch mass concentration14.954 6114.954 65.209 6470.034 2B-蛋白胨质量浓度 Peptone mass concentration0.216 00810.216 0080.075 250.786 8C-X5 转速 speed0.853 34110.853 3410.297 2730.591 9D-X7 接种量 Inoculum size7.001 40717.001 4072.439 0390.134 9AD50.341 98150.341 9817.537 340.000 5A264.594 08164.594 0822.502 260.000 1B211.651 83111.651 834.059 0790.058 3C230.860 33130.860 3310.750 630.003 9D267.642 07167.642 0723.564 070.000 1残差 Residual54.540 64192.870 56失拟项 Lack of Fit39.721 671426.166 590.957 3070.569 8纯误差 Pure Error14.818 97914.954 6Co总值 r Total290.039 91复相关系数 R-squared0.810 2校正相关系数 Adj-squared0.722 9变异系数 C.V. (%)1.789 017信噪比 Adeq Precisior15.553 65
研究表明,等高线图反映因素间的交互作用,研究等高线图为椭圆形代表相互作用显著,表示淀粉质量浓度和接种量之间交互作用显著,淀粉质量浓度和接种量的交互作用对综合酶活力影响显著。利用Design-Expert软件,对方程式进行分析和优化,淀粉质量浓度、蛋白胨质量浓度,转速和接种量的最优试验点编码值为X1,X2,X5,X7(0.42,-1.00,0.99,0.38),即淀粉质量浓度为1.21 g/100 mL,蛋白胨质量浓度0.25 g/100 mL,转速169.8 r/min,接种量7.76%。此方程综合评分的最大预测值为100.004。考虑实际限制,修正为淀粉质量浓度1.21 g/100 mL,蛋白胨质量浓度0.25 g/mL,转速170 r/min,接种量7.8%。图3
2.5 模型验证
研究表明,初始培养条件下(CMC-Na 1 g/100 mL,蛋白胨0.5 g/100 mL,磷酸氢二钾0.1 g/100 mL,培养时间144 h,转速150 r/min,温度30℃,接种量5%);优化后的条件是淀粉质量浓度1.21 g/100 mL,蛋白胨质量浓度0.25 g/mL,磷酸经二钾 0.1 g/100 mL,培养时间168 h,转速170 r/min,接种量7.8%,将菌株分别在初始培养条件下和优化后的培养条件下,进行产酶试验并进行比较。初始条件培养后所得CMC酶活260.335 U/mL,FPA酶活155.946 U/mL,综合评分为73.55;优化后条件培养所得CMC酶活435.449 U/mL,FPA酶活183.654 U/mL,综合评分为100分,与预测条件基本一致,比初始条件下培养高出了35.96%。
2.6 液体发酵下棉秆降解效果
研究表明,经过优化后的黑曲霉产酶菌液,通过液体发酵对棉秆的纤维素和半纤维素有一定程度的降解。在接种菌液后的前7 d,棉秆中纤维素含量和半纤维素含量基本没有发生变化,到第7 d时,开始有了变化,纤维素和半纤维素开始降解,棉秆中的纤维素和半纤维素含量开始降低,降解率也开始变大。到第30 d时,棉秆中纤维素含量由最初的40.2%降到28.5%,最高降解率为28.03%;半纤维素含量也由最初的11.6%降到7.9%,最高降解率为31.90%。在整个发酵期间,与未加菌液对照组相比,纤维素和半纤维素含量显著降低,对照组的纤维素和半纤维素含量几乎无变化。图4

图3 淀粉质量浓度和接种率对酶活的综合影响的交互作用的响应面和等高线
Fig.3 Response surface and contour plots of the interaction of starch mass concentration and inoculation rate on the combined effects of enzyme activity
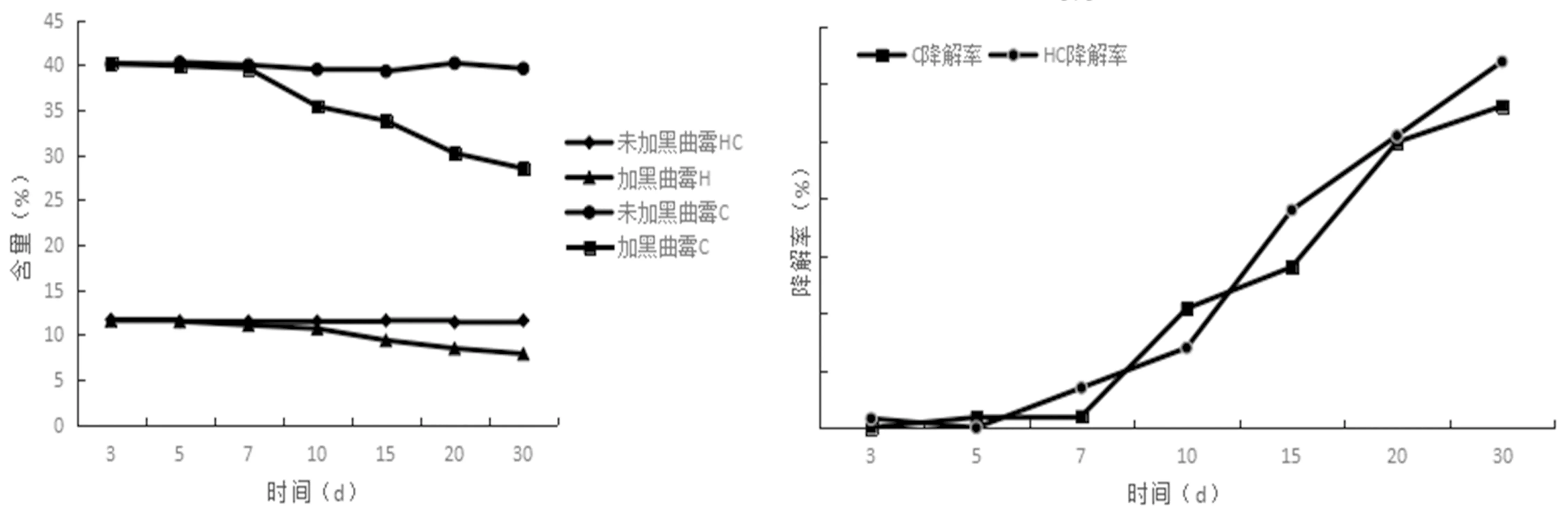
图4 液体发酵过程中棉秆中纤维素含量、半纤维素含量和降解率变化
Fig.4 Changes of cellulose content, hemicellulose content and degradation rate in cotton straw during liquid fermentation
3 讨 论
3.1 CMC酶活只是代表了纤维素酶的一种,想要提高菌株产纤维素酶的能力,需要对多种酶活进行优化。以往的研究,只以CMC酶活作唯一指标,不能代表纤维素酶的整体酶活力。冯培勇等[26]以CMCase为指标,在最优条件下酶活达到360.03 U/mL;刘松等[27]通过响应面法,以CMCase为指标,在最优条件下酶活达到63.5 U/mL;白爱枝等[28]以玉米芯为碳源产纤维素酶水平较高,用量以80 g/L为宜,氮源以6 g/L的蛋白胨效果为最佳;麦芽糖作为速效碳源,可供菌体早期迅速生长并产酶,以10 g/L为宜;研究还发现,用中和剂CaCO3可有效地调控发酵pH,提高产酶能力,容氧和发酵温度以30 mL/250 mL三角瓶和28℃为宜,200 r/min发酵培养72 h达到产酶高峰。经优化后菌株产纤维素酶的活力较优化前提高150%以上。以上研究都仅仅以CMC酶活为指标,只表征了内切葡聚糖酶活力。
3.2 棉秆纤维素降解一直阻碍棉秆饲料的应用,优化具有高效产纤维素酶能力的菌株对于棉秆纤维素降解有很大价值。近年来些关于棉秆降解的研究,都是采取细菌来降解棉花秸秆的纤维素。侯敏等[29]枯草芽孢杆菌(bacillussubtilis),与产朊假丝酵母(Candidautilis)、植物乳杆菌(lactobacillusplantarum)、地衣芽孢杆菌(Bacilluslicheniformis)构建复合菌系按1∶1∶2∶1进行发酵, 纤维素降解率达35.91%,接种量对纤维素降解率影响最大。席琳桥等以地衣芽孢杆菌(Bacilluslichenniformis)、面包乳杆菌(Lactobacilluscrustorum)、鼠李糖乳杆菌(Lactobacillusrhamnosus)、于酪乳杆菌(Lactobacilluscase)、乳酸片球菌(Pediococcusacidilactici)、肠球菌属(Enterococcus)、葡萄球菌属(Staphylococcus)和芽孢杆菌属(Bacillus),建立青贮乳酸菌系降解棉花秸秆,棉秆中半纤维素被降解42.69%,纤维素被降解44.30%,木质素被降解30.45%[29]。
4 结 论
4.1 碳源为淀粉,氮源为蛋白胨,无机盐为K2HPO4,培养时间为168 h,转速为150 r/min,温度为30℃,接种量为7%;再利用PB试验筛选出淀粉质量浓度,蛋白胨质量浓度,转速和接种量为主要影响因素;通过Box-Benhken试验设计,对主要因素进行优化后,确定淀粉质量浓度1.21 g/100 mL,蛋白胨质量浓度0.25 g/100 mL,转速170 r/min和接种量7.8%,CMC酶活435.449 U/mL,FPA酶活183.654 U/mL,综合评分为100分,比未优化的高35.96%(CMC酶活435.449 U/mL,FPA酶活155.946 U/mL,综合评分73.55分)。
4.2 将优化后的黑曲霉菌液,转接到以棉秆为唯一碳源的液体培养基,测定第3、5、7、10、15、20、30 d棉秆中的纤维素和半纤维素,纤维素含量从最初的40.2%降到28.5%,半纤维素从最初的11.6%降到7.9%,第30d纤维素降解率达到28.03%,半纤维素降解率达到31.09%,表明黑曲霉对棉秆中纤维素降解有着显著作用。
参考文献(References)
[1] 李蕾.纤维素酶高产木霉菌株的筛选及其对秸秆的降解效果[D].兰州:甘肃农业大学硕士学位论文,2014.
LI Lei. (2014).Screeningofcellulase-producingTrichodermastrainsanditsdegradationeffectonstraw[D]. Master Dissertation.Gansu Agricultural University, Lanzhou. (in Chinese)
[2]林润泽.东北农田木霉菌的鉴定、酶活评价及其纤维素酶发酵工艺[D]. 沈阳: 沈阳农业大学硕士学位论文,2016.
LIN Run-ze. (2016).Identification,enzymeactivityevaluationandcellulasefermentationprocessofTrichodermaspp.inNortheastChina[D]. Master Dissertation. Shenyang Agricultural University, Shenyang. (in Chinese)
[3]杨君芳,液态混菌发酵产纤维素酶的实验研究[D]. 郑州: 郑州大学博士学位论文,2011.
YANG Jun-fang. (2011).Experimentalstudyoncellulaseproductionbyliquidmixedfermentation[D]. PhD Dissertation, Zhengzhou University, Zhengzhou. (in Chinese)
[4]刘凯,林建强,曲音波.纤维素酶生产技术[J].生物产业技术,2008,(4):54-60.
LIU Kai, LIN Jian-qiang, QU Yin-bo. (2008). Cellulase Production Technology [J].Biotechnology, (4): 54-60. (in Chinese)
[5] Zaccone, R. , & Caruso, G. . (2002). Microbial hydrolysis of polysaccharides and organic phosphates in the northern adriatic sea.ChemistryandEcology, 18(1-2): 85-94.
[6] Davies, G. J. , Wilson, K. S. , & Henrissat, B. . (1997). Nomenclature for sugar-binding subsites in glycosyl hydrolases [J].BiochemicalJournal, 321 ( Pt 2)(2): 557-559.
[7]李振红,陆贻通.高效纤维素降解菌的筛选[J].环境污染与防治,2003,(3):133-135, 153.
LI Zhen-hong, LU Yi-tong. (2003). Screening of high-efficiency cellulose-degrading bacteria [J].EnvironmentalPollutionandControl, (3): 133-135, 153. (in Chinese)
[8]李洋.纤维素酶产生菌的筛选及产酶条件优化[D]. 大连: 大连理工大学硕士学位论文,2015.
LI Yang. (2015).Screeningofcellulase-producingbacteriaandoptimizationofenzymeproductionconditions[D]. Master Dissertation. Dalian University of Technology, Daliang. (in Chinese)
[9] Duff, S. J. B. (1996). Bioconversion of forest products industry waster cellulosics to fuel ethanol: a review.BioresourceTechnology, 55(1): 1-33.
[10] Ghose, T. K. (1987). Measurement of cellulase activities. Pure & Applied Chemistry, 59(2): 257-268.
[11]曲丽丽.海洋黑曲霉固态发酵耐盐纤维素酶的培养条件优化及粗酶制剂的制备[D].杭州:浙江大学硕士学位论文,2017.
QU Li-li. (2017).Optimizationofcultureconditionsofsolidfermentationofsalt-tolerantcellulasebyAspergillusnigerandpreparationofcrudeenzymepreparation[D]. Master Dissertation. Zhejiang University, Hanzhou. (in Chinese)
[12]杨丽娜.一株产纤维素酶菌株的筛选、鉴定及发酵条件优化[D].杨凌:西北农林科技大学硕士学位论文,2013.
Yang Li-na. (2013).Screening,identificationandoptimizationoffermentationconditionsforacellulase-producingstrain[D]. Master Dissertation. Northwest A& F University, Yangling. (in Chinese)
[13]吴发远.黑曲霉发酵生产纤维素酶条件的研究[J].中国农学通报,2009,25(9):74-77.
Wu Fa-yuan. (2009). Study on the Conditions of Fermentation of Cellulase by Aspergillus niger [J].ChineseAgriculturalScienceBulletin, 25(9): 74-77. (in Chinese)
[14] 唐嘉徽. 黑曲霉(AS3.316)产纤维素酶条件优化及重离子辐照诱变高产菌株筛选[D].兰州:甘肃农业大学硕士学位论文,2012.
TANG Jia-hui. (2012).OptimizationofcellulaseproductionconditionsbyAspergillusniger(AS3.316)andscreeningofhigh-yieldstrainsinducedbyheavyionirradiation[D]. Master Dissertation. Gansu Agricultural University, Lanzhou. (in Chinese)
[15]李景,陈定刚.响应面优化米曲霉固态发酵豆粕制备ACE抑制肽条件[J].食品研究与开发,2018,39(5):120-125.
LI Jing, CHEN Ding-gang. (2018). Optimization of ACE inhibitory peptides prepared by solid fermentation of Aspergillus oryzae by response surface [J].FoodResearchandDevelopment, 39(5):120-125. (in Chinese)
[16]王浩,卢梓荧,谭颖斯,等.响应面法优化米曲霉液体发酵生产中性蛋白酶工艺[J].中国酿造,2018(12):40-45.
WANG Hao, LU Zi-ying, TAN Ying-si, et al. (2018). Optimization of liquid fermentation process for the production of neutral protease by Aspergillus oryzae by response surface methodology [J].ChineseBrewing, (12): 40-45. (in Chinese)
[17]刘海霞,张力,乔梁.白腐真菌发酵罐产漆酶条件的优化[J].江苏农业科学,2017,45(21):305-307.
LIU Hai-xia, ZHANG Li, QIAO Liang. (2017). Optimization of laccase production conditions in white rot fungi fermenter [J].JiangsuAgriculturalSciences, 45(21): 305-307. (in Chinese)
[18]邱思佳.红曲霉酸性蛋白酶基因的同源表达及液态发酵条件优化研究[D]. 重庆: 重庆大学硕士学位论文,2016.
QIU Si-jia. (2016).HomologousexpressionoftheacidproteasegeneofMonascusandoptimizationofliquidfermentationconditions[D]. Master Dissertation. Chongqing University, Chongqing. (in Chinese)
[19]刘最,何丽芳,陈晓华, 等.纤维素降解菌的筛选、酶活及对稻草秸秆的降解研究[J].纤维素科学与技术,2018,(2):1-7.
LIU Zui, HE Li-fang, CHEN Xiao-hua, et al. (2018). Screening, Enzyme Activity and Degradation of Straw Straw by Cellulose Degrading Bacteria [J].CelluloseScienceandTechnology, (2):1-7. (in Chinese)
[20]孙科,王锋.响应面法优化里氏木霉发酵水稻秸秆产纤维素酶的条件[J].黑龙江畜牧兽医,2017,(19):157-160, 295-296.
SUN Ke,WANG Feng.(2017). Optimization of cellulase production by fermentation of rice straw by Trichoderma reesei by response surface methodology [J].HeilongjiangAnimalHusbandryandVeterinaryMedicine, (19):157-160, 295-296. (in Chinese)
[21]姜军坡,朱宝成,王世英.以滤纸酶活力为指标优化解淀粉芽孢杆菌Tu-115菌株产纤维素酶液体发酵条件[J].饲料工业,2014,35(20):43-47.
JIANG Jun-po, ZHU Bao-cheng, WANG Shi-ying. (2014). Optimizing the fermentation conditions of cellulase produced by Bacillus amyloliquefaciens Tu-115 strain by using filter paper enzyme activity as index [J].FeedIndustry, 35(20):43-47. (in Chinese)
[22]刘云鹏. 裂褶菌对玉米秸秆木质纤维素的降解及应用研究[D]. 长春:吉林农业大硕士学位论文学,2017.
LIU Yun-peng. (2017).DegradationandapplicationofSchizophyllumtocornstalklignocellulose[D]. Master Dissertation. Jilin Agricultural University, Changchun. (in Chinese)
[23]安玉民,王菊葵, 黄烨,等.马铃薯秸秆中纤维素与半纤维素含量的测定[J].现代农业科技,2016,(17):159-160.
AN Yu-min, WANG Ju-kui, HUANG Yei, et al. (2016). Determination of Cellulose and Hemicellulose Content in Potato Stalk [J].Xiandannoyekeji, (17):159-160. (in Chinese)
[24]严琳,钟红梅,左婕, 等.响应面优化转透明颤菌血红蛋白基因里氏木霉液体发酵产纤维素酶的培养条件[J].中国畜牧兽医,2018,45(3):663-672.
YAN Lin, ZHONG Hong-mei, ZUO Jie, et al. (2018). Optimization of culture conditions for cellulase production by liquid fermentation of Treponema fuliginea hemoglobin gene by the response surface optimization [J].ChinaAnimalHusbandry&VeterinaryMedicine, 45(3): 663-672. (in Chinese)
[25]蒋艾廷,李宝坤,金丹,等.PB试验优化德氏乳杆菌增殖培养基的研究[J].中国酿造,2017,36(7):32-36.
JIANG Ai-ting, LI Bao-kun, JIN Dan, et al. (2017). Study on PB test optimization of Lactobacillus delbrueckii proliferation medium [J].ChinaBrewing, 36(7): 32-36. (in Chinese)
[26]冯培勇,赵彦宏,张丽.响应面法优化黑曲霉产纤维素酶发酵条件[J].食品科学,2009,30(23):335-339.
FENG Pei-yong, ZHAO Yan-hong, ZHANG Li. (2009). Optimization of cellulase fermentation conditions by Aspergillus niger by response surface methodology [J].FoodScience, 30(23):335-339. (in Chinese)
[27]刘松,李祝,周礼红, 等.响应面法优化黑曲霉产纤维素酶的发酵条件[J].食品科学,2013,34(17):225-229.
LIU Song, LI Zhu, ZHOU Li-hong, et al. (2013). Optimization of fermentation conditions for cellulase production by Aspergillus niger by response surface methodology [J].FoodScience, 34(17):225-229. (in Chinese)
[28]白爱枝,闫祖威,梁运章.黑曲霉产纤维素酶液体发酵条件的优化[J].食品科技,2009,34(3):11-13.
BAI Ai-zhi, YAN Zu-wei, LIANG Yun-zhang. (2009).Optimization of liquid fermentation conditions for cellulase production by Aspergillus niger [J].FoodScienceandTechnology, 34(3):11-13. (in Chinese)
[29]侯敏,包慧芳,王宁,等.棉秸秆纤维素降解菌系构建及固体发酵条件优化[J]. 新疆农业科学,2018,55(5): 936-948.
HOU Min, BAO Hui-fang, WANG Ning, et al. (2018). Construction of Cellulose Degrading Bacteria in Cotton Straw and Optimization of Solid Fermentation Conditions [J].XinjiangAgriculturalSciences, 55(5): 936-948. (in Chinese)

