si-RNA介导FGFR1基因沉默对胃癌细胞生长及凋亡的影响
许超超 金嵘 颜小丹 叶丽萍
据Jemal等[1]报道,2008年世界范围有近10万例新发胃癌患者和73万余例胃癌患者死亡,超过70%的新发和死亡病例发生在发展中国家,其中发病率最高的是在亚洲东部、东欧和南美。虽然外科手术和术后辅助化疗已经改善了胃癌患者的预后,但是胃癌的总体存活率并不令人满意。因此,了解胃癌发生、发展的分子机制和开发新的靶向治疗药物是必要的。成纤维细胞生长因子受体 1(fibroblast growth factor receptor 1,FGFR1)是一种高度保守的酪氨酸激酶(RTK)受体,通过与成纤维细胞生长因子(FGFs)结合,可以激活下游的一系列通路,在肿瘤细胞的分化、增殖以及肿瘤血管的生成中起到重要作用[2]。已有研究报道,FGFR1在胃癌组织中呈高表达,且在胃癌的发生、发展中扮演着重要角色[3]。进一步研究表明,在胃腺癌中FGFR1高表达与否与胃癌患者的 10年生存率相关[4];而且Wen等[5]和 Xu等[6]发现FGFR1不仅在胃癌组织中是扩增的,在胃癌细胞中也是扩增的,当FGFR1被小分子抑制剂L6123抑制或miR-133b沉默后,可以抑制胃癌细胞的增殖。本研究采用小干扰 RNA(small interfering RNA,siRNA) 介导FGFR1基因沉默来探讨其对胃癌细胞SGC-7901生长及凋亡的影响,现报道如下。
1 材料和方法
1.1 实验材料 人正常胃黏膜上皮细胞GES-1购自中国科学院细胞库/中国科学院上海生命科学研究院细胞资源中心;人胃癌细胞SGC-7901购于中南大学湘雅细胞中心;人胃癌细胞株SGC-7901、人正常胃黏膜上皮细胞GES-1均用含10%FBS的RPMI-1640完全培养基进行培养;所有细胞株均在恒温培养箱中培养(条件为:37℃、5%CO2、湿度 95%),每隔 1~2d 更换新鲜的培养基,并在细胞长至70%左右,进行传代、冻存或者下一步实验。
1.2 方法
1.2.1 Western blotting法检测细胞中FGFR1蛋白的表达情况 根据Genbank中提供的FGFR1基因序列,设计相应siRNA的序列,靶向FGFR1的siRNA序列:5′-GGAGGUGCUUCACUUAAGATT-3′,阴性对照(NC)的 siRNA 序列:5′-UUCUCCGAACGUGUCACGUTT-3′;取对数期生长的胃癌细胞SGC-7901,分3组:NC-siRNA组(转染NC的siRNA)、siRNA-FGFR1组(转染靶向FGFR1的siRNA)及空白组(加入相应剂量的灭菌水),先用250μl无血清的培养基分别与Lipofectamine2000(5μl)和 siRNA(5μl)各自混合均匀,再将Lipofectamine2000和siRNA混合均匀,最后将混合后的Lipofectamine2000和siRNA加入6孔板中,采用无血清培养基,培养6h后换成有血清的培养基;2d后收蛋白,采用Western blotting法检测细胞中FGFR1蛋白的表达情况。
1.2.2 MTT法检测细胞增殖情况 取对数生长期的胃癌细胞SGC-7901,分3组,NC-siRNA组、siRNA-FGFR1组及空白组,接种于96孔板(每孔3000~5000个细胞),用配置好的培养基进行培养;在铺板后的 0、24、48h,观察每组细胞的生长情况并在每个小孔中加入配置好的 MTT(5mg/ml)25μl,置于培养箱培养 4h,之后加入150μlDMSO用来溶解结晶,最后酶标仪490nm下读取OD值,检测细胞的增殖能力。
1.2.3 克隆集落形成试验检测增殖情况 取对数期生长的胃癌细胞SGC-7901,铺于6孔板中(1000个/孔)并轻轻摇晃,使细胞分散均匀,静置培养2周;当培养皿中出现肉眼可见的克隆时,即可终止培养,弃去上清液,用PBS小心浸洗1次,加4%多聚甲醛固定15min,然后去固定液,用PBS再次小心浸洗1次,最后用结晶紫染色20min,用PBS洗去染色液,待干燥后观察并拍照,观察细胞集落形成的大小。
1.2.4 流式细胞术分析细胞凋亡情况 取对数期生长的胃癌细胞SGC-7901,铺于6孔板中培养,贴壁过夜;培养48h后,收取原先的培养基和清洗所用的PBS,然后再收集贴壁的胃癌细胞,4℃、1000r/min,离心4min,弃上清液,并用PBS清洗1次后,继续相同条件下离心,保留沉淀,最后加入200μl Binding-buffer重悬沉淀;接着取100μl的细胞重悬液,先用Annexing-V(3μl)染色 10min,接着用 PI(1μl)继续染色 5min,最后用Binding-buffer混合均匀后在流式细胞仪上分析细胞凋亡情况。
1.2.5 Hoechst染色法分析细胞凋亡情况 取经70%乙醇浸泡过的盖玻片,用PBS洗涤以及酒精灯上过火消毒后放置在6孔板中,将对数期生长的胃癌细胞SGC-7901接种于6孔板上(30~40万个/孔),过夜贴壁,分3组,NC-siRNA组、siRNA-FGFR1组及空白组;培养48h,吸尽培养基后并用固定液固定15min,PBS清洗7min×3次,加入500μl的Hoechst染色液,避光染色10min后继续用PBS清洗7min×3次,最后加入适量的抗荧光淬灭剂,并在荧光显微镜下观察细胞核的形态学变化。
1.3 统计学处理 采用GraphPad Prism 5.0统计软件,计量资料以表示,组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 FGFR的表达量及siRNA转染效果 见图1。
由图1a可见,与人正常胃黏膜上皮细胞GES-1(OD值:0.19±0.03)相比,FGFR1蛋白在胃癌细胞 SGC-7901(OD 值:0.77±0.08)中表达增高(t=6.69,P<0.05)。由图 1b可见,与空白组(OD 值:0.96±0.08)相比,NC-siRNA组(OD 值:0.88±0.13)对FGFR1蛋白表达的抑制差异无统计学意义(t=0.71,P>0.05);而siRNA-FGFR1组(OD值:0.15±0.05)显著抑制了FGFR1蛋白的表达(t=12.55,P<0.01)。
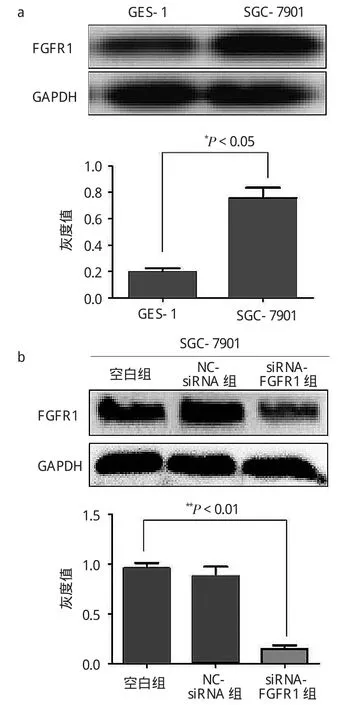
图1 Western blotting法检测FGFR1蛋白的表达量
2.2 SGC-7901细胞转染siRNA后对细胞增殖的影响 见图 2、3。

图2 SGC-7901细胞转染si-RNA后细胞的生长曲线
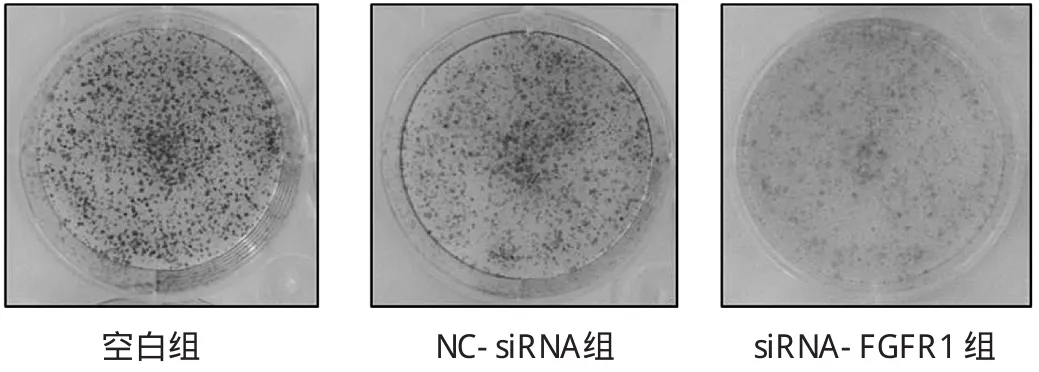
图3 克隆集落形成试验检测S GC-7901细胞转染si-RNA后细胞集落形成能力
由图2可见,在转染后的48h,空白组(OD值:0.62±0.03)和 NC-siRNA 组(OD 值:0.52±0.07)比较差异无统计学意义(t=1.37,P>0.05),siRNA-FGFR1组(OD值:0.27±0.04)与空白组相比,细胞的生长明显抑制(t=12.21,P<0.01)。由图3可见,siRNA-FGFR1组SGC-7901克隆集落形成在3组中最小,克隆集落形成实验结果与细胞增殖实验结果一致。
2.3 SGC-7901细胞转染siRNA后对细胞凋亡的影响见图 4、5。
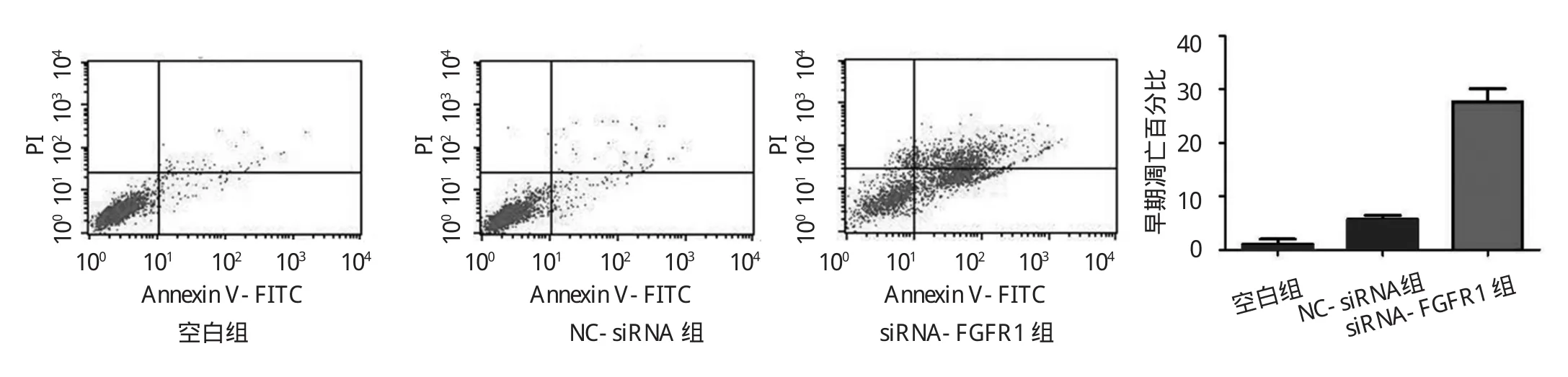
图4 流式细胞仪检测SGC-7901细胞转染s i-R N A后细胞的凋亡情况
由图 4可见,空白组(1.06±1.35)与 NC-siRNA 组(5.70±1.03)中胃癌SGC-7901细胞早期凋亡百分比差异无统计学意义(t=3.86,P>0.05),而 siRNA-FGFR1组(27.65±3.49)较空白组细胞早期凋亡百分比显著升高(t=10.05,P<0.01)。由图 5可见,Hoechst染色法的检测呈现出同样的结果,siRNA-FGFR1组显著增加了细胞核裂解和浓缩的比例,细胞核呈亮蓝色,可见核呈分叶,碎片状改变。
3 讨论
FGFRs是酪氨酸激酶受体,由胞外配体结合域、跨膜结构域和细胞内酪氨酸激酶结构域3部分组成,目前已经有4种受体蛋白被发现(FGFR 1~4)。FGFRs的突变激活或过量表达与包括乳腺癌、膀胱癌、多发性骨髓瘤、肝癌、肾细胞癌在内的多种癌症的发展及肿瘤周围血管的生成密切相关。
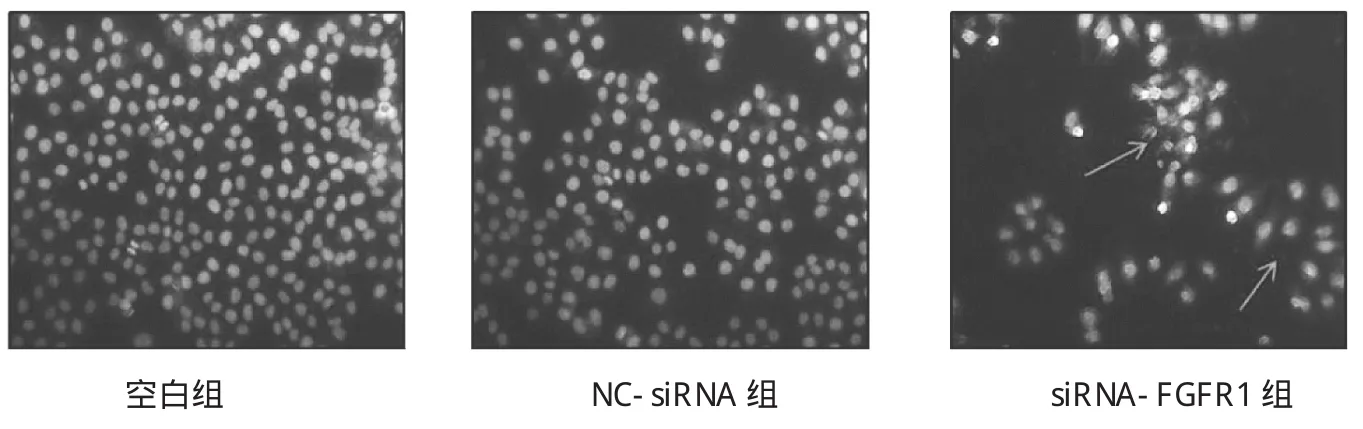
图5 Hoechst 33258检测SGC-7901细胞转染si-RNA后细胞核形态的变化
在FGFR1扩增的肿瘤中,小分子ATP竞争性抑制剂或siRNA可通过下调FGFR1的表达来发挥良好的抗肿瘤效果。一些学者发现FGFR1在非小细胞肺癌中是高表达的,当FGFR1被小分子抑制剂(AZD4547、NDGA类似物等)下调后可以有效抑制肿瘤细胞的增殖[7-9]。同样是肺癌,还有学者发现在小细胞肺癌中FGFR1也是高表达的,且与肺癌患者的生存率密切相关[10-11]。在乳腺癌中,一些学者发现FGFR1的高表达与患者的预后、肿瘤大小以及淋巴结转移等相关,且PD166866(FGFR1小分子抑制剂)可以有效抑制乳腺癌细胞的增殖并促进其凋亡[12-15]。Koole等[16]发现在头颈部鳞状细胞癌中(不管是否存在人类乳头瘤病毒感染),FGFR1都是高表达的,而且FGFR抑制剂不仅可以抑制癌细胞增殖,还可以与化疗药物联合而发挥更明显的抗肿瘤效果。因此FGFR1在癌症的治疗中可以作为一个有效的靶点。
为了特异性地研究FGFR1对胃癌细胞生物学行为的影响,本研究选择FGFR1相对表达量较高的胃癌细胞株SGC-7901作为基因沉默研究模型。Western blotting证实siRNA-FGFR1可显著抑制FGFR1蛋白的表达;并在FGFR1蛋白表达受到稳定沉默后,胃癌细胞时间生长曲线结果显示,在转染后的48h细胞增殖受到明显抑制,而且克隆集落实验也表明siRNA-FGFR1成功抑制了胃癌细胞克隆集落的形成;此外在促进细胞凋亡方面,流式细胞术结果显示,siRNA-FGFR1可以显著促进胃癌细胞的早期凋亡,而且通过Hoechst染色法发现在细胞的形态学方面,当FGFR1被沉默后胃癌细胞SGC-7901的细胞核裂解和浓缩的比例也较空白组有增加。
本实验初步证实了以FGFR1为目的基因,通过siRNA技术成功抑制了其在胃癌细胞SGC-7901中的表达,同时发挥了显著的抑制胃癌增殖以及诱导胃癌细胞凋亡的抗肿瘤效果,但是其潜在机制有必要进一步研究,而这也正是下一步笔者研究的重点,除此之外,上皮-间质转化(EMT)是癌症进展的核心过程,与癌细胞侵犯间质组织并迁移到其他区域的能力有关,最近已有研究发现,在头颈部鳞状细胞癌中,FGFR1抑制剂可以通过核转染因子AP-1来影响上皮-间质转化过程[17-18];笔者前期研究已经发现siRNA-FGFR1可以抑制胃癌细胞的侵袭[6],但是否与EMT以及AP-1有关,则需要进一步研究,以确定并阐明潜在的机制。
[1]JemalA,Bray F,Center MM,et al.Globalcancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2]Brooks AN,Kilgour E,Smith PD.Molecular pathways:fibroblast growth factor signaling:a new therapeutic opportunity in cancer[J].Clin Cancer Res,2012,18(7):1855-1862.
[3]OkiM,Yamamoto H,TaniguchiH,et al.Overexpression of the receptor tyrosine kinase EphA4 in human gastric cancers[J].World J Gastroenterol,2008,14(37):5650-5656.
[4]Schafer MH,Lingohr P,Strasser A,et al.Fibroblast growth factor receptor 1gene amplification in gastric adenocarcinoma[J].Hum Patho,2015,46(10):1488-1495.
[5]Wen D,Li S,Ji F,et al.miR-133b acts as a tumor suppressor and negatively regulates FGFR1 in gastric cancer[J].Tumour Biol,2013,34(2):793-803.
[6]Xu C,Li W,Qiu P,et al.The herapeutic potential of a novel non-ATP-competitive fibroblast growth factor receptor 1inhibitor on gastric cancer[J].Anti-Cancer Drugs,2015,26(4):379-387.
[7]Zhang J,Zhang L,Su X,et al.Translating the therapeutic potential of AZD4547 in FGFR1-amplified non-small cell lung cancer through the use of patient-derived tumor xenograft models[J].Clinicalcancer research:an officialjournalof the American Association for Cancer Research,2012,18(24):6658-6667.
[8]Wu J,Ji J,Weng B,et al.Discovery of novel non-ATP competitive FGFR1 inhibitors and evaluation oftheir anti-tumor activity in nonsmall cell lung cancer in vitro and in vivo[J].Oncotarget,2014,5(12):4543-4553.
[9]Wang Y,Cai Y,Ji J,et al.Discovery and identification of new non-ATP competitive FGFR1 inhibitors with therapeutic potential on non-small-cell lung cancer[J].Cancer letters,2014,344(1):82-89.
[10]Park JS,Lee JS,Kim EY,et al.The frequency and impact of FGFR1 amplification on clinical outcomes in Korean patients with smallcelllung cancer[J].Lung cancer,2015,88(3):325-331.
[11]Thomas A,Lee JH,Abdullaev Z,et al.Characterization of fibroblast growth factor receptor 1in small-cell lung cancer[J].Journal of thoracic oncology:official publication of the International Association for the Study of Lung Cancer,2014,9(4):567-571.
[12]ShiYJ,Tsang JY,NiYB,et al.FGFR1 is an adverse outcome indicator for luminal A breast cancers[J].Oncotarget,2016,7(4):5063-5073.
[13]Tomiguchi M,Yamamoto Y,Yamamoto-Ibusuki M,et al.Fibroblast growth factor receptor-1protein expression is associated with prognosis in estrogen receptor-positive/human epidermal growth factor receptor-2-negative primary breast cancer[J].Cancer science,2016,107(4):491-498.
[14]Turner N,Pearson A,Sharpe R,et al.FGFR1 amplification drives endocrine therapy resistance and is a therapeutic target in breast cancer[J].Cancer research,2010,70(5):2085-2094.
[15]Chen Y,Xie X,Li X,et al.FGFR antagonist induces protective autophagy in FGFR1-amplified breast cancer cell[J].Biochemical and biophysical research Communications,2016,474(1):1-7.
[16]Koole K,Brunen D,van Kempen PM,et al.FGFR1 Is a Potential Prognostic Biomarker and Therapeutic Target in Head and Neck Squamous Cell Carcinoma[J].Clinical cancer research:an official journal of the American Association for Cancer Research,2016,22(15):3884-3893.
[17]Nieto MA.Epithelial plasticity:a common theme in embryonic and cancer cells[J].Science,2013,342(6159):1234850.
[18]Nguyen PT,Tsunematsu T,Yanagisawa S,et al.The FGFR1 inhibitor PD173074 induces mesenchymal-epithelial transition through the transcription factor AP-1[J].British journal of cancer,2013,109(8):2248-2258.

