猪流行性腹泻病毒流行株M基因的克隆与序列分析
丁卫星,王荣谈,李春华,,夏 叶,郭佳宏,倪建平,缪德年,*,赵 敏*
(1上海瑞丰农业科技有限公司,上海201106;2上海市农业科学院上海种猪工程技术研究中心,上海201106;3上海市农业科学院畜牧兽医研究所,上海201106;4上海佳牧生物制品有限公司,上海201106)
猪流行性腹泻是一种由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的,以严重的肠炎、腹泻、呕吐、脱水和仔猪高死亡率为显著特征的猪急性高度接触性肠道传染病[1]。自2010年底中国猪流行性腹泻疫情暴发以来,该病持续在中国流行蔓延,给养猪生产带来了巨大的经济损失,直至2015年中国部分地区的猪场仍然发病严重[2-4]。PEDV基因组全长为28 033 nt,编码4种主要结构蛋白[纤突蛋白(Spike protein,S)、小包膜蛋白(Envelope,E)、膜糖蛋白(Membrane,M)、核衣壳蛋白(Nucleocapsid,N)]和4种非结构蛋白(1a、1b、3a、3b)。其中M蛋白(27—32 kD)在病毒囊膜蛋白中含量最多,并通过与S蛋白和N蛋白互作参与病毒的组装。M蛋白具有跨膜结构,短的N末端结构域位于病毒外,C端结构域在病毒内[1]。在补体存在的条件下,M蛋白可诱导机体产生中和抗体,而且M蛋白还可以诱导α干扰素的产生[5]。本研究克隆了发病猪群临床分离株PEDV D1和D3的M基因序列,并分析目前我国PEDV流行毒株M蛋白的抗原性,以期为PEDV疫情诊断方法的建立和防控提供依据。
1 材料与方法
1.1 材料
PEDV临床毒株D1和D3分离自具有腹泻临床症状的仔猪。大肠杆菌JM109感受态细胞、pMD18-T载体、RNA提取试剂盒、高保真Prime STAR HSDNA聚合酶、DNA琼脂糖凝胶回收试剂盒、DL 2000 DNA Marker、质粒小量提取试剂盒均为宝生物工程(大连)有限公司产品。
1.2 引物
从GenBank中下载近年来流行的PEDV M基因核苷酸序列,经比对后根据其保守序列设计1对引物,用于 M基因的扩增。M1:5’-AGTCTTACATGCGAATTGACC-3’,M2:5’-AGCTGACAGAAGCCATAAAGT-3’,扩增片段大小为777 bp,引物由上海捷瑞生物科技有限公司合成。
1.3 样品处理
按照RNA提取试剂盒说明书提取PEDV临床毒株D1和D3的总RNA,反转录合成cDNA,以cDNA为模板进行PEDV M基因的PCR扩增(98℃2 min;98℃10 s,55℃10 s,72℃1 min,30个循环;72℃延伸10 min)。扩增产物经1.5%的琼脂糖凝胶电泳检测。
1.4 PEDV M基因的克隆与序列测定
将PEDV M基因的PCR产物纯化回收后,克隆于pMD18-T载体中,转化大肠杆菌JM109感受态细胞,在LB培养基中过夜培养,用质粒小量提取试剂盒提取质粒,以PCR方法鉴定重组质粒,阳性质粒交宝生物工程(大连)有限公司测序。
1.5 PEDV M基因遗传进化分析
采用DNAStar软件对测得的PEDV D1和D3的M基因序列与我国其他地区的分离株以及国外分离株(表1)的PEDV M基因进行同源性分析,采用MegAlign软件构建系统进化树。

表1 用于进行M基因序列比较的PEDV毒株Table 1 PEDV strains for sequence com parison of M gene
1.6 PEDV M蛋白二级结构与抗原性分析
利用DNAStar软件Protein不同方法对其进行二级结构预测。运用在线软件预测可能存在的抗原位点(http://imed.med.ucm.es/Tools/antigenic.pl)。
2 结果与分析
2.1 M基因的扩增
利用RT-PCR方法扩增PEDV临床毒株D1和D3的M基因全长,PCR产物经1.5%琼脂糖凝胶电泳分析,与预期大小相一致,约为777 bp(图1)。

图1 猪流行性腹泻病毒M基因的RT-PCR扩增Fig.1 RT-PCR amplification of M gene of PEDV
2.2 PEDV M基因序列分析
每个分离毒株取2个阳性质粒送公司测序。测序结果表明:相同毒株的M基因序列完全一致,PEDV分离株D1和D3的M基因大小分别为693 bp和681 bp,分别编码231个和227个氨基酸。以GeneBank上登录的CV777(AF353 511.1)作为参考,分析M基因碱基的变化,发现D1株存在12个核苷酸的插入[TTATGCTAGTAC(35—46)],3个核苷酸的突变(C198T、T388C、C448T),导致氨基酸存在 4氨基酸(MLVL)的插入(13—16)和2个位点的氨基酸发生改变(C134R、L154F)。D3株存在12个核苷酸的突变(G37C、T125C、G180A、C198T、C213T、C222T、C234T、T285C、T348A、A603C、T618C、G640T),导致 3个位点的氨基酸发生改变(E13Q、V42A、A214S)(图 2)。
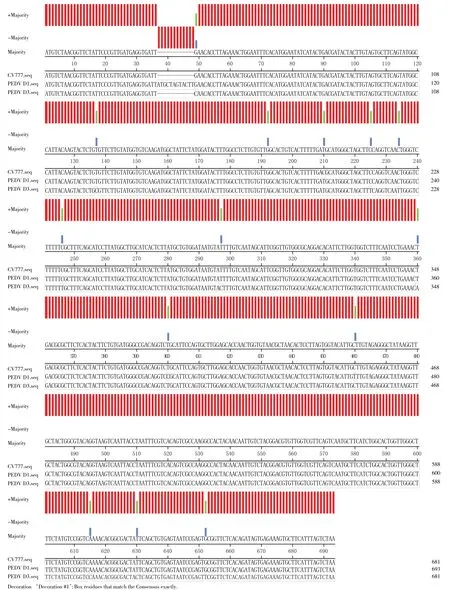
图2 分离株D1和D3的M基因序列Fig.2 M gene sequence of PEDV isolates D1 and D3
2.3 M基因序列同源性及进化树分析
运用DNAStar软件将流行毒株的M基因序列与GenBank上已发表的M基因参考序列进行比较分析,结果显示:流行毒株M基因之间的核酸序列同源性为98.1%,M蛋白之间的氨基酸序列同源性为97.8%;与参考毒株核苷酸和氨基酸的相似性分别为97.2%—100%和96.9%—100%。系统发育树结果表明:流行毒株 D1与参考株 EAS1、SM98、CHM2013分离株亲缘性较近,流行毒株 D3与参考株PEDV-LY、PEDV-WS、CH22分离株亲缘性较近,处于同一分支(图3)。

图3 根据PEDV M基因序列绘制系统进化树Fig.3 Phylogenetic tree based on the sequence of PEDV M gene
2.4 M蛋白二级结构和抗原表位的预测
对PEDV D1株M蛋白来说,Garnier-Robson法计算出特定氨基酸残基在特定结构内部的可能性结果是α-螺旋区域有9个区段,β-折叠区域有18个区段。用Chou-Fasman法预测的结果为α-螺旋区域有1个区段,β-折叠区域有12个区段。用Karplus-Schulz法预测蛋白质骨架区的柔韧性表明:有12个区域为柔韧区域。用Jameson-Wolf法预测M蛋白潜在的抗原决定簇,结果显示:1—10位、18—21位、105—124位和185—228位这几个区段的抗原指数较高。对PEDV D3株M蛋白来说,Garnier-Robson法计算出特定氨基酸残基在特定结构内部的可能性结果是α-螺旋区域有8个区段,β-折叠区域有14个区段。用Chou-Fasman法预测的结果为没有α-螺旋区域,有7个β-折叠区域。用 Karplus-Schulz法预测蛋白质骨架区的柔韧性表明:有8个区域为柔韧区域。用Jameson-Wolf法预测M蛋白潜在的抗原决定簇,结果显示:1—17位、102—118位和182—223位这几个区段的抗原指数较高。对PEDV CV777参考株M蛋白来说,Garnier-Robson法计算出特定氨基酸残基在特定结构内部的可能性结果是α-螺旋区域有10个区段,β-折叠区域有17个区段。用Chou-Fasman法预测的结果是α-螺旋区域有1个区段,β-折叠区域有11个区段。用Karplus-Schulz法预测蛋白质骨架区的柔韧性表明:有12个区域为柔韧区域。用Jameson-Wolf法预测M蛋白潜在的抗原决定簇,结果显示:1—17位、102—118位和182—223位这几个区段的抗原指数较高。
2.5 M蛋白抗原位点在线预测
运用在线软件(http://imed.med.ucm.es/Tools/antigenic.pl)预测可能存在的抗原位点,结果表明:PEDV D1株M蛋白的抗原位点预测分析出7个抗原决定簇,平均抗原倾向为1.0617,其极可能的抗原位点氨基酸残基为4—17位、26—103位、120—126位、132—177位、179—189位、199—205位和208—225位;PEDV D3株M蛋白的抗原位点预测分析出7个抗原决定簇,平均抗原倾向为1.0633,其极可能的抗原位点氨基酸残基为4—14位、22—99位、116—122位、125—173位、175—185位、195—201位和204—222位;PEDV CV777株M蛋白的抗原位点预测分析出7个抗原决定簇,平均抗原倾向为1.0628,其极可能的抗原位点氨基酸残基为4—13位、22—99位、116—122位、125—173位、175—185位、195—201位和204—221位。
3 讨论
自1982年我国首次分离到PEDV后,一些省份或地区陆续有报道 PEDV的感染与发病,PED已经成为我国养猪业主要的传染病之一。从2010年末到现在,PEDV一直持续在我国猪群中流行,导致大量的新生仔猪发病死亡,因此该病的流行引起了人们的广泛关注[6]。从不同省市采集的样品检测结果显示,有些省份PEDV感染率极高,即使未发病猪场也有PEDV的潜在感染[7]。虽然PEDV只有一种血清型,但分子生物学分析表明PEDV的基因组存在基因多样性。本课题组获得了2株中国PEDV毒株的M基因全序列,测序结果显示:与经典株CV777相比,D1株M基因存在12个核苷酸的插入TTATGCTAGTAC(35—46),3个核苷酸的突变(C198T、T388C、C448T),导致蛋白存在4氨基酸(MLVL)的插入(13—16),2个位点的氨基酸发生改变(C134R、L154F);D3株M基因存在12个核苷酸的突变(G37C、T125C、G180A、C198T、C213T、C222T、C234T、T285C、T348A、A603C、T618C、G640T),导致 3个位点的氨基酸发生改变(E13Q、V42A、A214S)。系统发育树结果表明:流行毒株D1与参考株 EAS1、SM98、CHM2013分离株亲缘性较近,流行毒株D3与参考株PEDV-LY、PEDV-WS、CH22分离株亲缘性较近,而均与参考株CV777和早期分离株JS2008的亲缘关系较远。上述研究结果与吴玉璐等[8]、卢冰霞等[9]、黄冬妮等[10]的研究结论一致。另外,本试验发现PEDV D1与D3株核苷酸的插入或突变对M蛋白的二级结构产生了明显的影响,特别是PEDV D1株的抗原性位点也发生了重要变化,这可能是导致经典疫苗株免疫效果不理想的原因之一,这就给PEDV的研究和防控指明了方向。未来的工作更需重视研究PEDV的变异及其对致病力和免疫效果的影响,为新一代PEDV疫苗的研究提供依据。
[1]LEE C.Porcine epidemic diarrhea virus:An emerging and re-emerging epizootic swine virus[J].Virology Journal,2015,12:193.
[2]WANG E,GUO D,LIC,et al.Molecular Characterization of the ORF3 and S1 Genes of Porcine Epidemic Diarrhea Virus Non S-INDEL Strains in Seven Regions of China,2015[J].PLoSONE,2016,11(8):e0160561.
[3]SU Y,LIU Y,CHEN Y,et al.Detection and phylogenetic analysis of porcine epidemic diarrhea virus in central China based on the ORF3 gene and the S1 gene[J].Virol J,2016,13(1):192.
[4]LIZ L,ZHU L,MA JY,et al.Molecular characterization and phylogenetic analysis of porcine epidemic diarrhea virus(PEDV)field strains in south China[J].Virus Genes,2012,45(1):181-185.
[5]CHANG SH,BAE J L,KANG T J,et al.Identification of the epitope region capable of inducing neutralizing antibodies against the porcine epidemic diarrhea virus[J].Mol Cells,2002,14(2):295-299.
[6]朱迪国,宋建德,袁丽萍,等.2013—2014年全球猪流行性腹泻重大疫情分析[J].中国动物检疫,2014,31(10):42-46.
[7]张志,董雅琴,刘爽,等.我国部分省份猪流行性腹泻的流行病学监测[J].中国动物检疫,2014,31(10):47-51.
[8]吴玉璐,虞凌雪,程群,等.猪流行性腹泻病毒 M基因的表达及鉴定[J].中国动物传染病学报,2012,20(6):6-10.
[9]卢冰霞,秦毅斌,何颖,等.2011—2014年广西猪流行性腹泻病毒检测及其 M基因的序列分析[J].中国畜牧兽医,2015,42(3):549-557.
[10]黄冬妮,黄良宗,马春全,等.广东省猪流行性腹泻病毒ORF3和M基因的克隆与序列分析[J].黑龙江畜牧兽医,2015(5):136-139.

