分散固相萃取-气相色谱法测定土壤中的高效氯氰菊酯残留
蔡晓钰,姜 宇,蒋宝南,刘腾飞
(1江苏省水文水资源勘测局苏州分局,苏州215011;2苏州农业职业技术学院,苏州215008;3江苏太湖地区农业科学研究所,苏州215155
高效氯氰菊酯(β-cypermethrin,β-Cyp),又名戊酸氰醚酯,是典型的Ⅱ型拟除虫菊酯类杀虫剂。具有触杀与胃毒作用,通过改变昆虫神经膜的通透性,使中毒昆虫过度兴奋、麻痹而死亡[1-2],是国内外广泛应用的杀虫剂之一。β-Cyp对蜜蜂、鸟类、鱼类、蚕高毒[3-5],对光、热稳定,在农作物生长过程中长期使用,会造成残留和累积,带来严重的环境污染与农产品安全问题。土壤是种植农作物的物质基础,也是农药在环境中迁移转化的重要载体、归宿地和积蓄库。因此,建立简单、快速、准确地测定土壤中β-Cyp的检测方法,对保护土壤环境和农产品安全具有重要意义。
土壤样品基体复杂,含有色素、甾醇、有机酸等多种干扰物,因此,分析测定前需要经过有效的提取方法和净化步骤消除基体干扰。目前,土壤中β-Cyp的分析测定,样品的前处理主要采用传统的振荡法[6-8]、匀浆法[9]等提取技术,以及液液分配[7]、固相萃取[7,9]、柱层析[7-8,10-11]等净化方法,普遍存在操作繁琐、耗费时间、材料成本高、溶剂使用多等不足。分散固相萃取(Dispersive solid phase extraction,DSPE)[12]是近年来发展起来的一种简便、快速、高效、经济的新型样品前处理技术。它利用直接在试样提取液中加入的固相吸附剂对基质中干扰杂质的吸附作用,达到除杂净化的目的。目前在蔬菜、水果等植物性农产品[13-14],肉类、鱼类等动物性食品[15-16],以及土壤等环境样品[17-18]中多种农药残留的检测中已取得了较好的应用效果。但尚未有文献报道将该技术应用于土壤中β-Cyp的净化分析。本试验将DSPE方法应用于土壤样品前处理,结合气相色谱-电子捕获检测法(GC/ECD),建立一种快速、高效、准确地测定土壤中β-Cyp残留量的分析方法。
1 材料与方法
1.1 仪器与设备
7890A气相色谱仪,配电子捕获检测器(ECD)(美国Agilent公司);KQ-500DE超声波清洗器(昆山超声仪器公司);TG16-WS高速离心机(湖南湘仪实验仪器公司);HSC-24 B氮吹仪(天津恒奥科技公司);SX2-4-10马弗炉(上海跃进医疗器械公司);Direct-Q 5 UV超纯水机(美国Millipore公司)。
1.2 药品与试剂
β-Cyp标准溶液,质量浓度100 mg/L,购于农业部环境保护科研监测所;正己烷,色谱纯(瑞典Oceanpak公司);N-丙基乙二胺(PSA),40—60μm(中国Agela Technologies公司);十八烷基硅烷键合硅胶(C18),40—60μm(美国 Sepax Technologies公司);乙腈、氯化钠、无水硫酸镁(620℃灼烧4 h)均为分析纯(上海国药集团化学试剂有限公司)。
1.3 供试土壤
供试土壤取自当地某蔬菜生产基地,采用5点法取样,取样深度为0—15 cm。样品自然风干,除去砂石、草根和其他碎屑,捣碎,充分混匀,四分法取一定量装入自封袋,备用。制备好的土样尽快分析,否则于-18℃冷冻保存。
1.4 试验方法
1.4.1 标准溶液的配制
将100 mg/L的β-Cyp标液从冰箱中取出恢复至室温,取1 mL置于10 mL容量瓶,用正己烷定容,配成10 mg/L的标准储备液。使用时再用正己烷稀释,配制成质量浓度分别为1.0 mg/L、0.5 mg/L、0.2 mg/L、0.05 mg/L和0.02 mg/L的系列标准工作液,贮存于4℃冰箱中,备用。
1.4.2 样品前处理
1.4.2.1 提取
称取5.0 g土样于50 mL聚四氟乙烯离心管中,加入2mL超纯水,涡旋混匀,浸润15min,加入10mL乙腈和2 g氯化钠混匀,超声提取15min,加入2 g无水硫酸镁,涡旋2min,以6 000 r/min离心4min,取上清液待净化。
1.4.2.2 净化
称取150 mg PSA、150 mg C18和300 mg无水硫酸镁于10 mL离心管中,加入4 mL上述待净化的提取液,涡旋2 min,以9 000 r/min离心5 min。转移2 mL上清液,60℃水浴下氮吹近干,定量加入1 mL正己烷溶解残渣,混匀,过0.22μm有机系滤膜,待GC/ECD测定。
1.4.3 色谱条件
色谱柱:HP-5毛细管柱(30 m×0.32 mm×0.25μm);检测器温度300℃;进样口温度250℃;柱箱温度:初始温度180℃,保持2 min,以12℃/min的速率升温至260℃,保持7 min;载气:高纯氮气,流速2.8 mL/min;尾吹气:60 mL/min;进样量 1μL,不分流进样。
1.4.4 添加回收试验
称取5.0 g土壤空白样品3份,分别添加10 mg/L的标准储备液500μL、100μL及1 mg/L的标准工作溶液100μL,添加水平分别相当于1.0 mg/kg、0.2 mg/kg、0.02 mg/kg,充分混匀,静置1 h让溶剂挥发,按前述方法提取、净化和GC/ECD测定,对每个添加水平作3个平行,考察方法的准确度和精密度。
1.4.5 基质效应分析
将土壤空白样品按本试验方法进行前处理,用该空白土壤提取净化液作溶剂,配制系列基质标准溶液。取基质标准溶液与溶剂标准溶液,用GC/ECD进样测定,以标准溶液的质量浓度(x)为横坐标,峰面积响应值(y)为纵坐标,分别绘制基质标准曲线和溶剂标准曲线。
2 结果与讨论
2.1 提取溶剂的选择
文献报道一般采用乙腈[6,9]、丙酮-石油醚[7,11]等对土壤中的 β-Cyp进行提取。本试验在空白土壤中添加 100μL供试农药的标准储备液,比较了乙腈、丙酮-石油醚(1∶1,V/V)、丙酮-石油醚(3∶1,V/V)对样品中β-Cyp的提取效果。结果表明(表1):以乙腈作为提取溶剂时β-Cyp的回收率最高,而且乙腈对土壤基质中的蜡类、脂肪等非极性成分提取能力弱,提取液杂质较少,颜色较浅,有利于简化后续的净化操作,故选择乙腈作为提取溶剂。

表1 不同提取溶剂的回收率结果Table 1 Recoveries of different extraction solvents(n=3) %
2.2 提取方式的选择
超声波法利用超声波的空化作用和热作用,可以加速分析物从样品基体中溶解出来,具有操作简单、节省时间、提取效率高的特点,可以很好地用于批量样品的同时处理中,故选用超声波法提取样品。在空白土壤中添加100μL供试农药的标准储备液,比较了5 min、10 min、15min、20min、30min的超声时间对提取效果的影响。结果表明(图1):超声时间为5min、10 min时,β-Cyp提取回收率偏低,低于80%,延长超声时间至15 min时,回收率有所增高,达到91.5%,进一步延长提取时间,回收率变化不大。为节省样品提取时间,选择超声时间为15min。
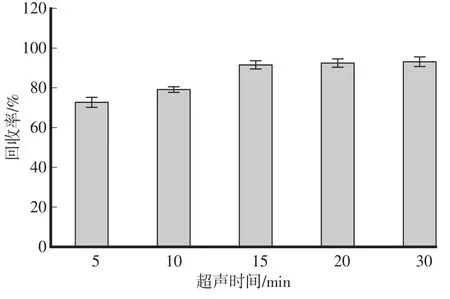
图1 不同超声时间对土壤中β-Cyp提取回收率的影响(n=3)Fig.1 Effect of ultrasonic time durations on extraction efficiencies ofβ-Cyp in soil(n=3)
2.3 净化条件的选择
采用DSPE的方式净化样品,并选用PSA和C18作为分散固相吸附剂,PSA用于去除土壤提取液中的脂肪酸、金属离子、极性色素等干扰物质,C18用于去除甾醇、油脂和弱极性的色素。取4.0 mL空白土壤提取液,加入100μL供试农药的标准储备液,混匀后经PSA和C18吸附剂涡旋净化,比较了不同用量吸附剂对提取液的净化效果及对目标农药回收率的影响。结果表明(表2):随着PSA和C18用量的增加,提取液的净化效果提高,颜色逐渐变浅,但同时目标物β-Cyp的回收率缓慢降低。当PSA和C18用量均为150 mg时,β-Cyp的回收率较好,且此时提取液的颜色较浅,色谱分析时的干扰峰较少。故选择分散吸附剂PSA和C18的用量各为150 mg,同时在提取液中加入300 mg的无水硫酸镁以除去溶剂中残留的少量水分,避免PSA粉末吸水后性能下降。

表2 β-Cyp经C18和PSA吸附剂处理后的回收率结果Table 2 Recoveries ofβ-Cyp after purified by C18 and PSA
2.4 色谱分析结果
在本方法色谱条件下,对β-Cyp标准溶液、土壤空白样品及空白加标样品进行测定,对应的色谱图见图2—图4。从色谱图中可以看出,β-Cyp的保留时间约为10.89 min,峰形良好,无拖尾现象,土样经前处理后,基质中的内源性杂质对其测定没有干扰,说明本方法的色谱条件及前处理条件选择合适。
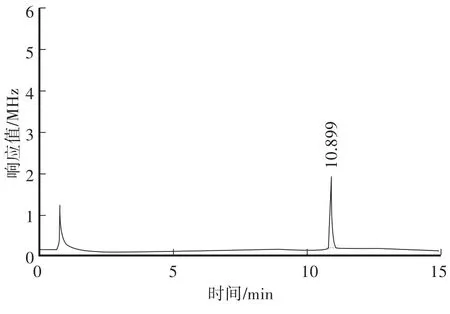
图2 β-Cyp标准溶液(0.2 mg/L)Fig.2 GC ofβ-Cyp standard solution(0.2 mg/L)
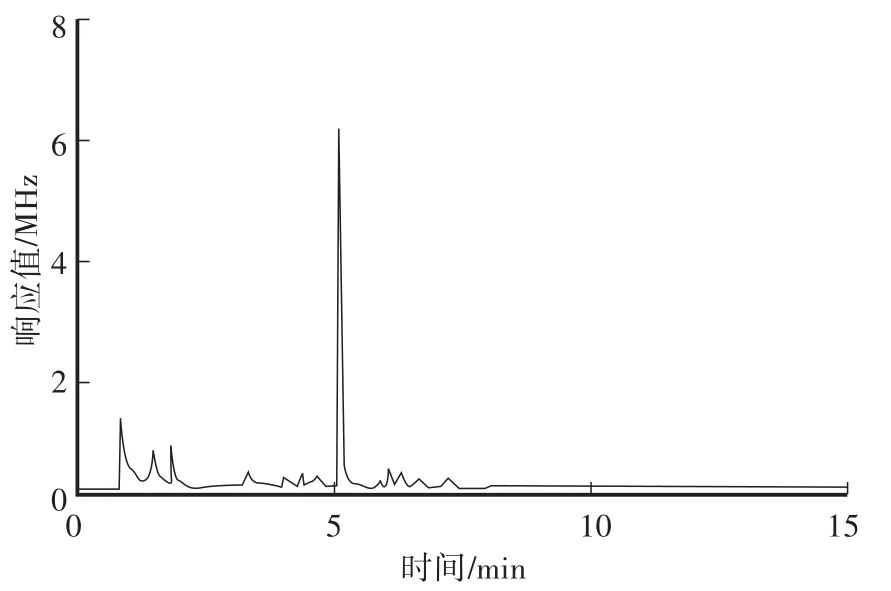
图3 土壤空白样品色谱图Fig.3 GC of a blank soil samp le
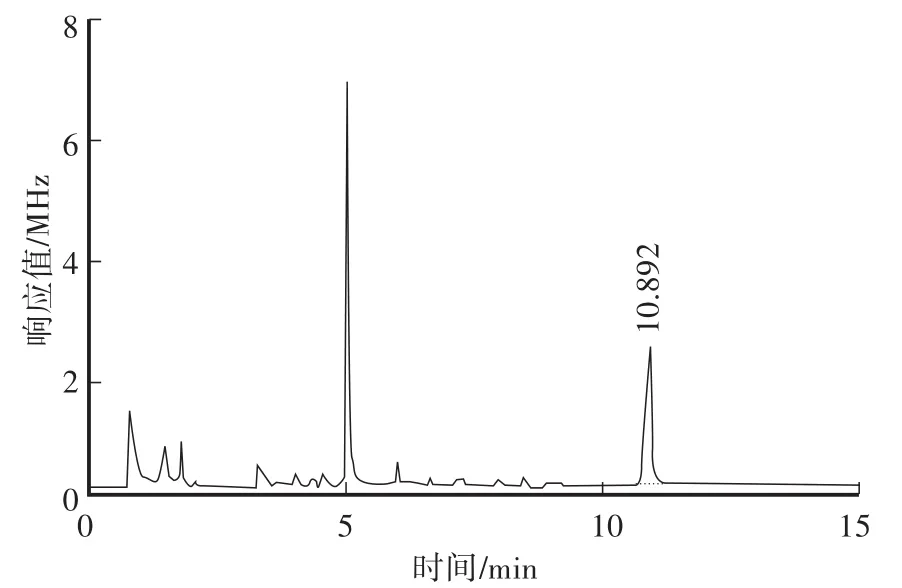
图4 土壤空白加标色谱图(0.2 mg/kg)Fig.4 GC of 0.2 mg/kg spiked soil sam p le
2.5 方法线性范围与标准曲线
取配制好的质量浓度为0.02—1.0 mg/L的β-Cyp系列溶剂标准溶液和基质标准溶液进行GC/ECD测定,以标准溶液的质量浓度(x)为横坐标,对应峰面积(y)为纵坐标,绘制标准曲线。
表3为β-Cyp在溶剂和基质中的标准曲线和相关系数。由表3可以看出,β-Cyp的质量浓度(x)在0.02—1.0 mg/L范围内与峰面积(y)呈良好的线性关系,相关系数均大于0.9930。

表3 β-Cyp的标准曲线与相关系数Table 3 Standard curve equations and correlation coefficients
2.6 基质效应分析
在气相色谱分析中,基质效应可引起分析结果的偏差和对样品分析过程回收率的错误计算[19],所以对基质效应考察评估并采取有效措施进行消除或补偿,是进行农药残留准确分析的重要环节。本试验采用基质标准曲线和溶剂标准曲线的斜率之比(k)评价基质效应[20]:当k在0.9—1.1时,基质效应不明显;当k大于1.1时,为基质增强效应;当k小于0.9时,为基质减弱效应。
根据表3结果,得出β-Cyp的k值为1.3867,表明采用本方法检测土壤叶中的β-Cyp时存在基质增强效应。因此,在使用外标法定量时,采用空白土壤样品的净化液稀释标样,以消除基质干扰,减少误差。
2.7 方法准确度与精密度
表4为土壤中β-Cyp的添加回收率和相对标准偏差。从表4可以看出,当添加浓度为0.02—1.0 mg/kg时,β-Cyp在土壤中的平均回收率为83.8%—100.6%,相对标准偏差(n=3)为3.7%—9.8%,表明该方法具有很好的准确性和精密性,符合农药残留检测的要求[21]。
2.8 方法检出限与定量限
在本方法条件下,对β-Cyp最小添加水平(0.02mg/kg)的土壤样品进行测定,以色谱图中信噪信号的3倍为检出限,以最小添加水平为定量限,得到土壤中β-Cyp的检出限和定量限分别为0.003mg/kg、0.02mg/kg。
2.9 实际样品分析
利用本试验建立的分析方法对当地蔬菜生产基地采集的土壤样品进行检测。结果显示,在被检测的7份土壤样品中,共检出3份土壤样品含有β-Cyp,含量分别为0.0253 mg/kg、0.0304mg/kg、0.0343mg/kg。通过调查,该蔬菜生产基地在取样前曾施用了4.5%高效氯氰菊酯乳油防治青菜和苋菜上的菜青虫,造成了β-Cyp在土壤中的残留,与农药残留分析结果相吻合。

表4 土壤中β-Cyp的添加回收率和相对标准偏差Table 4 Recoveries and relative standard deviations ofβ-Cyp in soil samp le(n=3)
3 结论
本试验以乙腈为提取溶剂,采用超声波法提取,PSA和C18混合吸附剂分散萃取净化,GC/ECD检测,建立了土壤中β-Cyp残留量的分析方法。方法的准确度、精密度和灵敏度均满足残留分析的要求。在0.02—1.0 mg/kg添加水平下,β-Cyp在土壤中的平均回收率为83.8%—100.6%,相对标准偏差小于10%,检出限、定量限分别为0.003 mg/kg、0.02 mg/kg。
该方法操作简单,定量准确,溶剂用量少,对检测条件要求低,易于普及掌握,为土壤中β-Cyp残留的研究提供了可靠的分析手段,对保证农产品安全具有重要意义。
[1]马萍,秦龙娟,张亚然,等.高效氯氰菊酯对小鼠肝细胞的氧化损伤[J].环境科学学报,2012,32(3):757-761.
[2]SODERLUND DM,NIPPLE DC.Themolecular biology of knockdown resistance to pyrethroid insecticides[J].Insect Biochem Mol Biol,2003(33):563-577.
[3]王健,刘丽丽,余凯敏,等.高效氯氰菊酯对斑马鱼胚胎毒性的研究[J].生物技术通报,2014,(10):223-229.
[4]李前龙,唐旭东,徐莉,等.不同温度下5种拟除虫菊酯类农药对家蚕的毒性变化[J].蚕业科学,2013(1):70-75.
[5]许迪,潘竟林,刘万强,等.多杀菌素、阿维菌素乳油和高效氯氰菊酯3种农药对环境生物的安全性评价[J].生态毒理学报,2013,8(6):897-902.
[6]何华,徐存华,孙成,等.高效氯氰菊酯在土壤中的降解动态[J].中国环境科学,2003,23(5):490-492.
[7]代雪芳,毛佳,宋爽,等.高效氯氰菊酯在苜蓿和土壤中的残留及消解动态[J].西南农业学报,2014,27(2):658-663.
[8]卢洪秀,陈俊,马步春.混合农药在甘蓝及土壤中的残留动态研究[J].上海农业学报,2014,30(3):82-88.
[9]王彦辉,柏连阳,李欣,等.高效氯氰菊酯在柑橘和土壤中的残留消解动态[J].农药,2011,50(6):428-430.
[10]丁蕊艳,陈子雷,杨国生.凝胶渗透色谱净化-气相色谱法测定高效氯氰菊酯在棉花及土壤中的残留[J].农药,2012,51(11):822-824.
[11]王飞,王军,李纯.高效氯氰菊酯在苹果和土壤中的消解动态及残留安全性评价[J].安徽农业科学,2010,38(20):10837-10838.
[12]ANASTASSIADESM,LEHOTAY S J,STAJNBAHER D,et al.Fast and easymultiresiduemethod employing acetonitrile extraction/partitioning and“dispersive solid-phase extraction”for the determination of pesticide residues in produce[J].JAOAC Int,2003,86(2):412-431.
[13]KAEWSUY A P,BREWERW E,WONG J,et al.Automated QuEChERS tips for analysis of pesticide residues in fruits and vegetables by GCMS[J].JAgric Food Chem,2013,61(10):2299-2314.
[14]ALBERT A,KRAMER A,SCHEEREN S,et al.Rapid and quantitative analysis of pesticides in fruits by QuEChERS pretreatment and lowtemperature plasma desorption/ionization orbitrap mass spectrometry[J].Anal Methods,2014,15(15):5463-5471.
[15]苏明明,董振霖,徐静,等.QuEChERS法联合在线凝胶过滤色谱-气相色谱-质谱联用法快速测定鱼肉中16种农药残留量[J].食品安全质量检测学报,2014,5(6):1757-1764.
[16]郭礼强,宫小明,丁葵英,等.基于QuEChERS提取的液相色谱-串联质谱法测定干腌火腿中15种真菌毒素[J].分析测试学报,2015,34(2):141-146.
[17]刘腾飞,杨代凤,董明辉,等.茶园土壤中有机磷农药的分散固相萃取-气相色谱测定[J].上海农业学报,2016,32(2):70-74.
[18]AKAMATSU M,TSUJITA K,PITIYONT V,et al.Pesticide residue analyses of soils collected from suburban agricultural fields around Bangkok[J].Trop Agr Develop,2013,57(1):8-15.
[19]刘腾飞,张丽,杨代凤,等.茶园土壤中拟除虫菊酯类农药残留检测[J].江苏农业学报,2015,31(4):935-941.
[20]蒋宝南,刘腾飞,单建明,等.QuEChERS-GC/μECD法测定土壤中的毒死蜱残留量[J].江苏农业科学,2014,42(12):332-335.
[21]中华人良共和国农业部.中华人民共和国农业行业标准-农药残留试验准则NY/T788-2004[S/J].农产品质量与安全,2004(4):29-33.

