microRNA-7对人肝癌细胞MHCC-97H上皮间质转化的影响及作用机制
张传海,桂 阳*,郭凤林,马金良,余继海
microRNA是一类约22个碱基的小分子非编码RNA,对细胞的增殖、分化具有重要的调控作用,已成为近年来医学研究的热点。microRNA通常与下游靶基因mRNA的3’端非翻译区(3’-untranslated region,3’-UTR)结合,从而促使靶基因降解或抑制其翻译,尤其在肿瘤的发生发展中扮演着重要角色[1-2]。肝癌以其恶性程度高、转移性强成为临床治疗当中的难题,尤其是其转移机制目前还不是十分清楚。该课题旨在通过研究miR-7对肝癌细胞株MHCC-97H细胞上皮-间质转化(epithelial-mesenchymal transition,EMT)的影响及作用机制,为深入探讨其在肝癌中的作用奠定基础,为进一步阐明肝癌的发生、转移机制及临床治疗提供新思路。
1 材料与方法
1.1材料肝癌细胞株MHCC-97购自中国科学院上海细胞库;pRL-TK载体购自上海林渊生物科技有限公司;RNA提取试剂盒、反转录试剂盒、Real-time PCR试剂购自北京天根生化科技有限公司;RPMI1640细胞培养基、胎牛血清购自美国Gibco公司;RIPA细胞裂解液、BCA蛋白定量试剂盒购自上海碧云天生物技术研究所;GAPDH、E-钙黏蛋白(E-cadherin)、β-链蛋白(β-catenin)、N-钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)抗体购自美国Santa Cruz公司;表皮生长因子受体(epithelial growth factor receptor,EGFR)、p-EGFR抗体购自美国Bioworld公司;双荧光素酶报告基因检测试剂盒购自美国Promega公司;PCR引物购自美国Invitrogen公司。
1.2方法
1.2.1细胞培养 MHCC-97H细胞快速复苏后,1 000 r/min离心5 min,弃上清液,使用完全培养基制成单细胞悬液,接种于细胞培养瓶,37 ℃、5%CO2培养箱中培养。隔天换液、观察细胞生长状况,当细胞汇合度约为90%时,进行消化、传代、种板,按1×105/孔接种于6孔细胞培养板。继续培养细胞至汇合度为80%时,将培养基更换为无血清RPMI 1640培养基,进行后续实验。
1.2.2载体构建 miR-7真核载体(GV268/miR-7)、野生型和突变型EGFR 3’-UTR荧光素酶载体(GV272/ EGFR 3’-UTR wt和GV272/ EGFR 3’-UTR mu),均由上海吉凯基因化学技术有限公司构建,经鉴定证实构建成功。
1.2.3细胞转染 当细胞汇合度约为90%时,进行消化、计数,按1×105/孔接种于24孔细胞培养板。继续培养细胞至汇合度为80%时,更换培养基为无血清、无抗生素培养基,使用Lipofectamine 2000并参考其说明书进行细胞转染。
1.2.4Real-time PCR 预冷的PBS洗涤细胞3次,参照RNA和microRNA提取试剂盒说明书提取细胞总RNA和microRNA。以总RNA和microRNA为模板,参照逆转录试剂盒说明书合成cDNA第一链。以cDNA为模板,使用ABI7500 Real-time PCR仪检测相关基因的表达。MiR-7和U6引物序列分别为:上游引物 :5′-TGGAAGACTAGTGATT-3′和上游引物:5′-TGCGGGTGCTCGCTTCGGCAGC-3′,下游引物为通用引物;Real-time PCR反应程序为:95 ℃、15 min;95 ℃、20 s;60 ℃、34 s,以U6为内参,采用2-ΔΔCt法比较分析miR-7表达。E-cadherin上游引物:5′-TCGCTTACACCATCCTCAGC-3′, 下游引物:5′-GGAAACTCTCTCGGTCCAGC-3′;β-catenin上游引物:5′-ACCACAAGCAGAGTGCTGAA-3′, 下游引物:5′-GCTTGCATTCCACCAGCTTC-3′;N-cadherin上游引物:5′-AACAGCAACGACGGGTTAGT-3′, 下游引物:5′-CAGACACGGTTGCAGTTGAC-3′;Vimentin上游引物:5′-AGGCGAGGAGAGCAGGATTT-3′, 下游引物:5′-AGTGGGTATCAACCAGAGGGA-3′;EGFR上游引物:5′-CGAATGGGCCTAAGATCCCG-3′,下游引物:5′-AGCTTGGTTGGGAGCTTCTC-3′;GAPDH上游引物:5′-GCCGCATCTTCTTTTGCGTC-3′,下游引物:5′-TACGACCAAATCCGTTGACTCC-3′;Real-time PCR反应程序为:95 ℃、15 s;60 ℃、1 min,以GAPDH为内参,采用2-ΔΔCt法比较分析各基因表达。
1.2.5Western blot RIPA细胞裂解液提取细胞总蛋白,BCA法定量后,按50 μg/孔的量加样、电泳、转膜。转膜结束后,5%脱脂奶粉室温封闭1.5 h,TBST洗膜3 min。各蛋白抗体分别参考抗体说明书进行操作,4 ℃孵育过夜,TBST洗膜3次,每次5 min。相应二抗室温孵育1.5 h,TBST洗膜3次,每次10 min;ECL发光、显影,以GAPDH为内参,分析各指标的相对表达量。
1.2.6双荧光素酶报告基因实验 将H293T细胞以每孔1×105个细胞的密度接种于24孔板中,当80%的细胞融合时,利用Lipofectamine 2000共转染(含有GV268/miR-7+野生型或突变型GV272/EGFR 3’UTR)细胞,常规培养24 h后,按照双荧光素酶报告基因检测试剂盒说明书进行操作,以海肾荧光素酶载体(pRL-TK)作为参照,化学发光仪检测、分析各组萤火虫荧光素酶活性变化,判定miR-7是否与EGFR 3’UTR结合。
1.2.7细胞划痕 取处于对数生长期的细胞,胰酶消化后,加入RPMI 1640培养基重悬为单细胞悬液。细胞计数板计数,以1×106/孔种入12孔细胞培养板,培养箱中过夜培养。待细胞长成单层即弃去培养液,用ø 1.0 μm的划痕器在每孔中央划出一划痕,无菌PBS洗去脱落细胞,100倍光学显微镜下拍照,即为0 h。然后将细胞置于培养箱中分别继续培养24、48 h后,在同一观察点处进行拍照、记录细胞生长情况。利用Image Pro Plus 6.0软件测量每孔多个点划痕间距,取平均值,计算迁移率,即细胞迁移率(%)=(划痕宽度0 h-划痕宽度24 h/48 h)/划痕宽度0 h×100%。
1.2.8Transwell实验 胰酶消化细胞后,用无血清DMEM培养基重悬、调整细胞浓度,以每孔1×104个的细胞密度加入到预铺好Matrigel基质胶的Transwell小室的上室内,下室加入500 ml完全培养液,37 ℃、5%CO2培养箱中培养24 h。取出上室,4%多聚甲醛固定15 min,结晶紫染色1 min,蒸馏水清洗3次,每次3 min。以正常组作为对照,200倍光学显微镜下观察、计数穿膜细胞数,随机选取5个视野。
1.3实验分组本研究共分为2部分,第一部分miR-7对MHCC-97H细胞EMT的影响,分组为正常组、转染GV268组和转染GV268/miR-7组,分别标记为Normal、GV268和GV268/miR-7;第二部分为miR-7对EGFR 3’-UTR及EGFR表达的影响,分组为正常组、转染GV272/EGFR 3’-UTR wt和GV272/EGFR 3’-UTR mu组,分别标记为Normal、GV272/EGFR 3’-UTR wt和GV272/EGFR 3’-UTR mu。

2 结果
2.1载体构建结果经测序鉴定GV268/miR-7、GV272/ EGFR 3’-UTR wt和GV272/ EGFR 3’-UTR mu序列均与设计序列一致,无碱基突变,表明构建成功。见图1。
2.2miR-7对MHCC-97细胞侵袭能力的影响Transwell结果显示,与Normal组相比,GV268/miR-7组细胞失去MHCC-97H细胞的基本形态,呈不规则形,且穿透基底膜的细胞数量显著下降(F=2.595,P=0.000),细胞侵袭能力为正常组的(41.82±11.28)%。见图2。
图1 载体测序比对结果
2.3miR-7对MHCC-97细胞迁移能力的影响与Normal组相比,GV268/miR-7组细胞24、48 h的迁移能力均显著降低,差异有统计学意义(F=2.082、2.790,P=0.002、0.000),其迁移力分别降低(32.19±9.15)%和(45.67±10.07)%。见图3。
2.4miR-7对EMT相关标识蛋白的影响Real-time PCR和Western blot分析结果显示,与正常组相比,转染GV268/miR-7组E-cadherin mRNA和蛋白表达显著升高(F=12.740、1.241,P=0.000、0.001),β-catenin mRNA和蛋白表达显著升高(F=55.870、1.550,P=0.000、0.000),N-cadherin mRNA和蛋白表达明显降低(F=30.570、1.257,P=0.000、0.001),Vimentin mRNA和蛋白表达明显降低(F=42.710、3.600,P=0.000、0.000)。见图4。
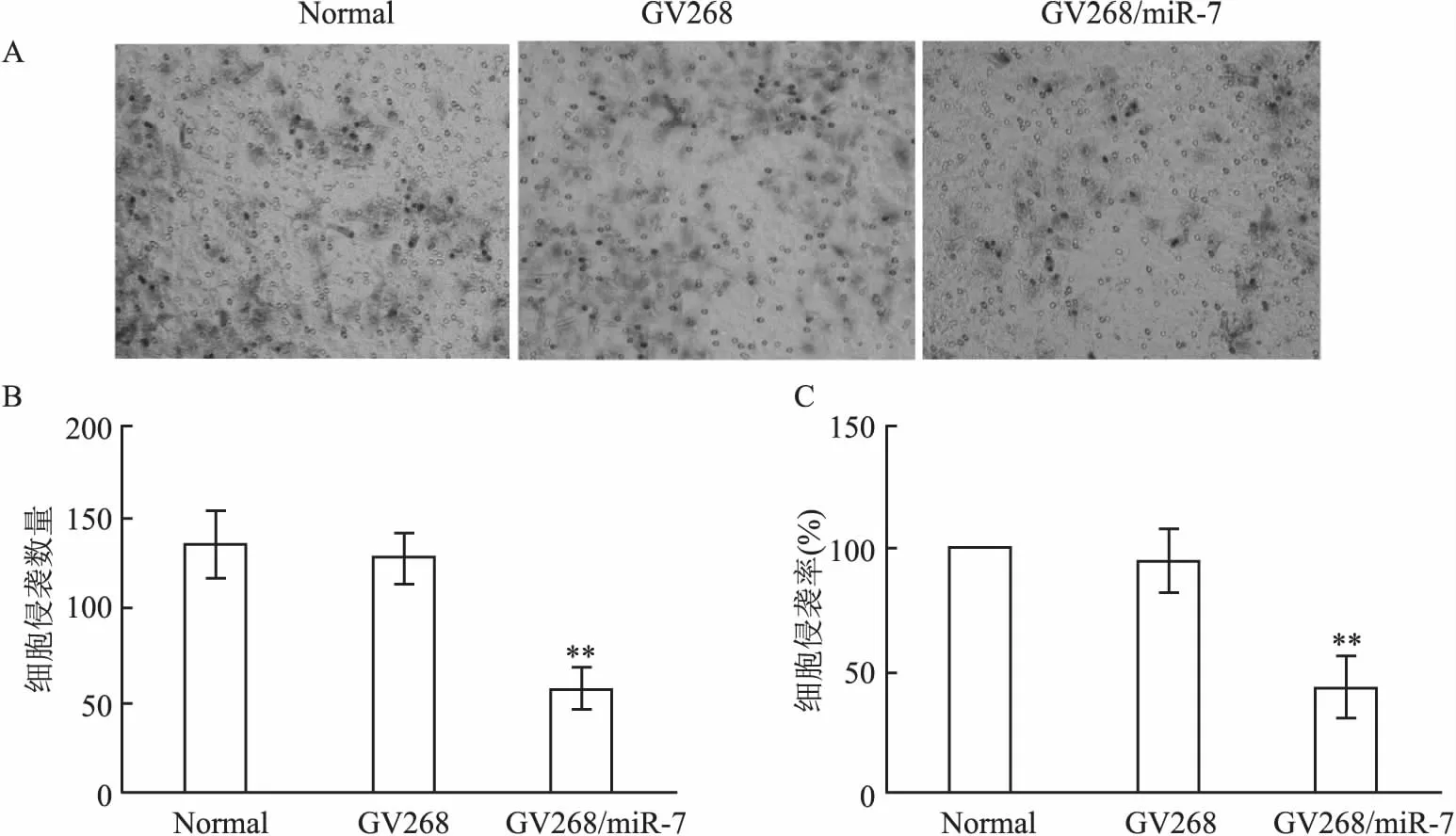
图2 miR-7对MHCC-97细胞侵袭能力的影响
A:不同组别细胞穿透Transwell小室的苏木精染色结果(×200);B:不同组别穿透Transwell小室的细胞数量;C:不同组别细胞侵袭能力比较分析;与Normal组比较:**P<0.01

图3 miR-7对MHCC-97细胞迁移能力的影响
A:细胞划痕检测不同组别细胞的迁移情况(×100);B:不同组别细胞迁移能力的比较分析;与Normal组比较:**P<0.01
2.5miR-7对EGFR和p-EGFR表达的影响与Normal组相比,GV268/miR-7组EGFR mRNA和蛋白表达均显著下降(F=4.602、2.196,P=0.000、0.002),p-EGFR蛋白表达也显著降低(F=3.707,P=0.003)表明miR-7可抑制EGFR和p-EGFR的表达。见图5。
2.6miR-7对EGFR3’-UTR活性的影响双荧光素酶活性检测分析结果显示:与GV268/miR-7+GV272相比,GV268/miR-7+GV272/EGFR 3’-UTRwt组荧光素酶活性显著降低(F=1.690,P=0.000),而GV268/miR-7+GV272/EGFR 3’-UTR mu组荧光素酶活性无明显变化,表明miR-7与EGFR 3’-UTR区域存在结合位点,且二者可以结合,结合位点位于EGFR 3’-UTR区域内,序列为:GTCTTCCA。见图6。
3 讨论
肝癌以恶性程度高、转移能力强、预后差成为了临床治疗的难题,而如何降低肝癌转移能力成为急需解决的问题。近年来的研究[3]表明,EMT与肝癌细胞的侵袭、迁移关系密切,并且课题组前期的研究[4]也已经证实。EMT是指上皮细胞的生物过程通过特定程序转化成间质细胞,其在胚胎发育、慢性炎症反应、癌症转移发挥着关键作用[5-7]。EMT发生的主要标志为上皮标志物E-cadherin和β-catenin的减少和间质标记物E-cadherin和β-catenin的增加[8-10]。其通过表达更具有侵入性的蛋白酶,减弱肿瘤细胞间的黏附能力,使得肿瘤细胞具有运动活性,增加远处转移能力和形成转移灶。据报道[11-12],一些miRNA如miR-7、miR-200、miR-429、miR-141可以促进或抑制癌症转移和通过调节EMT的侵袭。

图4 miR-7对MHCC-97H细胞EMT标识基因表达的影响
A:miR-7对EMT标识基因mRNA表达水平的影响;B:Western blot检测miR-7对EMT标识蛋白表达的影响;C:miR-7对EMT标识蛋白表达水平的影响;与Normal组比较:**P<0.01

图5 miR-7对EGFR和p-EGFR表达的影响
A:miR-7对EGFR mRNA表达水平的影响;B:Western blot检测miR-7对EGFR和p-EGFR蛋白的影响;C:miR-7对EGFR和p-EGFR蛋白表达影响的分析;与Normal组比较:**P<0.01

图6 miR-7对EGFR 3’-UTR萤火虫荧光素酶活性的影响
1:转染GV272组;2:转染GV272+GV268/miR-7组;3:转染GV268+GV272/EGFR 3’-UTR wt组;4:转染GV268+GV272/EGFR 3’-UTR mu组;5:转染GV268/miR-7+GV272/EGFR 3’-UTR wt组;6:转染GV268/miR-7+GV272/EGFR 3’-UTR mu组;与转染GV268+GV272/EGFR 3’-UTR wt组比较:**P<0.01;与转染GV268/miR-7+GV272/EGFR 3’-UTR mu组比较:##P<0.01
miR-7作为肿瘤抑制性微小RNA首先在胶质母细胞瘤中被鉴定出来,其可通过靶向调控PAK1和EGFR信号通路抑制胶质母细胞瘤生长和侵袭[13-14]。研究[15-16]表明,miR-7在乳腺、舌、胃、肺和肝等肿瘤组织中下调。虽然许多研究[17-18]报道了miR-7的作用,但是其对肝癌细胞EMT的影响及作用机制研究的较少。因此,本研究运用Real-time PCR、Western blot和免疫组化,验证了过表达miR-7可降低MHCC-97H细胞的侵袭、迁移能力,提高上皮标识蛋白E-cadherin和β-catenin的表达,降低间质标识蛋白N-cadherin和Vimentin的表达,进而抑制MHCC-97H细胞EMT。
EGFR具有酪氨酸激酶受体家族的基本生物学功能,包括调控细胞活性、增殖、迁移和分化等,EGFR突变或过表达与肿瘤的发生发展有着密切联系[19]。本研究运用生物信息学预测,通过构建双荧光素酶报告基因载体,证明了miR-7可直接靶向调控EGFR,抑制EGFR及p-EGFR表达,进而降低MHCC-97H细胞的侵袭、迁移能力,初步阐明了miR-7调控MHCC-97细胞EMT的作用机制,为深入研究其对MHCC-97细胞的影响奠定了基础。然而,由于miR-7作用途径的多样性,后期本研究将通过更加深入、广泛的研究,进一步阐述其在肝癌中的生物学功能。
[1] 王 艳,吴 强,胡向阳,等.不同侵袭力乳腺癌细胞miRNAs表达谱检测[J].安徽医科大学学报,2010,45(3):302-5.
[2] Varnholt H, Drebber U, Schulze F, et al. MicroRNA gene expression profiles of heatitis C virus- associated hepocellular carcinoma[J]. Hepatology, 2008,47(4):1223-32.
[3] Lee T K, Man K, Poon R T, et al. Signal transducers and activators of transcription 5b activation enhances hepatocellular carcinoma aggressiveness through induction of epithelial-mesenchymal transition[J].Cancer Res,2006,66(20):9948-56.
[4] Zhang C, Guo F, Xu G, et al. STAT3 cooperates with Twist to mediate epithelial-mesenchymal transition in human hepatocellular carcinoma cells[J]. Oncol Rep, 2015, 33(4):1872-82.
[5] Hua K, Jin J, Zhang H,et al.MicroRNA-7 inhibits proliferation,migration and invasion of thyroid papillary cancer cellsviatargeting CKS2[J].Int J Oncol, 2016,49(4):1531-40.
[6] Liu W, Zhang Y, Xia P,et al.MicroRNA-7 regulates IL-1β-induced extracellular matrix degeneration by targeting GDF5 in human nucleus pulposus cells[J].Biomed Pharmacother,2016, 83:1414-21.
[7] Sun X, Li J, Sun Y,et al.miR-7 reverses the resistance to BRAFi in melanoma by targeting EGFR/IGF-1R/CRAF and inhibiting the MAPK and PI3K/AKT signaling pathways[J].Oncotarget,2016,7(33):53558-70.
[8] Yue K, Wang X, Wu Y,et al. microRNA-7 regulates cell growth, migration and invasionviadirect targeting of PAK1 in thyroid cancer[J].Mol Med Rep, 2016,14(3):2127-34.
[9] Zhao J, Wang K, Liao Z, et al. Promoter mutation of tumor suppressor microRNA-7 is associated with poor prognosis of lung cancer[J].Mol Clin Oncol,2015,3(6):1329-36.
[10] Zhao J G, Men W F, Tang J. MicroRNA-7 enhances cytotoxicity induced by gefitinib in non-small cell lung cancerviainhibiting the EGFR and IGF1R signalling pathways[J].Contemp Oncol (Pozn),2015,19(3):201-6.
[11] Glover A R,Zhao J T,Gill A J,et al.microRNA-7 as a tumor suppressor and novel therapeutic for adrenocortical carcinoma[J].Oncotarget,2015,6(34):36675-88.
[12] Hao Z, Yang J, Wang C,et al.MicroRNA-7 inhibits metastasis and invasion through targeting focal adhesion kinase in cervical cancer[J].Int J Clin Exp Med,2015,8(1):480-7.
[13] Suto T, Yokobori T, Yajima R, et al. MicroRNA-7 expression in colorectal cancer is associated with poor prognosis and regulates cetuximab sensitivityviaEGFR regulation[J].Carcinogenesis,2015,36(3):338-45.
[14] Wang B, Sun F, Dong N, et al. MicroRNA-7 directly targets insulin-like growth factor 1 receptor to inhibit cellular growth and glucose metabolism in gliomas[J]. Diagn Pathol,2014,9:211.
[15] Zhou X, Hu Y, Dai L, et al. MicroRNA-7 inhibits tumor metastasis and reverses epithelial-mesenchymal transition through AKT/ERK1/2 inactivation by targeting EGFR in epithelial ovarian cancer[J].PLoS One,2014,9(5):e96718.
[16] Liu Z, Jiang Z, Huang J,et al. miR-7 inhibits glioblastoma growth by simultaneously interfering with the PI3K/ATK and Raf/MEK/ERK pathways[J].Int J Oncol,2014,44(5):1571-80.
[17] Kong X, Li G, Yuan Y, et al.MicroRNA-7 inhibits epithelial-to-mesenchymal transition and metastasis of breast cancer cells via targeting FAK expression[J].PLoS One,2012,7(8):e41523.
[18] Xiong S, Zheng Y, Jiang P, et al.PA28gamma emerges as a novel functional target of tumour suppressor microRNA-7 in non-small-cell lung cancer[J].Br J Cancer,2014,110(2):353-62.
[19] Li L, Zhang Z, Bie Z,et al. Epidermal growth factor receptor mutation analysis in cytological specimens and responsiveness to gefitinib in advanced non-small cell lung cancer patients[J].Chin J Cancer Res,2015,27(3):294-300.

