镉对小鼠睾丸间质细胞睾酮合成的影响
朱文祥,刘洪茂,穆柯瀚,姬艳丽,,徐德祥
目的探讨镉对小鼠睾丸间质细胞睾酮合成的影响。方法镉处理组采用20 μmol/L CdCl2处理TM3细胞,分别在加入CdCl24 h和8 h后收集细胞上清液,对照组TM3细胞给予等容积磷酸盐缓冲液(DPBS)。采用ELISA法测定细胞上清液中睾酮含量,采用RT-PCR和Western blot技术检测睾酮合成关键酶mRNA和蛋白表达水平。结果镉处理组细胞上清液中睾酮含量明显降低(P<0.01)。与对照组相比,镉显著下调TM3细胞类固醇激素合成急性调控蛋白(StAR)、细胞色素P450胆固醇侧链裂解酶(P450scc)与17β-羟类固醇脱氢酶(17β-HSD) mRNA表达(P<0.01),镉处理组TM3细胞StAR、P450SCC、细胞色素P45017α-羟化酶(P45017α)、3β-HSD与17β-HSD的蛋白表达水平也明显降低,与对照组相比,差异均有统计学意义(P<0.05,P<0.01)。结论镉抑制小鼠睾丸间质细胞睾酮的分泌,其原因可能与镉抑制间质细胞部分睾酮合成关键酶mRNA和蛋白表达水平有关。
镉;睾丸间质细胞;睾酮;睾酮合成
镉的男(雄)性生殖毒性作用已经受到越来越多的关注。该课题组前期研究[1]显示,非职业人群中男性精液镉浓度与精子质量呈明显负相关性。目前更多的研究[2-3]证实了这一结论,即精浆中镉浓度与精子浓度及精子活力呈负相关性,与畸形精子百分比呈正相关性,甚至精液中很低浓度的镉都可能通过降低精子质量而引起男性不育。动物实验进一步证明:镉能够诱导成年雄性大鼠或小鼠出现明显的睾丸损伤、精子数量减少、精子活力下降甚至不育[4-5]。该课题组前期体内研究结果[6]也表明,青春期镉处理能够损害睾丸发育,抑制睾酮合成。但目前对镉抑制睾酮合成的分子机制尚未阐明。
睾酮是重要的雄激素之一,主要由睾丸间质细胞合成分泌。该文以小鼠睾丸间质细胞系TM3细胞为研究对象,探讨镉对TM3细胞睾酮合成的影响及可能的分子机制,为科学地评价镉对男(雄)性生殖系统的毒性作用提供理论依据。
1 材料与方法
1.1细胞株与主要试剂氯化镉(CdCl2)购自美国Sigma公司;聚偏二氟乙烯(polyvinylidene fluoride, PVDF)膜购自美国Millipore公司;化学发光显影试剂盒、细胞培养箱购自美国Thermo公司;β-actin、类固醇激素合成急性调控蛋白(steroidogenic acute regulatory protein, StAR)、细胞色素P450胆固醇侧链裂解酶(P450 side-chain cleavage enzyme, P450scc)、3β-羟类固醇脱氢酶(3β-hydroxysteroid dehydrogenase, 3β-HSD)、细胞色素P45017α-羟化酶(P45017α-hydroxylase enzyme, P45017α)、17β-HSD抗体购自美国Santa Cruz公司;睾酮ELISA测定试剂盒购自苏州卡尔文生物科技有限司;18S、StAR、P450scc和17β-HSD特异性引物由上海生工生物工程技术服务公司合成;等容积磷酸盐缓冲液(dulbecco phosphate-buffered saline, DPBS)及DMEM/F12培养基购自美国Hyclone公司;胰蛋白酶、青霉素-链霉素溶液、马血清及胎牛血清购自江苏碧云天生物技术有限公司;细胞培养瓶、培养皿和培养板购自美国Corning公司;光学倒置显微镜购自德国OLYMPUS公司;多规格制胶玻璃板、电泳仪和转膜仪购自北京六一生物科技有限公司;Tanon全自动化学发光显影仪及Tanon全自动化学发光图像分析系统购自上海天能科技有限公司;罗氏Light Cycler 480实时荧光定量PCR仪及PCR仪统计分析软件购自瑞士Roch公司;小鼠睾丸间质细胞系TM3细胞购自中国科学院上海生命科学研究院。
1.2细胞培养和处理TM3细胞在75 cm2培养瓶中贴壁培养,DMEM/F12培养基含5%灭活胎牛血清、2.5%灭活马血清以及1%青霉素-链霉素溶液,放到恒温环境37 ℃和5% CO2培养箱中培养加样器接种细胞于96孔板中,每板分为3组,每组10孔,每孔100 μl(约104个细胞),外围一圈孔加DPBS或培养液保湿,将96孔板置于恒温37 ℃、5% CO2细胞培养箱中培养18 h后开始染毒,CdCl2染毒剂量为20 μmol/L,对照组加相应体积的DPBS,4 h后收细胞上清液即为镉处理4 h组,再过4 h后收对照组和镉处理8 h组的细胞上清液,此处收集的细胞上清液用于ELISA实验;加样器接种细胞于6个90 mm培养皿中,每个皿加10 ml细胞悬液,每组2个皿的细胞,置于恒温37 ℃、5%CO2培养箱中培养36 h,然后更换培养基培养液开始染毒,CdCl2染毒剂量为20 μmol/L,对照组加相应体积的DPBS缓冲液,4 h后收细胞即为镉处理4 h组,再过4 h后收对照组和镉处理8 h组的细胞,此处收集的细胞用于Western blot实验;加样器接种细胞于12个25 cm2培养瓶中,每组4瓶,每瓶加10 ml细胞悬液,置于恒温37 ℃、5% CO2培养箱中培养36 h,待细胞长满后然开始染毒8 h组和对照组,CdCl2染毒剂量为20 μmol/L,对照组加相应体积的DPBS缓冲液,4 h后收细胞为镉处理4 h组,再过4 h后收对照组和镉处理8 h组的细胞,此处收集的细胞用于RT-PCR实验。
1.3ELISA法测定细胞上清液中睾酮含量20 μmol/L CdCl2处理不同时间(4、8 h)后收集细胞培养液,低速常温离心机1 000 r/min离心10 min后收集上清液,置于-20 ℃冰箱中储存待用。用ELISA试剂盒检测细胞上清液中睾酮的含量。具体操作步骤为:先把睾酮试剂盒从4 ℃冰箱中取出,使用前先室温平衡20 min,从铝箔袋中取出所需的板条;20×洗涤缓冲液稀释成1×洗涤缓冲液以备使用。在样品孔中加入10 μl细胞上清液和40 μl稀释液;标准品孔分别加入不同浓度(0、50、 100、200、400、800 pg/ml)的标准品50 μl;空白孔不加。在每个孔中都加入辣根过氧化物酶标记的抗体100 μl(除空白孔外),用封板膜将反应孔封住,放入37 ℃恒温箱中孵育60 min。倒去反应液体,在干燥的吸水纸上把液体拍干;在每个孔中再加入200 μl洗涤液洗涤,如此重复洗涤5次;每孔中分别加入50 μl的底物A液和50 μl的底物B液,放入37 ℃恒温箱中避光孵育15 min。反应结束后,在每孔中分别加入50 μl的终止液,混匀,利用底物四甲基联苯胺与辣根过氧化物酶发生反应而呈现蓝色,再加入终止液,在酸的作用下最终转变为黄色。反应颜色的深浅程度和细胞上清液中睾酮的含量呈线性关系。在15 min内,用酶标仪(波长450 nm)测量各孔的吸光度值,重复测量3次,每孔的吸光度值取3次测量的平均值。在Excel表中,以标准品的浓度作为横坐标,对应标准品的吸光度值作为纵坐标,绘制出标准品的标准曲线,按照曲线方程计算各孔中细胞上清液睾酮的含量。
1.4RT-PCR反应20 μmol/L CdCl2处理不同时间(4、8 h)后收集细胞,倒去培养瓶中的培养液,用DPBS将瓶中的细胞洗2~3遍,用TRIzol裂解液提取细胞总RNA,随后用AMV法对细胞样品RNA进行逆转录,逆转录合成cDNA,置于-20 ℃或-80 ℃冰箱中储存待用。扩增反应使用LightCycler®480 PCR仪,扩增条件为:95 ℃预变性10 min,然后按95 ℃变性15 s、60 ℃退火15 s、72 ℃延伸30 s的程序进行45次循环反应[7]。末次循环后,在电脑上进行溶解曲线分析以检测cDNA的含量,按 2-ΔΔCT法计算目标基因相对比值,用18 S作为实验的内对照。本实验扩增所使用的引物序列如下所示:18 S的正向引物:5′-GTAACCCGTTGAACCCCATT-3′,反向引物:5′-CCATCCAATCGGTAGTAGCG-3′;StAR的正向引物:5′-TGTCAAGGAGATCAAGGTCCTG-3′,反向引物:5′-CGATAGGACCTGGTTGATGAT-3′;P450scc的正向引物:5′-AGGTGTAGCTCAGGACTTCA-3′,反向引物:5′-AGGAGGCTATAAAGGACACC-3′;17β-HSD的正向引物:5′- ATTTTACCAGAGAAGACATCT-3′,反向引物:5′- GGGGTCAGCACCTGAATAATG-3′。
1.5Westernblot检测相关蛋白的表达20 μmol/L CdCl2处理不同时间(4、8 h)后收集细胞,倒去培养瓶中的培养液,用DPBS将瓶中的细胞洗2~3遍,用RIPA裂解液提取细胞总蛋白,采用BCA浓度测定试剂盒进行蛋白定量。每孔上10~20 μg蛋白,进行垂直电泳(浓缩胶电压50 V、1 h,分离胶电压100 V、1.5 h),再以平行电泳(电流200 mA、3.5 h左右)的方式将凝胶中的细胞蛋白转移到PVDF膜上。转移有蛋白的PVDF膜在5%脱脂牛奶中4 ℃封闭过夜。PVDF膜分别用一抗(β-actin:1 ∶4 000、StAR:1 ∶11 000、P450SCC:1 ∶1 000、P45017α:1 ∶1 000、17β-HSD:1 ∶1 000、3β-HSD:1 ∶1 000) 室温孵2~3 h。洗涤后的PVDF膜用辣根过氧化物酶标记的山羊抗小鼠IgG(β-actin: 1 ∶40 000)、山羊抗兔IgG(P45017α: 1 ∶60 000、17β-HSD: 1 ∶80 000 和StAR: 1 ∶1 100 000)以及兔抗山羊IgG(P450SCC: 1 ∶60 000及 3β-HSD: 1 ∶120 000)于摇床上室温孵育1~2 h。采用Tanon化学发光显影仪检测蛋白的表达水平,采用Tanon全自动化学发光图像分析系统分析目的蛋白的灰度值与内参蛋白的灰度值,目的蛋白的相对表达量的计算公式为:目的蛋白的相对表达量=目的蛋白的灰度值/内参蛋白的灰度值。

2 结果
2.1镉抑制TM3细胞睾酮分泌为研究镉对TM3细胞睾酮分泌的影响,TM3细胞被给予20 μmol/L CdCl2,分别在加入CdCl24 h和8 h后收集细胞上清液,采用ELISA法测定细胞上清液中睾酮含量。实验结果显示:镉处理4 h组和8 h组细胞上清液中睾酮含量分别为(383.3±9.2)、(367.4±6.1) pg/ml,明显低于对照组睾酮含量(463.9±13.4) pg/ml (F=87.96,P<0.01)。 见图1。
2.2镉对TM3细胞睾酮合成关键酶mRNA表达的影响为探讨镉处理对TM3细胞睾酮合成关键酶mRNA表达的影响,TM3细胞被给予20 μmol/L CdCl2,分别在加入CdCl24 h和8 h后收集细胞,采用RT-PCR法检测睾酮合成关键酶mRNA表达水平。结果显示,镉处理组StAR、P450SCC与17β-HSD mRNA的表达水平均呈下降趋势(图2),镉处理4 h组和8 h组StAR、P450SCC与17β-HSD mRNA的表达水平与对照组比较,差异均有统计学意义(F=18.86、50.34、6.20,P<0.01、P<0.01、P<0.05)。
2.3镉对TM3细胞睾酮合成关键酶蛋白表达的影响为探讨镉对TM3细胞睾酮合成通路关键酶蛋白表达的影响,TM3细胞被给予20 μmol/L CdCl2,分别在加入CdCl24 h和8 h后收集细胞,采用Western blot法检测睾酮合成关键酶蛋白的表达水平。结果显示:与对照组相比,镉明显抑制TM3细胞StAR、P450SCC与P45017α的蛋白表达,并且随镉处理时间的延长,抑制作用更加明显(F=180.86,P<0.01;F=22.34,P<0.01;F=46.87,P<0.01) (图3A、B、D)。此外,镉处理4 h组和8 h组TM3细胞3β-HSD与17β-HSD的蛋白表达水平也明显降低(F=36.91、92.34,P<0.01) (图 3C、E)。
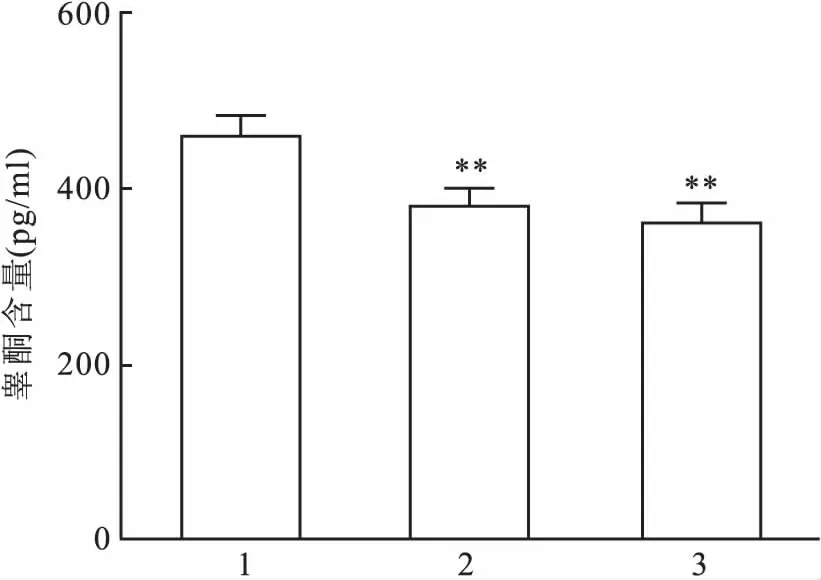
图1 CdCl2对TM3细胞睾酮分泌的影响
1:对照组;2:镉处理4 h组;3:镉处理8 h组;与对照组比较:**P<0.01
3 讨论
睾酮属于类固醇激素,主要由睾丸间质细胞合成和分泌[8],是雄激素的一种。睾酮对雄性生殖系统的生长发育起至关重要的作用,如刺激雄性外生殖器官及内生殖器官发育成熟,促进精子的生成和发育,维持雄性第二性征等。本课题组体内研究[6]结果表明,镉能够损害睾丸发育,减少精子发生,其可能与镉抑制睾酮的合成和分泌有关。本研究结果表明,镉处理组TM3细胞睾酮含量明显低于对照组,提示镉能抑制小鼠睾丸间质细胞合成和分泌睾酮。

图2 CdCl2对TM3细胞睾酮合成关键酶mRNA表达的影响 A:StAR;B:P450SCC;C:17β-HSD;1:对照组;2:镉处理4 h组;3:镉处理8 h组;与对照组比较:*P<0.05,**P<0.01
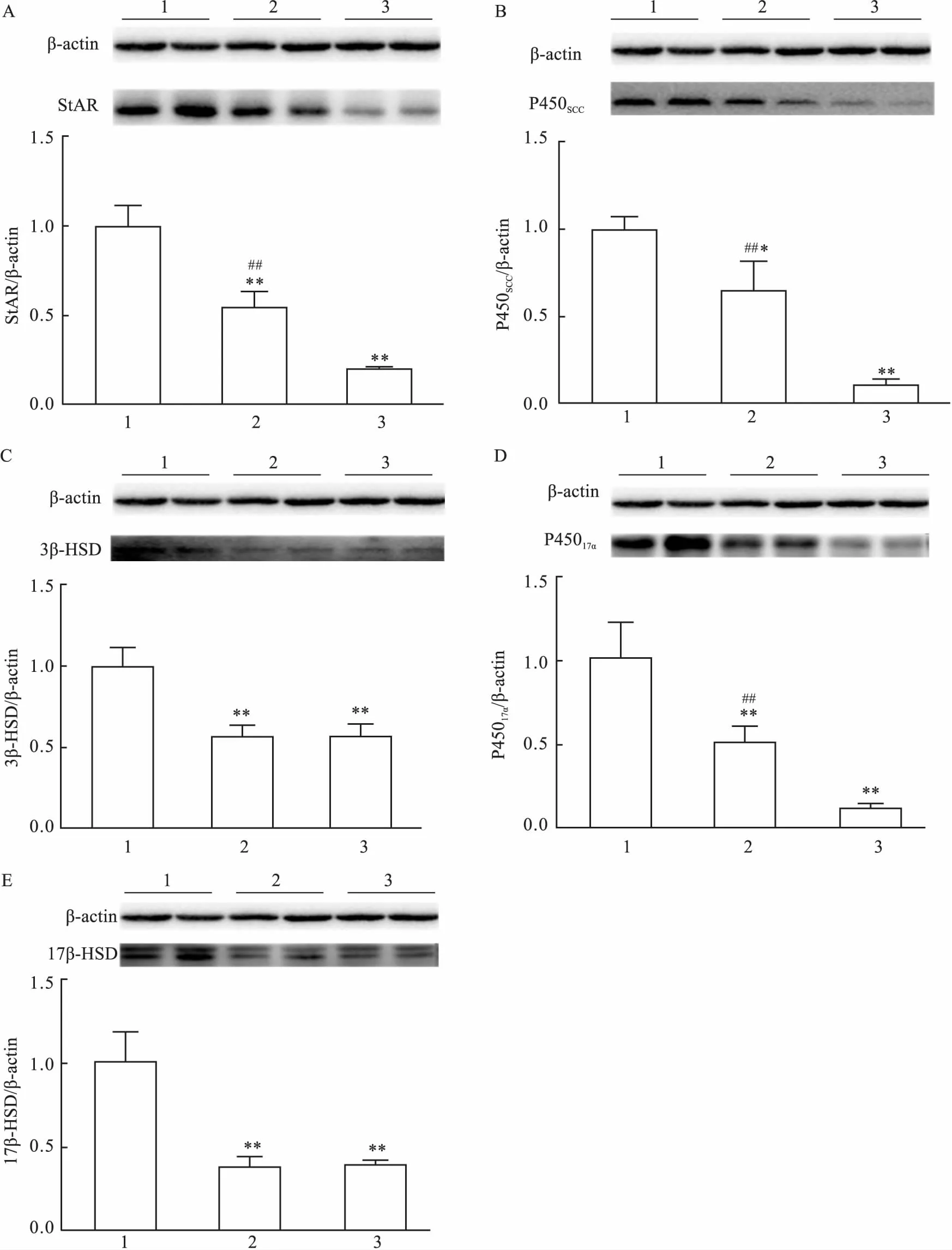

A:StAR;B:P450SCC;C:3β-HSD;D:P45017α;E:17β-HSD;1:对照组;2:镉处理4 h组;3:镉处理8 h组;与对照组比较:*P<0.05,**P<0.01;与镉处理8 h组比较:##P<0.01
睾丸间质细胞在合成睾酮时要经过一系列酶促反应:首先胆固醇通过位于睾丸间质细胞线粒体外膜上的线粒体外膜上StAR转运至线粒体内膜;在线粒体内膜细胞色素P450scc的催化下,胆固醇被转化为孕烯醇酮;后者被转运至滑面内质网,一方面在3β-HSD作用下被转化为孕酮,另一方面其被P45017α催化为17-羟孕酮和雄烯二酮;最后雄烯二酮在17β-HSD作用下生成睾酮。外源化学物影响上述任一环节均可能对睾酮合成和分泌产生损害作用。本实验研究了镉处理对TM3细胞睾酮合成关键酶的影响。实验结果表明,镉处理组TM3细胞的StAR、P450scc、3β-HSD、P45017α和17β-HSD蛋白的表达水平与对照组比降低,且镉处理组TM3细胞的StAR、P450scc和17β-HSD mRNA的表达水平与对照组比也降低。
综上所述,镉处理可能抑制了TM3细胞睾酮合成通路中关键酶mRNA和蛋白的合成,直接造成睾酮的分泌降低,睾酮分泌的减少又会影响到男(雄)性的生育功能。然而目前对镉通过何种分子机制下调睾酮合成酶mRNA和蛋白的表达进而抑制睾酮合成仍不清楚,尚需要开展进一步的研究。
[1] Xu D X, Shen H M, Zhu Q X, et al. The associations among semen quality, oxidative DNA damage in human spermatozoa and concentrations of cadmium, lead and selenium in seminal plasma [J]. Mutat Res, 2003, 534(1-2): 155-63.
[2] Rani A, Kumar A, Lal A, et al. Cellular mechanisms of cadmium-induced toxicity: a review [J]. Int J Environ Health Res, 2014, 24(4): 378-99.
[3] Pant N, Kumar G, Upadhyay A D, et al. Correlation between lead and cadmium concentration and semen quality [J]. Andrologia, 2015, 47(8): 887-91.
[4] Siu E R, Mruk D D, Porto C S, et al. Cadmium-induced testicular injury [J]. Toxicol Appl Pharmacol, 2009, 238(3): 240-9.
[5] Monsefi M, Alaee S, Moradshahi A, et al. Cadmium-induced infertility in male mice [J]. Environ Toxicol, 2010, 25(1): 94-102.
[6] Ji Y L, Wang H, Zhao X F, et al. Crosstalk between endoplasmic reticulum stress and mitochondrial pathway mediates cadmium-induced germ cell apoptosis in testes [J]. Toxicol Sci, 2011, 124(2): 446-59.
[7] 冷银芝, 李应配, 罗时猛, 等. 双酚A对小鼠3T3-L1前脂细胞分化的影响 [J]. 安徽医科大学学报, 2016, 51(9): 1281-5.
[8] Chen H, Ge R S, Zirkin B R. Leydig cells: From sterm cells to aging [J]. Mol Cell Endocrinol, 2009, 306(1-2): 9-16.

