一种用于检测硫化氢和生物硫醇化学传感器的合成与应用
夏玉婷,江 波,胡庆红,袁泽利
(遵义医学院 药学院无机化学教研室,贵州 遵义 563099)
H2S和高半胱氨酸(Hcy)、半胱氨酸(Cys)及谷胱甘肽(GSH)等生物硫醇小分子在人的生理活动中起着重要作用。如硫化氢(H2S)是继一氧化氮(NO)和一氧化碳(CO)被发现后的第三种气体信号分子,在许多生理过程中扮演着重要角色。一些疾病如肝硬化、肺动脉高压和阿尔茨海默病等均与细胞内H2S的失衡有关[1-2]。而高/半胱氨酸是维持细胞和组织生长,以及生物氧化还原平衡的重要物质[3-5],其体内含量异常与帕金森综合症、各种心血管疾病、肝损伤、癌症以及阿尔兹海默病等多种疾病密切相关[3-5]。谷胱甘肽在维持细胞还原环境的过程中起着氧化还原调节器的角色,具有维持细胞内的还原环境和保护细胞器免受活性氧的损坏作用[6-7]。因此,对H2S和生物硫醇进行检测具有十分重要的作用。目前应用毛细管电泳法[6-7]、质谱法[8]、电化学法[9]等方法对这些生物硫醇小分子进行含量测定。与上述方法相比,近年发展起来的化学传感器为主体的分析法具有前处理简便、灵敏度高、信号可调、无损、实时等优点,成为对小分子检测的研究热点[10-11]。与普通荧光探针相比,比率荧光探针具有自参比特征,可有效避免来自环境的干扰,提高检测的准确度。为此,研究者们竞相设计开发新的化学传感器分子应用于生物硫醇的比率检测,如刘长辉等[12]最近制备了一个近红外的花箐染料分子并成功实现了对高/半胱氨酸的比率检测,并将其应用于血清中高/半胱氨酸的测定取得了良好的效果。但该方法仅能实现对高/半胱氨酸的双功能检测。为在同一传感器分子能够实现对3个或以上的生物硫醇小分子的定性定量检测,本文基于硝基苯呋喃基团(NBD)极易与硫离子和生物硫醇的亲核并反应特性,以1,8-萘二甲酸酐为母核,设计合成了一个新的化学传感器L(合成路线见图1),考察其对生物硫醇小分子的选择性识别性能和识别机理,并将其应用于人体血清样品的测定。
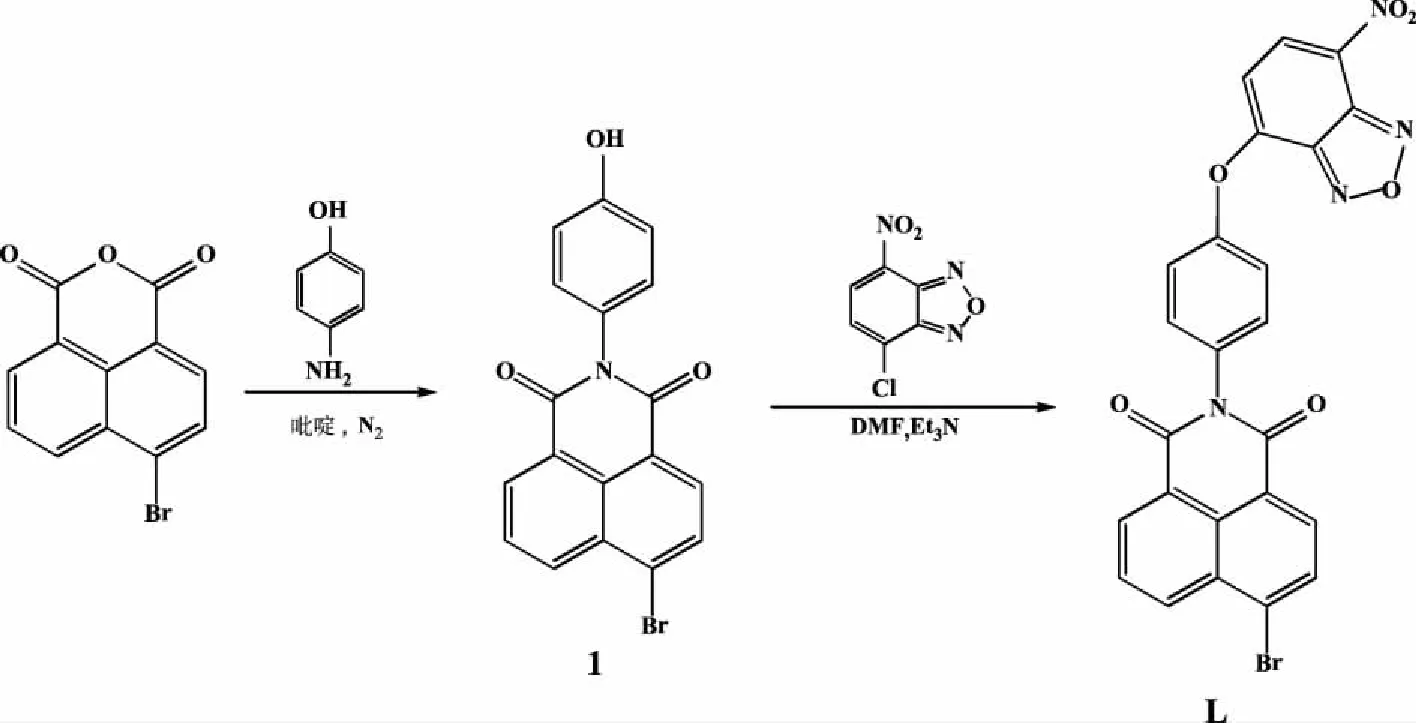
图1 传感器L的合成路线
1 材料与方法
1.1 仪器与试剂 Agilent 400 MR DD2核磁共振仪(美国安捷伦公司); Varian 1000 FT-IR红外光谱仪(美国安捷伦公司);Varian Carry荧光分光光度计(美国安捷伦公司);Micromass LCT PremierXE高分辨质谱仪(美国沃特世公司); TU-1901双光束紫外可见分光光度计(北京普析通用仪器有限责任公司);ABSCIEX QTRAP4000 LC-MS/MS质谱仪(ABSCIEX公司); P230型高效液相色谱仪(大连伊利特分析仪器有限公司)。
4-溴1,8-萘二甲酸酐(分析纯)、对苯二酚(分析纯)、4-氯-7-硝基苯并呋喃(分析纯)、Na2S(分析纯)、半胱氨酸(分析纯)、高半胱氨酸(分析纯)及还原谷胱甘肽(分析纯)均购自安奈吉或百灵威试剂公司,其他试剂及合成所需溶剂均为分析纯,如未特殊说明使用前均未进行纯化处理。实验用水为超纯水(电阻率:18.3 MΩ·cm)。血清样品来自于遵义医学院附属医院检验科。
1.2 目标传感器L的合成 中间体1的合成:将2.76 g(10 mmol)的4-溴-1,8-萘二甲酸酐溶于30 mL吡啶,在氮气下缓慢滴加含2.18 g(20 mmol)间氨基酚的20 mL吡啶溶液,于30 min内滴完,继续在60 ℃下搅拌反应20 min。另称取1.22 g(10 mmol)醋酸锌溶解于20 mL吡啶后加入上述反应液中,60 ℃下搅拌反应24 h,冷却后将其倾倒入300 mL的水中,过滤,用水充分洗涤滤饼,真空干燥得咖啡色固体,产率79.2%。1H NMR(DMSO-d6,400 MHz),δ:9.68 (s,1H,OH),8.58(s,1H,Ar-H),8.32~8.34 (d,1H,J=6.6 Hz,Ar-H),8.24~8.25(d,1H,J=6.6 Hz,Ar-H),8.02 (s,1H,Ar-H),7.14 ~7.16 (d,2H,J=7.4 Hz,Ar-H),6.87~6.89(d,2H,J=7.4 Hz,Ar-H);13C NMR (DMSO-d6,100MHz)δ:163.38,163.33,157.20,131.59,130.97,129.85,128.86,126.61,122.71,115.40; MS,C18H10BrNO3的理论计算值:368.2,实验值:368.3。
L的合成:将0.36 g(10 mmol)的4-氯-7-硝基苯并呋喃和0.19 g(10 mmol)的中间体1溶解于15 mL无水N,N-二甲基甲酰胺(DMF)中搅拌溶解,再加入250 μL 三乙胺,室温下搅拌反应3 h,将反应液倒入50 mL 冰水中,有固体析出,用乙酸乙酯萃取,饱和 NaCl溶液洗涤,再经无水硫酸钠干燥后,减压除去溶剂,所得固体用水、甲醇洗涤数次,得棕色粉末状固体,产率37.5%,m.p.:314~316℃.1H NMR (DMSO-d6,400 MHz)δ:8.74~8.76 (d,2H,J=8.4 Hz,Ar-H),8.61~8.65(t,2H,J=7.2Hz,Ar-H),8.37~8.39(d,1H,J=7.9 Hz,Ar-H),8.28-8.30(d, 1H,J=7.9 Hz,Ar-H),8.04-8.08 (m,1H,Ar-H),7.58~7.65 (dd,4H,J=18.6,8.9 Hz,Ar-H).13C NMR (DMSO-d6,100 MHz)δ:163.35,13.29,157.20,149.69,131.56,129.04,128.69,123.91,122.66,115.39.HR-MS(ESI-MS),C24H11BrN4O6+H+的计算值:530.994 0,实验值:530.994 8; FT-IR(4 000~400 cm-1,KBr):3 468,3 416,3 080,2 919,1 672,1 637,1 618,1 572,1 538,1 487,1 401,1 269,1 195,1 098,997,858,747。

1.4 紫外-可见吸收光谱和荧光光谱的测定 本文依据文献惯例以S2-作为H2S识别性能考察[13]。将传感器L及其分别与1.3中所述及的阴离子或氨基酸配置成所需浓度的溶液10 mL。测其紫外-可见光谱和荧光光谱(狭缝宽度均为5 nm,电压为中等)。
1.5 氢核磁共振滴定及质谱测试 分别称取0.53 g传感器L置于5 支核磁管中,分别用少量DMSO-d6:D2O(v∶v=9∶1)溶解后,再分别加入0.2倍、0.5 倍、1.0 倍、2.0倍的硫化钠、半胱氨酸、高半胱氨酸和谷胱甘肽,用DMSO-d6:D2O (v∶v=9∶1)补足核磁管内溶液均为600 μL。摇匀后分别于室温下立即测定其核磁共振氢谱图。将上述测试物的最后一支核磁管于液质联用上以乙腈为流动相测其质谱。
1.6 HPLC测试 分别称取5 mg传感器L置于3支5 mL容量瓶中,分别用色谱纯DMSO:甲醇(v:v=11)溶解后定容至5 mL。再分别取1.5 mL传感器L溶液置于3支5 mL容量瓶中,再分别加入1.0倍的硫化钠、半胱氨酸、高半胱氨酸和谷胱甘肽,用色谱纯甲醇补足容量瓶内溶液均为5 mL。摇匀后分别于室温下静置0.5 h时后,用甲醇:水(v∶v=9∶1)为流动相测其高效液相色谱。
1.7 血清样品中S2-和生物硫醇的测定 将血清样品用Tris-HCl缓冲溶液(20 mmol/L,pH 7.4)稀释1倍,经蛋白沉淀后置于5 ℃备用。测定时取上层清液500 μL,加入1.0 μmol/L的传感器L储备液,混匀后再加入一定量的硫化钠、半胱氨酸、高半胱氨酸和谷胱甘肽储备液。对H2S和GSH的测定以Tris-HCl缓冲溶液为参比分别在576 nm和426 nm处测其吸光度。高/半胱氨酸的测定以481 nm激发,测试543 nm处荧光强度,激发和发射狭缝均为5 nm,电压为中等并保持不变。
2 结果
2.1 传感器L识别性能
2.1.1 传感器L选择性 传感器L分别与1.3中述及的阴离子和氨基酸混合后的紫外-可见光谱和荧光光谱示于图2。由图2A可以看出,在受试范围内的阴离子中仅有S2-与传感器混合后紫外-可见光谱在576 nm处产生了一个新的且强度很大的吸收峰,这说明L与S2-发生了某种作用。同时,L与S2-混合后的溶液颜色也迅即由无色变为紫红色,而其余受试范围内的阴离子未见变化(见图3)。说明L对S2-具有高的特异选择性,且能实现裸眼快速定性对S2-的比色检测。上述体系在荧光光谱测试却未有荧光发射光谱产生。由图2B可以看出,在受试范围内的18种氨基酸与传感器L混合物中,高半胱氨酸和半胱氨酸在481 nm处引起了显著的吸光度增强,而L与谷胱甘肽作用后在426 nm处产生了显著的吸光度增强。有趣的是,半胱氨酸与L混合物的溶液颜色由无色变为橙黄色,且该现象与半胱氨酸的浓度相关,随着Cys浓度的逐渐增加,溶液颜色由无色变为酒红色,最后达到2.0倍于L后变为橙色(见图3),在相同条件下,Hcy和GSH与L混合后溶液颜色无变化(见图3)。表明L可以用于半胱氨酸的裸眼快速比色检测。因此,传感器L可用于H2S、GSH和Hcy/Cys具有高的选择性和特异性检测,尤其能对H2S和Cys进行裸眼比色定性检测。
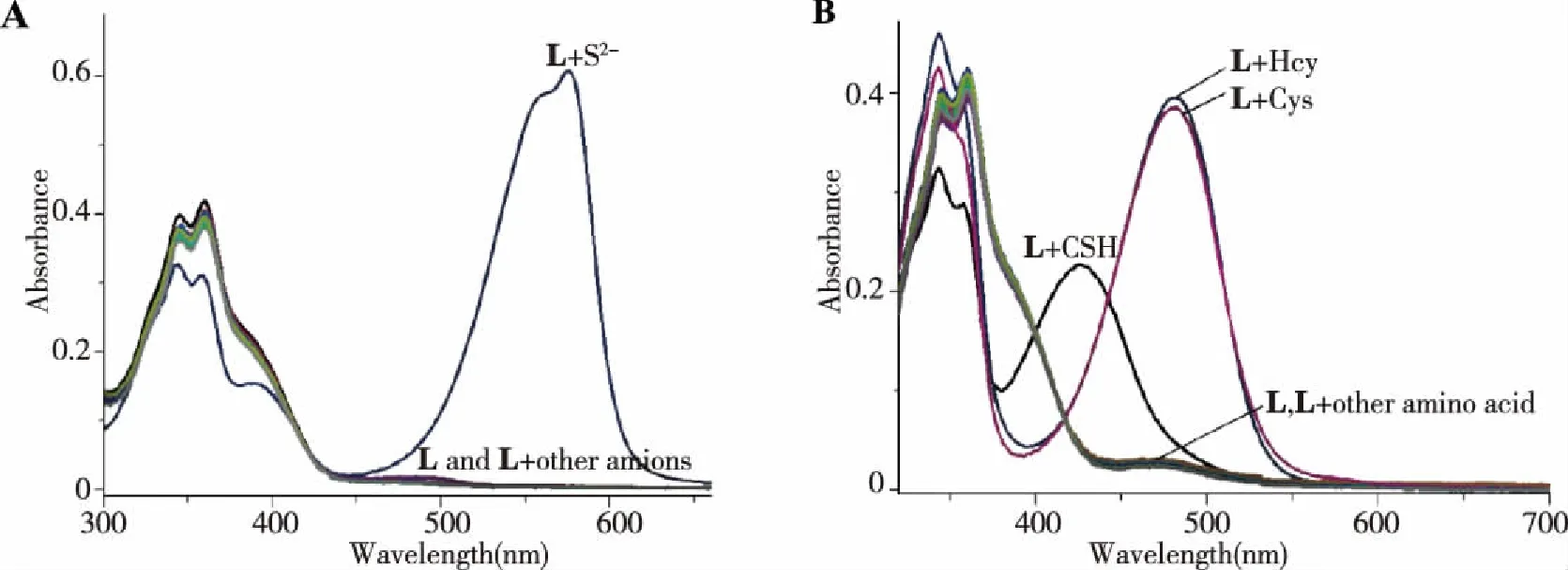
图2 传感器L与不同阴离子(A)和不同氨基酸(B)作用前后的紫外-可见光谱图

从左往右:L,L+S2-,L+Hcy,L+Cys和L+GSH。图3 传感器L及其分别与S2-、Hcy、Cys和GSH作用前后的颜色变化
在上述条件下,进一步测试了传感器L与18种阴离子和18种氨基酸作用前后的荧光光谱(见图4)。结果表明:传感器L仅与Hcy、Cys及GSH作用后在543 nm产生了新的荧光发射峰,荧光强度分别增加了148、58和9倍,而剩余氨基酸及阴离子均未见新的荧光发射峰产生。这表明3种生物硫醇与L发生的反应顺序为Hcy>Cys>GSH。此外,从图5可见,在365 nm紫外灯照射下,L与Hcy作用后的溶液显示出非常显著的黄色荧光。因此,可将传感器L对Hcy具有荧光识别的高选择性。
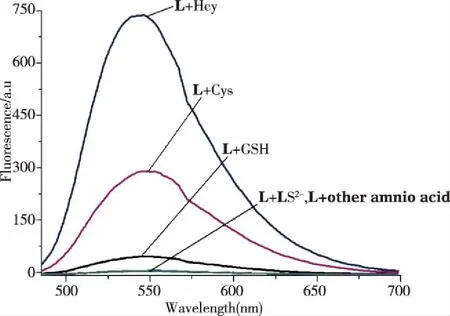
图4 传感器L(5 μM)与S2-及不同氨基酸(每个浓度均为50 μM)作用前后的荧光光谱图

从左往右:L,L+S2-,L+Hcy,L+Cys和L+GSH。图5 传感器L(5 μM)及其分别与S2-、Hcy、Cys和GSH(每个浓度均为50 μM)作用前后溶液在365 nm紫外灯照射下的颜色变化
以上实验现象表明,传感器L可以作为紫外-可见光谱响应识别S2-、Cys和GSH,而荧光光谱可作为对Hcy的特异响应识别,且对S2-和Cys可以实现裸眼的紫红色和橙黄色定性检测,对Hcy可以实现紫外灯照射下的绿色定性检测。
2.1.2 传感器L识别H2S、Hcy、Cys和GSH的抗干扰性能 为验证L对其余阴离子和氨基酸的抗干扰能力,将L分别与待测的H2S、Hcy、Cys和GSH混合后,再分别加入干扰离子或氨基酸进行竞争性实验,结果示于图6中。从图6可以看出,研究范围内的干扰物除Hcy和Cys会对GSH的识别以及Cys会对Hcy的识别带来一定干扰外,对测试的H2S、Hcy、Cys和GSH均无显著干扰,说明L对H2S、Hcy、Cys和GSH的测定具有较强的抗干扰能力。
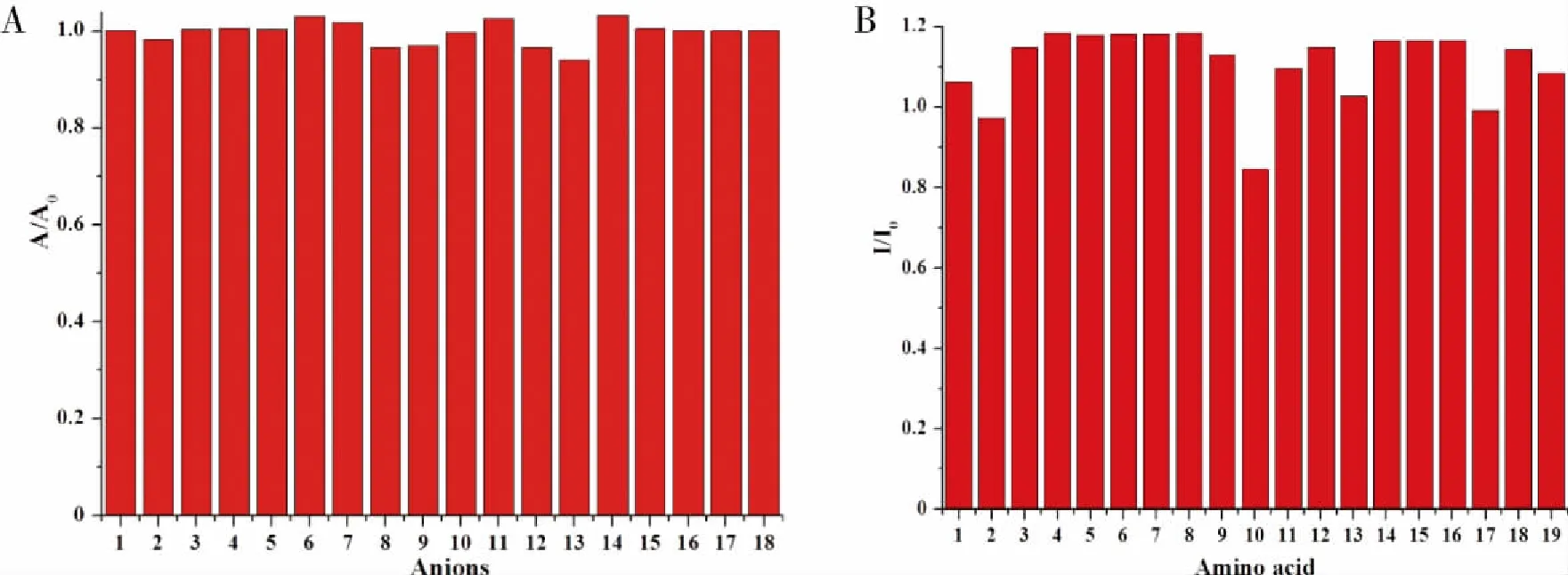
A:在Tris-HCl溶液中干扰离子(2.0×10-5 mol/L)和S2-(2.0×10-5 mol/L)共存时L(1.0×10-5 mol/L)在576 nm处的吸光度值变化; 1:L+S2-; 2:L+S2- +F; 3:L+S2- +Cl-; 4:L+S2- +Br-; 5:L+S2- +I-; 6:; 7:; 8:; 9:; 10:; 11:; 12:; 13:; 14:; 15:L+S2- +SCN-; 16:; 17:L+S2- +CN-; 18:L+S2- +AcO-。B:在Tris-HCl溶液中干扰氨基酸(2.0×10-5 mol/L)和Hcy(2.0×10-5 mol/L)共存时L(1.0×10-5 mol/L)在552 nm处的荧光强度的变化。1:L+Hcy; 2:L+Hcy +GSH; 3:L+Hcy +Tyr; 4:L+Hcy +Glu; 5:L+Hcy +Arg; 6:L+Hcy +Gly; 7:L+Hcy +Trp; 8:L+Hcy +Asn; 9:L+Hcy +Val; 10:L+Hcy +Cys; 11:L+Hcy +Met; 12:L+Hcy +Ser; 13:L+Hcy +Phe; 14:L+Hcy +Phg; 15:L+Hcy +His; 16:L+Hcy +Ala; 17:L+Hcy +Mts;18:L+Hcy +Leu; 19:L+Hcy +HCy。 图6 传感器L识别H2S、Hcy、Cys和GSH的抗干扰性能
2.1.3 传感器L识别H2S和生物硫醇的机理
2.1.3.1 核磁共振氢谱滴定 为阐明L识别S2-和生物硫醇小分子的机理,在一定浓度下L中滴加S2-或生物硫醇小分子后测核磁共振氢谱实验考察,实验结果示于图7中。由图可以看出,随着待识别的S2-或生物硫醇小分子浓度的逐渐增加,在8.74~8.76 ppm的芳环质子化学位移逐渐消失,而在7.10~7.12 ppm和6.95 ppm出现了一组新的质子化学位移,结合文献报道,该峰为硝基苯呋咱基团(NBD)与硫离子或生物硫醇发生亲核反应后的芳环质子化学位移[14-15],其余芳环质子均向高场发生微小移动。说明L识别硫离子或生物硫醇因发生亲核反应导致其分子结构中的芳环质子化学环境发生改变所致。
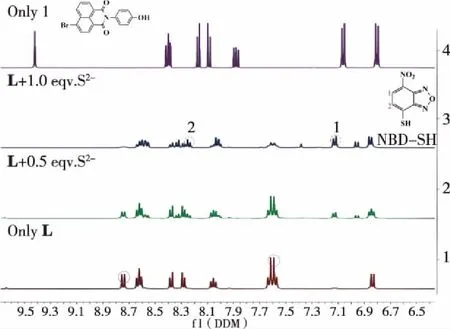
图7 中间体1(顶端)、传感器L(底端)及L与不同浓度S2-反应后(中间)的部分1H NMR谱图
2.1.3.2 质谱和HPLC实验 为进一步证实L识别硫离子和生物硫醇因发生亲核反应导致原来结构中的醚键断裂,将上述含传感器L分别与S2-、Hcy、Cys和GSH的最后一管核磁溶液进行质谱测试。结果发现了m/z= 368.3 (计算值368.2)中间体1的碎片峰。同时,L与半胱氨酸混合后发现了m/z=283.2(计算值283.2)的NBD-NH-CH(COOH)-CH2S的碎片峰,而L与高半胱氨酸混合后发现了m/z= 283.2 (计算值283.2)的NBD-NH-CH(COO)-(CH2)2-S的碎片峰。进一步证实了L识别S2-、Hcy、Cys和GSH是由于发生亲核反应导致原来结构中的醚键断裂进行的反应型识别机理。
2.1.3.3 HPLC实验 以中间体为对照品,还测试了传感器L分别与S2-、Hcy、Cys和GSH混合后溶液的HPLC实验。结果表明,中间体出峰时间在t=3.32 min,而当L分别与S2-、Hcy、Cys和GSH混合后也分别在t=3.31 min出现了中间体的峰,这更加证实了L识别硫离子、Hcy和Cys是由于发生亲核反应导致原来结构中的醚键断裂生成了中间体和NBD与硫醇物质。
基于上述实验结果和文献,推测L识别S2-、Hcy、Cys和GSH是因发生亲核反应导致原来结构中的醚键断裂的化学反应型传感器,且L和Hcy和Cys的硫醇反应后发生重排所致[15]。推测的识别机理如图8所示。
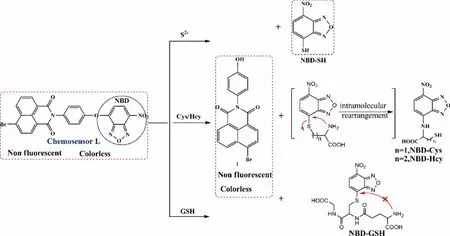
图8 传感器L对S2-和Hcy及Cys的识别机理
2.2 传感器L测定H2S、Hcy、Cys和GSH
2.2.1 负载L的试纸比色定性定量测定H2S和Cys 负载传感器的裸眼比率检测是化学传感器实用性的重要性能,具有方便携带、操作简便等优势。鉴于L识别H2S和Cys表现出的裸眼颜色变化特性,将滤纸侵泡在含L(20 μM)的DMSO溶液中,取出晾干,再喷洒40 μM的1.3中所述的18种阴离子或18种氨基酸于滤纸上,得到图9所示的裸眼快速定性检测H2S和Cys结果,并能显著区分受试范围内的其余物种,说明L可作为负载于试纸的快速裸眼检测H2S和Cys工具。
为进一步验证负载L的试纸能够对H2S和Cys的裸眼比率定量检测,将不同浓度的H2S和Cys喷洒于负载L的试纸上,得到如图10所示结果,能够通过试纸颜色逐渐加深的裸眼颜色变化检测S2-和Cys浓度,这说明L还可作为负载于试纸的快速裸眼比率定量检测H2S和Cys工具。
此外,为了证实传感器L能识别H2S气体,往含20 μM传感器L的溶液中通入H2S气体(由Na2S和浓硫酸反应产生),随着通入H2S气体的增加,溶液颜色也由无色变为紫红色,表明L确实能够作为H2S的高选择性比色传感器。
2.2.2 血清样品中S2-、Hcy、Cys和GSH的测定 为检验传感器L对于临床血清样本中生物硫醇小分子的实用性,对遵义医学院附属医学院检验科血清样本进行了生物硫醇小分子加标样品检测,检测结果列于表1中。由表1可以看出,传感器L可应用于临床血清样本中生物硫醇小分子的微量测定,对生物硫醇小分子的加标回收率为95.3%~102.5%,RSD小于8%,获得满意的测定结果。因此,传感器L可应用于实际样品中H2S、Hcy、Cys和GSH生物硫醇小分子含量的测定。

A图中,1:L; 2:L+F-; 3:L+Cl-; 4:L+Br-; 5:L+I-; 6:L+S2-; 7:; 8:; 9:; 10:; 11:; 12:; 13:; 14:; 15:; 16:L+SCN-; 17:; 18:L+CN-;B图中,1:L; 2:L+Tyr; 3:L+Glu; 4:L+Arg; 5:L+Gly; 6:L+Trp; 7:L+Asn; 8:L+Val; 9:L+His.10:L+Mts; 11:L+Ser; 12:L+Phe; 13:L+Phg; 14:L+Ala; 15:L+cys; 16:L+Hcy; 17:L+GSH; 18:L+Leu; 19:L+Met。图9 负载L的试纸用于定性探测S2-(A)和Cys(B)的结果

A图中,1、2、3、4、5、6和7分别表示[S2-]= 0.0 μM、6.0 μM、12.0 μM、18.0 μM、24.0 μM、30.0 μM 和40.0 μM;B图中,1、2、3、4、5、6和7分别表示[Cys]= 0.0 μM、10.0 μM、30.0 μM、40.0 μM、50.0 μM、60.0 μM和80.0 μM。图10 负载L的试纸用于定量探测S2-(A)和Cys(B)的结果
表1传感器L测定血清样品中S2-、Hcy、Cys和GSH
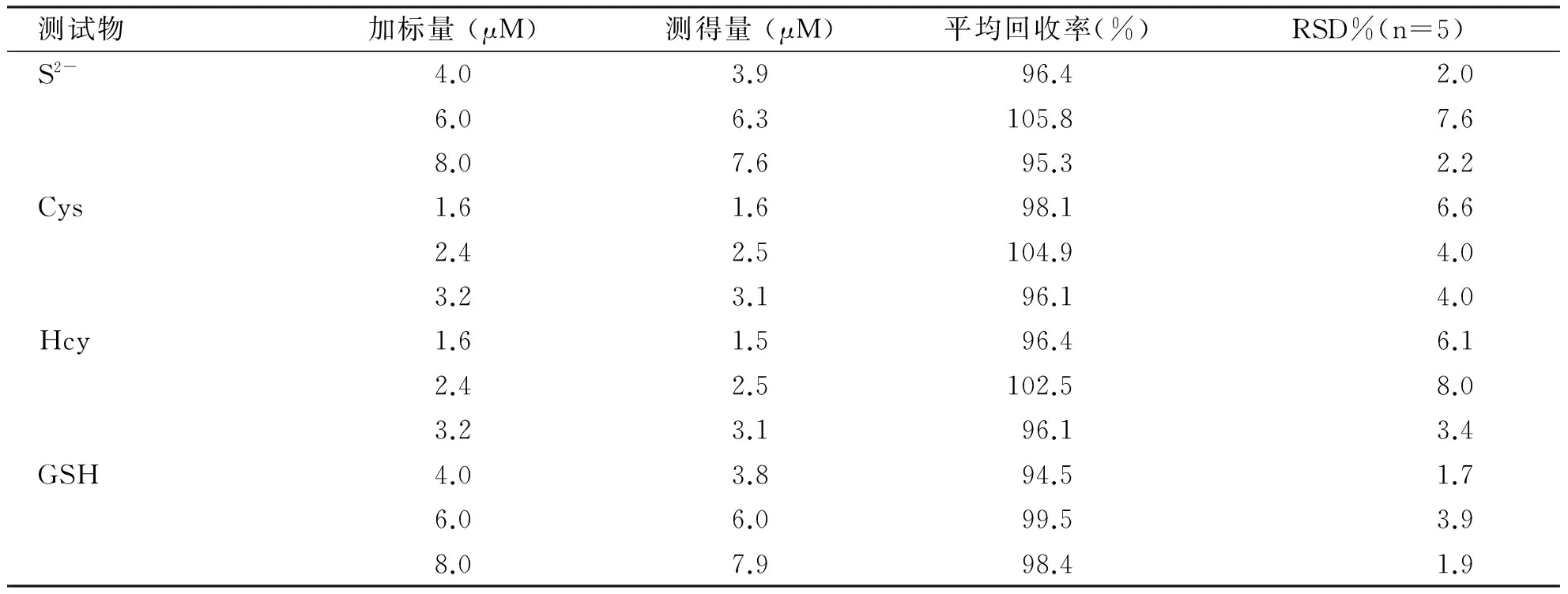
测试物加标量(μM)测得量(μM)平均回收率(%)RSD%(n=5)S2-4.03.996.42.06.06.3105.87.68.07.695.32.2Cys1.61.698.16.62.42.5104.94.03.23.196.14.0Hcy1.61.596.46.12.42.5102.58.03.23.196.13.4GSH4.03.894.51.76.06.099.53.98.07.998.41.9
3 讨论
以4-溴-1,8-萘二甲酸酐为原料,经与对羟基苯胺缩合,进一步以三乙胺作为缚酸剂下将其与4-氯-7-硝基苯并呋喃通过威廉姆森成醚反应制备得到目标传感器L。探针L为褐色粉末,易溶于二甲基亚砜(DMSO)和N,N-二甲基甲酰胺(DMF)溶剂中,微溶于氯仿、乙醇和甲醇中。L的结构和组成经1H NMR、13C NMR、HR-MS(ESI-MS)以及FT-IR证实为预期目标分子结构。
通过紫外-可见光谱和荧光光谱研究了新合成的传感器L检测H2S和生物硫醇的性能。表明本研究所构建的新化学传感器L可用作紫外-可见吸收光谱法分别在426 nm、481和576测定GSH、Cys和H2S,尤其是Cys和H2S可实现比色快速定性定量检测。同时,可在543 nm处通过荧光分光光度法定性定量测定Hcy。分别用上述探寻的方法应用于我校附属医院检验科提供的血清加标回收实验也取得了满意的测定结果。
依据硝基苯呋喃形成的醚键易于与H2S及Hcy和Cys硫醇发生亲核反应而生成了新的硝基苯呋喃硫醇物质,从而产生吸收光谱和荧光比色信号的机理,本研究制备了一个比色吸收光谱测定H2S、Cys和GSH、荧光检测Hcy的检测方法。该方法操作简单、选择性高、抗干扰能力强,能应用于血清样品H2S、Hcy、Cys和GSH含量的测定。尤其是能通过比色定性定量测定H2S和Cys的显著优势。 因此,L是一种高选择性的反应型优异传感器,可实现对实际样品中H2S、Hcy、Cys和GSH的单分子多功能准确检测。
[1] 张鹏,韩潇碉,于法标,等.用于检测多硫化氢和亚硝酰氢的小分子荧光探针[J].影像科学与光化学,2016,34(5):402-426.
[2] Gupta N,Reja S I,Bhalla V,et al.Fluorescent probes for hydrogen polysulfides (H2Sn,n> 1):from design rationale to applications[J].Org Biomol Chem, 2017,15:6692-6701.
[3] 岳永康,霍方俊,阴彩霞.硫醇亲核反应及其荧光识别研究[J].中国科学:化学,2016,47(2):249-257.
[4] Sanskriti I,Upadhyay K K.Cysteine,homocysteine and glutathione guided hierarchical self-assemblies of spherical silver nanoparticles paving the way for their naked eye discrimination in human serum[J].New J Chem,2017,41(11):4316-4321.
[5] Zhang X,Yan Y C,Hang Y D,et al.A phenazine-barbituric acid based colorimetric and ratiometric near-infrared fluorescent probe for sensitively differentiating biothiols and its application in TiO2sensor devices[J].Chem Commun,2017,53(42):5760-5763.
[6] 郭靖,刘庆文,杜建时,等.基于萘酰亚胺的生物硫醇探针的合成及对含硫醇氨基酸的检测[J].分析化学,2017,45(9):1330-1338.
[7] 杨润洁,唐尧,朱维平.用于检测细胞内谷胱甘肽的比率型荧光探针[J].高等学校化学学报,2016,37(4):643-647.
[8] Burford N,Eelman M D,Mahony D E,et al.Definitive identification of cysteine and glutathione complexes of bismuth by mass spectrometry:assessing the biochemical fate of bismuth pharmaceutical agents[J].Chem Commun,2002,9(1):146-147.
[9] Lee P T,Lowinsohn D,Compton R G.Simultaneous detection of homocysteine and cysteine in the presence of ascorbic acid and glutathione using a nanocarbon modified electrode[J].Electroanalysis,2014,26(7):1488-1496.
[10]何顺莉,余光勤,袁泽利.基于脱单芳氨基反应的一氧化氮荧光探针的合成及其在活细胞中成像的应用[J].分析试验室,2016,35(12):1370-1374.
[11]周卿,周旭美,杨杰,等.高效液相色谱与共振散射光联用方法测定家兔血浆中阿米卡星的含量[J].遵义医学院学报,2012,35(6):528-531.
[12]刘长辉,李银辉,齐风佩,等.近红外双发射荧光探针比率检测高/半胱氨酸[J].中国科学:化学,2017,47(8):1015-1021.
[13]Li K B,Chen F Z,Yin Q H,et al.A colorimetric and near-infrared fluorescent probe for hydrogenpolysulfides and its application in living cells[J].Sensors & Actuators B Chemical,2018,254:222-226.
[14]Montoya L A,Pearce T F,Hansen R J,et al.Development of selective colorimetric probes for hydrogen sulfide based on nucleophilic aromatic substitution[J].Journal of Organic Chemistry,2013,78(13),6550 -6557.
[15]Bae J,Choi J,Park T J,et al.Reaction-based colorimetric and fluorogenic signaling of hydrogen sulfide using a 7-nitro-2,1,3-benzoxadiazole-coumarin conjugate[J].Tetrahedron Letters,2014,55(6):1171-1174.

