农业废弃物堆肥化进程与纤维素类物质降解研究
周月明,雷阳明,夏家帅,任春蓉
(1.中国科学院 重庆绿色智能技术研究院,重庆 400714;2.重庆大学 城市建设与环境工程学院,重庆 400044;3.重庆工商大学 环境与资源学院,重庆 400067)
近年,农业正朝着集约化和规模化的方向发展,破坏了传统农业已有的废弃物循环利用模式,形成了大量随意堆积的农业废弃物,主要包括家畜粪尿、果皮、菜叶、秸秆等[1-2],其中作物秸秆就地焚烧,畜禽粪便与腐烂果蔬随意丢弃,既污染环境,又浪费资源[3-4]。堆肥化技术即利用微生物的转化作用,将这些废物转化为营养丰富的土壤肥料,具有效率高、成本低、污染低等多方面优点,已经成为重要的农业废物资源化利用技术之一[5]。
秸秆、粪便等废物中含有大量木质素及纤维素类物质,此类物质由β-D-葡萄糖以β-1,4-糖苷键连接而成,键与键之间化学性质稳定,且氢键和非共价键连接构成微纤丝,微纤丝有规律地排列成空间结构,这种长期进化出的复杂结构可以保护植物的整体性,也增加了纤维素类物质的难降解性,阻碍堆肥化进程[6]。
通过添加纤维素降解菌剂,使基质中的微生物协同作用,产生大量纤维素降解酶,将秸秆以及柑橘渣中的纤维素类物质降解,转化为易于植物吸收的小分子多糖,提高堆肥产品质量。
李瑞鹏[7]以秸秆与奶牛场废弃物为堆肥原料,通过60 d的堆肥处理,产品达到无害化要求,50℃持续时间10 d,高温有利于堆肥产品的腐熟,并且不同处理组中纤维素酶活性随堆肥反应呈现出先升高后降低的趋势,最大值达到27.1 U,这与温度变化趋势基本一致,另外,堆肥物料有机碳的降解和热值减少亦呈现出显著的正相关[8]。
田伟[9]以牛粪与秸秆为堆肥原料,在112 d的堆肥周期内,水分、挥发性固体物质、全碳的含量均逐渐降低,并且都在前42 d降低的幅度最大,这与有机质损失率的研究结果相一致,在前42 d有机质的损失最多,达到了43.8%。在堆肥第42 d纤维素酶的酶活达到最大值85.7 U之后有所降低,在整个高温阶段,纤维素酶的酶活均处于较高水平。进入降温阶段后,由于纤维素被大量分解,纤维素酶的酶活也逐渐下降,纤维素的降解趋势与堆肥化进程基本一致[10]。
本文以秸秆、柑橘渣以及动物粪便为堆肥原料,通过考查温度、pH、含水率、水溶性有机碳、总养分等指标的变化规律,综合评价堆肥化进程;并且探索堆肥化过程中总纤维素含量与酶活性变化的相关性,找到影响堆肥品质的因素以及纤维素降解的关键酶,为农业废弃物快速资源化利用提供技术支持和理论依据。
1 材料与方法
1.1 试验材料
实验原料:秸秆、收集自重庆市荣昌县高田村的粪便及采自附近某小型柑橘榨汁厂的柑橘皮渣。堆肥菌剂:如金菌剂(北京康源绿洲有限公司),主要成分为酿酒酵母及植物乳杆菌等。原料主要成分见表1。
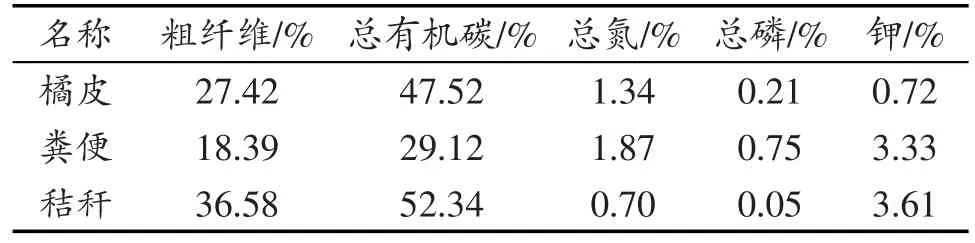
表1 堆肥原料主要成分Table 1 Main ingredients of compost material
DNS试剂:称取3,5-二硝基水杨酸(C7H4N2O7)7.3 g,置于1 000 mL烧杯中,加600 mL蒸馏水,逐渐加入氢氧化钠(NaOH)10.0 g,在50℃水浴中搅拌溶解,再依次加入酒石酸钾钠(C4O6H4KNa) 192.0 g,苯酚(C6H5OH) 2.5 g,无水亚硫酸钠(Na2SO3)5.0 g,混匀,冷却至室温,定容至1 000 mL,过滤,于棕色瓶中保存,暗处放置7天后使用。
中性洗涤剂:称取乙二胺四乙酸二钠(EDTA·2H2O)18.6 g和硼酸钠(Na2B4O7·10H2O)6.8 g,放入1 000 mL烧杯中,加200 mL蒸馏水,加热溶解,依次加入十二烷基磺酸钠(C12H25NaO4S)30 g和乙二醇乙醚(C4H10O2)10 mL,再称取磷酸氢二钠(Na2HPO4)4.56 g,于另一烧杯中,加入200 mL蒸馏水微热溶解,将两烧杯内液体混合,定容至1 000 mL,pH范围为6.9~7.1,一般不需要调节pH。
钒钼酸铵试剂:A液,称取25.0 g钼酸铵溶于400 mL水中;B液,称取1.25 g偏钒酸铵溶于300 mL沸水中,冷却后加250 mL硝酸,冷却。边搅拌边将A液缓缓注入B液中,用水稀释至1 L,混匀,贮于棕色瓶中。
1.2 试验设计
将秸秆切成5 cm小段,秸秆与粪便、柑橘皮渣质量按照4∶1∶5比例混匀,添加菌剂,控制含水率在60%左右。试验共设2个处理,接种菌剂(A组),不接种菌剂(B组)处理,每个处理设3个平行。添加菌剂处理按照菌料质量比1∶1000(w/w)添加菌剂,各处理将发酵原料置于500×400×300塑料整理箱中,整理箱四壁均匀分布孔径80 mm圆孔,用于通风,每天中午12点测定堆体中心温度,在中温及高温阶段,每2 d翻堆一次,在降温阶段,每3 d翻堆一次,共持续40 d。分别于第0 d,3 d,12 d,20 d,30 d,40 d取样,测定羧甲基纤维素 酶(Carboxymethyl Cellulase,CMCase), 漆 酶(Laccase),滤纸酶(Filter Paper Lyase,FPase)活性,总纤维素(Total Fiber,TF),总养分(N+P2O5+K2O),微生物数量,pH与含水率等指标。
1.3 测定项目与方法
1.3.1 粗酶液制备
取10 g堆肥样品浸入100 mL蒸馏水中,震荡培养4 h,静置30 min,随后用纱布过滤,于4℃,8 000 r/min的离心机内离心20 min,取上清液作为粗酶液,测量其酶活性[11]。酶活性测定中,每个试验处理均设置以蒸馏水代替粗酶液的对照组,每个处理重复3次。
1.3.2 漆酶活性(Laccase)
以2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(C18H24N6O6S4,ABTS)为底物。取2.5 mL浓度为0.1 mol/L的柠檬酸-柠檬酸钠缓冲溶液(pH 5.0)和0.3 mL浓度为1 mmol/L的ABTS置于比色管中,另取酶液0.2 mL,组成3 mL反应体系,反应15 min。于λ=420 nm处测吸光度值。酶活性定义:每分钟氧化1µmol ABTS所需的酶量定义为一个酶活力单位,单位为U。氧化产物的消光系数为3.6×104mol/(L·cm)[5]。
1.3.3 滤纸酶活性(FPase)
称取30 mg剪碎的滤纸,置于比色管中,依次加入0.8 mL乙酸-乙酸钠缓冲液(pH 4.8)和0.2 mL粗酶液。混匀后,置于50℃恒温水浴锅中,反应30 min,取出冷却至室温,加入0.5 mL DNS显色剂,置于沸水浴中5 min,取出冷却至室温,加蒸馏水定容至10.0 mL,在540 nm处测吸光度[12]。酶活性定义:每分钟水解滤纸产生1µmol葡萄糖所需酶量为一个酶活力单位,单位为U。
1.3.4 羧甲基纤维素酶(CMCase)
以0.5%羧甲基纤维素钠溶液为底物,取2 mL底物溶液于10 mL比色管中,加入粗酶液0.5 mL,50℃水浴反应30 min,再加入3 mL DNS试剂,置于沸水浴中加热10 min,冷却至室温,定容至10 mL,540 nm下测定吸光度[13]。酶活性定义:每分钟水解羧甲基纤维素钠产生1µmol葡萄糖所需酶量为一个酶活力单位,单位为U。
1.3.5 总纤维素含量(Total Fiber,TF)
准确称取1.0 g干样品记为W,置于直筒烧杯中,分别加入100 mL中性洗涤剂,0.5 mL十氢化萘,0.5 g无水亚硫酸钠,将烧杯套上冷凝装置,置于电炉上,尽快煮沸,后保持微沸60 min,注意加水保持刻度在100 mL,煮沸完毕,取下直筒烧杯,将烧杯中的残渣全部移入玻璃砂芯漏斗,以沸水冲洗漏斗内残渣,直到滤液为中性。用20 mL丙酮冲洗并抽滤。将玻璃砂芯漏斗置于105℃烘箱中烘4 h后,在干燥器中冷却30 min后称重,直至衡重W1。称重后,将玻璃砂芯漏斗放入马弗炉中,550℃灰化3 h,在干燥器中冷却30 min后再次称重W2。
总纤维素含量计算公式如下:

1.3.6 pH
称取鲜样品10.0 g,置于含有90 mL无菌水的无菌干燥锥形瓶中,在120 r/min摇床中震荡30 min,后静置10 min,用pH计测定过滤后浸提液的pH。
1.3.7 水溶性有机碳(WSC)
前处理同节1.3.1,所得粗酶液即为WSC测定母液,稀释至适当浓度后用总有机碳分析仪测定水溶性有机碳含量[9]。

式中:C为提取液中有机碳浓度;单位为mg/g;G为样品中水溶性有机物的原始浓度,单位为mg/g;W为固体质量,单位为g;K为吸着系数,单位为L/g;V为水相体积,单位为L。
1.3.8 总养分(N+P2O5+K2O)
(1)采用凯氏定氮仪测定N含量
将样品置于CuSO4,K2SO4,H2SO4的混合溶液中消解、稀释、过滤。将稀释液进行蒸馏,收集蒸馏产生的NH3,并溶于H3BO3溶液中,最后通过滴定H3BO3溶液来计算样品中N的含量[5]。
(2)采用H2SO4-H2O2消煮—钒钼酸铵比色法测定P2O5含量
取试样1.0 g,加5 mL优级纯硫酸和1.5 mL 30%过氧化氢溶液,摇匀,瓶口放一弯颈小漏斗,放置过夜。在电炉上缓慢升温至硫酸冒烟,取下稍冷却,加15滴过氧化氢溶液,加热10 min,稍冷后再加5~10滴过氧化氢溶液并分次消煮,直至溶液澄清后,继续加热10 min,除尽剩余的过氧化氢。取下稍冷,小心加水至20 mL,加热煮沸。取下冷却,用少量水冲洗弯颈小漏斗,洗液收入原凯氏烧瓶中。将消煮液移入100 mL容量瓶中,加水定容,静置澄清,作为储备液。
吸取此储备溶液10.0 mL于容量瓶中,加水至30 mL,加2滴质量浓度为0.2%的 2,4-二硝基酚指示剂溶液,用10%氢氧化钠溶液和5%硫酸溶液调节溶液呈微黄色,加10.0 mL钒钼酸铵试剂,摇匀,定容至50 mL,用分光光度计于波长440 nm处测定吸光度[14]。

式中:c2为显色液磷浓度,单位µg/mL;V3为显色液体积,50 mL;D为分取倍数,定容体积/分取体积(100/10);m为风干样质量,单位g;X0为风干样含水量;2.29表示将P换算成P2O5的因数;0.000 1为将µg/g换算为质量分数的因数。
(3)采用H2SO4-H2O2消煮—火焰光度法测定K2O含量
吸取5.0 mL储备液于50 mL容量瓶中,定容。在火焰光度计上测定,记录仪器示值[14]。

式中:c3为测定液K浓度,单位µg/mL;V4为测定体积,50 mL;D为分取倍数,定容体积/分取体积(100/5);m为风干样质量,单位g;X0为风干样含水量;1.20表示将K换算成K2O的因数;0.000 1表示将µg/g换算为质量分数的因数。
1.3.9 微生物数量
采用稀释涂布平板法测定细菌、真菌和放线菌数量[8]。
1.3.10 含水率
用烘干恒重法测定堆肥样品的含水率。称取10 g左右新鲜堆肥样品置于已知重量平皿中,测定质量,将平皿置于烘箱中60℃烘干12 h,在干燥器中冷却并称重。堆肥样品烘干前后的重量差与新鲜样品重量的比值即为含水率(%)[15]。
1.4 数据处理
试验所用数据均为三组平行数据的平均值,采用OriginPro 8.0软件进行统计分析。
2 结果与分析
2.1 堆肥过程中理化指标变化
2.1.1 温度
温度是堆肥化最直观也是最重要的参数,微生物的生长、繁殖都与温度变化密切相关,有些微生物不适应堆体温度的变化,数量逐渐减少,甚至死亡,另一部分微生物则大量繁殖,成为堆体中的优势种群[5]。堆肥过程中温度变化如图1所示。

图1 堆肥过程中温度变化Fig.1 The changes of temperature during composting
根据温度变化堆肥过程分为3个阶段,对于添加堆肥菌剂的A组,1~4 d为升温阶段,5~14 d为高温阶段,15~17 d为降温阶段,18~40 d为腐熟阶段;对于未添加堆肥菌剂的B组,1~7 d为升温阶段,8~12 d为高温阶段,13~17 d为降温阶段,18~40 d为腐熟阶段。在升温阶段,细菌和真菌将简单有机物(蛋白质、淀粉、多糖等)降解产生大量热量,由于堆体不易散热,中心温度快速上升,达到55℃,进入高温期,A组高温期持续10 d,B组高温期持续5 d,由于高温可杀死堆肥基质中的病原菌等有害物质,因此长时间的高温可以使堆肥达到卫生标准[7],A组高温期持续时间比B组多5 d,且高温期平均温度比B组高2.76℃(A组高温期平均温度58.22℃,B组高温期平均温度55.46℃),A组堆肥进行到第 15 d时温度迅速降低进入降温阶段,B组第13 d进入降温阶段,这是由于微生物活动减弱,导致堆体温度逐渐下降,B组先于A组进入降温阶段,这说明添加菌剂的A组微生物活性高于B组,从第18 d开始,A组与B组同时进入腐熟期,此阶段温度波动不大,趋于平稳,堆肥实验结束时堆体温度接近于室温。堆体温度的变化又会通过影响微生物的生长与代谢来影响堆肥进程。
2.1.2 pH
如图2所示,在整个堆肥过程中,A组pH从初始的7.07迅速降低到第3 d的6.53,微生物快速分解堆肥基质中的有机物,产生大量的有机酸,pH值较低;随着堆肥化的进行,有机酸被分解,pH值逐渐变大,第20 d达到最大值8.16,在堆肥的腐熟期稍有降低,第40 d达到7.78。与A组相比,B组pH在第3 d降低为6.71,随后逐渐升高,在第30 d达到最大值7.80,腐熟后期略有降低,这说明堆肥初期A组产酸能力强于B组,随着堆肥化的进行微生物分解有机酸的能力也强于B组,即添加菌剂的A组微生物活性高于B组。本次堆肥过程中的pH维持在6.53~8.16,与Bernal报道的堆肥最适pH 5.5~8.0基本吻合[16]。

图2 堆肥过程中pH变化曲线Fig.2 The changes of pH during composting
2.1.3 含水率
水分是微生物进行新陈代谢及反应的介质,堆体中可降解的物质只有先溶于水才能被微生物吸收并利用。另外,微生物只有不断从环境中吸收水分才能维持自身生长繁殖并降解纤维素[5]。从图3中可以看出,物料初始含水率为60.6%,随着堆肥化的进行,含水率不断降低,到堆肥化结束时,A组的含水率为29.5%,堆肥过程中含水率下降了31.1%,其中22.5%的水分是在堆肥的第1~12 d散失;堆肥结束时B组含水率为38.1%,下降了22.7%,其中15.7%的水分是在堆肥的第1~12 d散失,A组与B组在堆肥13 d以后水分散失速率较低,这与堆体中心温度变化相一致,含水率降低会使物料与空气的接触面积变大,加快堆体中热量和水分的散失,从而降低微生物新陈代谢与产酶能力,使腐熟速率变慢。A组最终含水率低于B组,再次说明A组微生物活性高于B组,更多的水分被微生物用于代谢与降解。

图3 含水率变化曲线Fig.3 The changes of moisture content during composting
2.1.4 水溶性有机碳(WSC)
WSC是堆肥微生物最直接的碳源,可被微生物直接利用来合成自身物质,WSC的变化反映堆肥微生物的活跃水平[10]。WSC的含量变化是动态的,当基质降解速率低于利用速率时,堆肥体系中的WSC含量就上升,相反就会降低[9]。如图4所示,WSC在堆肥前期略有上升,A组由开始的222.14 mg/kg上升到最高的239.60 mg/kg干样,B组由开始的220.45 mg/kg上升到最高的230.12 mg/kg干样,堆肥初期部分细菌和真菌种群能够较快适应堆肥环境,并产生相关酶,这些酶使有机物从堆肥物料上脱落并将其降解,产生大量WSC。随着堆体中微生物的继续生长繁殖,对碳源、氮源等营养物质的需求越来越大,WSC被迅速利用,合成大量的酶,将难降解有机质逐渐降解,导致堆体WSC在堆肥后期迅速降低[17],A组低至70.35 mg/kg,B组低至86.97 mg/kg。
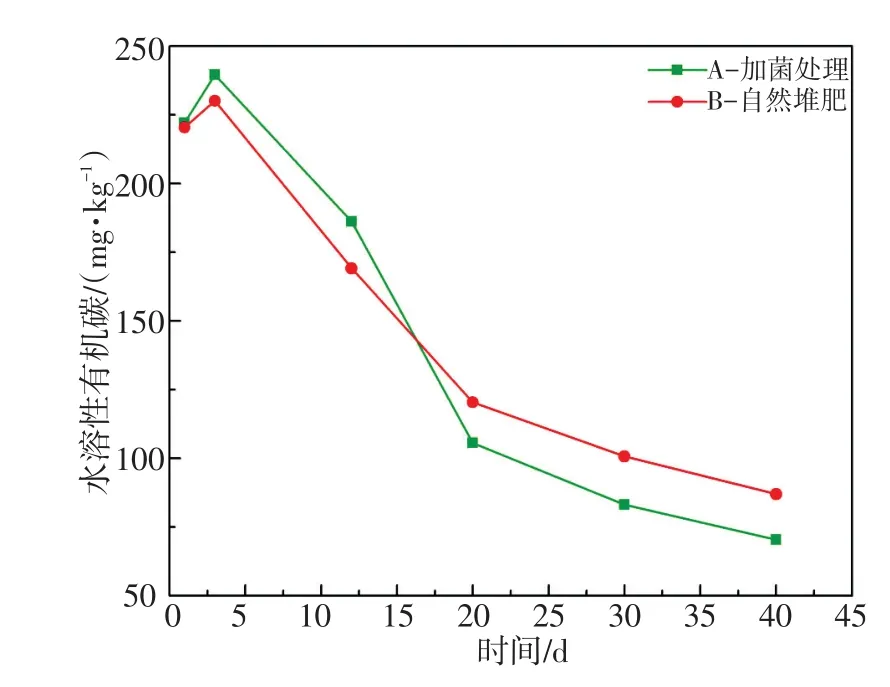
图4 水溶性碳水化合物(WSC)变化曲线Fig.4 The changes of WSC during composting
2.2 总纤维含量(TF)
纤维素、半纤维素与木质素靠分子间共价键与非共价键紧密相连,形成植物细胞壁,三者可占植物细胞干重的90%以上[18],由于其结构复杂,很难被降解。如图5所示,在堆肥升温阶段,TF含量略有降低,A组降解率为3.43 g/(kg·d),B组降解率为0.33 g/(kg·d);在高温及降温阶段,A组TF含量降低了11.60%,B组TF含量降低了7.59%,A组降解率为6.44 g/(kg·d),B组降解率为4.46 g/(kg·d);在腐熟阶段,TF降解率有所降低,A组降解率为3.40 g/(kg·d),B组降解率为2.69 g/(kg·d),A组TF最终含量为15.70%,B组TF最终含量为22.08%,由此可见,添加菌剂的A组对纤维素类的降解优于不加菌剂的B组。

图5 总纤维素含量(TF)变化曲线Fig.5 The changes of TF during composting
2.3 堆肥过程中相关酶活性变化
2.3.1 漆酶活性(Laccase)
Laccase在微生物降解木质素中发挥着关键作用。如图6所示,Laccase酶活在堆肥过程中变化剧烈,对于添加菌剂的A组,在升温阶段酶活迅速升高至146.7 U,并在高温及降温阶段稳定在146.70~150.79 U之间,在腐熟期,Laccase活性迅速降低,堆肥结束时Laccase活性为30.14 U。B组呈现出与A组基本相同的变化趋势,但B组高温及降温阶段酶活性比A组低12.28 U,这是由于B组高温阶段温度低于A组导致的。Roberts等[19]人报道大肠杆菌(E.coli)的Laccase最适宜反应温度为55℃,来自天蓝色链霉菌(S.coelicolor)的Laccase最适温度为80℃[20],所以Laccase活性在堆肥升温期及高温期迅速升高并维持在150 U上下,主要由于功能微生物在这一阶段快速增殖且产酶能力较强,当堆体温度降至30℃左右,微生物产酶能力被抑制,已有Laccase被底物不断利用,导致Laccase活性迅速降低,这与TF含量呈现出一致的变化趋势。

图6 漆酶(Laccase)活性变化曲线Fig.6 The changes of laccase activity during composting
2.3.2 滤纸酶活性(FPase)
FPase可以降解非水溶性纤维素,其活性可以反映堆肥体系降解纤维素与半纤维素的能力[21]。如图7所示,在堆肥升温期与高温期,A组与B组FPase活性都随着堆肥进程迅速增大,在第12 d达到最大,分别为102.22 U和87.45 U,这是因为微生物产酶能力及酶活性都随温度的升高而升高,当堆肥进入降温阶段及腐熟阶段后,酶活性随着温度的降低而降低,FPase活性对温度变化较为敏感。
2.3.3 羧甲基纤维素酶(CMCase)
CMCase以可溶性纤维素为底物,将其水解成还原性的寡糖,是纤维素酶系的主要成分[12]。如图8所示,A组与B组中CMCase活性先随反应进程不断升高,到第12 d时达到最大值,分别为A组350.56 U,B组320.19 U,后又逐渐降低,到第30 d时,A组CMCase活性为203.12 U,B组CMCase活性为200.08 U,之后A组酶活略有降低,B组酶活维持不变。由于CMCase以可溶性纤维素为底物,不同于FPase和Laccase,所以CMCase酶活在堆肥后期依旧保持较高的活性,推测是堆肥后期,堆体内仍然有一定浓度的可溶性纤维素类物质,所以依旧保持了一定的酶活,且堆肥后期(第30~40 d),A组酶活性降低了17.32 U,B组基本保持不变,这可能与含水率的变化有关,A组含水率由30.0%降低为29.5%,B组含水率则维持在38%上下,含水率降低导致可溶性纤维素减少,在诱导效应的作用下,相应酶活性也降低。
2.3.4 TF与Laccase,FPase,CMCase相关性
将图5至图8中TF值变化与3种酶活性变化趋势做相关性分析,发现TF与Laccase,FPase,CMCase活性相关性分别为0.836 7,0.760 8,0.389 3,这说明TF变化与Laccase活性显著相关(R2>0.8),与FPase活性相关(R2>0.6),所以Laccase及FPase活性可以反映总纤维素的降解效果。
2.4 堆肥过程中堆体微生物数量变化
如表2所示,堆肥前后A组细菌数量降低了1.09×109cfu/g,真菌数量降低了8.50×102cfu/g,放线菌数量降低了1.27×105cfu/g;B组细菌数量降低了8.90×108cfu/g,真菌数量降低了5.30×102cfu/g,放线菌数量降低了9.20×104cfu/g。细菌、真菌、放线菌的数量随着温度升高逐渐降低,在第12 d即高温期后期降至最低,随着堆肥进入降温期及腐熟期,微生物数量又呈现出上升趋势,这主要是温度变化导致的,堆肥过程中有害微生物被抑制作用,数量降低,有益微生物大量生长,成为堆肥过程的主导微生物,并且A组中微生物总量的减少值高于B组,再次印证较高的温度有利于抑制堆体中的有害微生物,大大提高堆肥产品的品质。

表2 堆肥过程中微生物数量的变化Table 2 The changes of microbial quantity during composting
2.5 总养分
总养分(N+P2O5+K2O)是微生物生长的重要营养物质,也是堆肥产品质量的评价标准。如图9所示,总养分含量随着堆肥进程逐渐增加,A组增加了1.58%,B组增加了1.24%。有机质在堆肥过程中被微生物分解利用,部分有机氮转化成氨氮和硝氮,氨氮进一步分解,以氨气的形式散失到空气中,使总质量有一定的损失;而P素和K素性质稳定,尽管P素与K素存在不同形态间的转化,但不会挥发损失[22-23],所以综合N,P,K的变化趋势,总养分含量略有升高。

图9 堆肥过程中总养分(N+P2O5+K2O)含量变化Fig.9 The changes of N+P2O5+K2O during composting
2.6 堆肥产品品质分析
农业废弃物经过40 d的堆肥处理后,各项指标变化如表3所示,pH由7.0左右上升到7.7~7.8,A组与B组保持一致。A组含水率降低了29.5%,B组含水率下降了22.7%,较低的含水率有利于有机肥的长期保存,A组优于B组。A组WSC含量降低了151.79 mg/kg,B组WSC含量降低了133.48 mg/kg,A组添加功能菌剂,微生物活性强,利用WSC的能力也强,所以A组WSC降低值高于B组。A组TF降低了19.42%,B组TF降低了13.06%,A组对纤维素的降解率更高。A组细菌、真菌、放线菌菌落数分别低于B组2.1×108cfu/g、2.5×102cfu/g、3.2×104cfu/g,并且A组N+P2O5+K2O含量高于B组0.34%,所以,A组所得堆肥产品品质优于B组。

表3 堆肥前后主要成分对比Table 3 Comparison of main components before and after composting
3 结论
(1)堆肥过程中,物料颜色逐渐加深,变为深褐色,堆肥初期堆体散发恶臭,有大量蚊蝇围绕,随堆体温度升高并保持稳定,恶臭及蚊蝇逐渐消失,堆体逐渐失水,堆体表面呈现干涸状,堆至40 d,获得堆肥产品。
(2)添加菌剂有助于推动堆肥进程,微生物的快速大量增殖可以促进堆体提前进入高温期,并维持较高的温度(最高温度60.3℃),持续较长的时间(10 d),使含水率、总养分、总纤维素、可溶性碳水化合物等指标都优于对照组,并且较高温度抑制了有害微生物的繁殖,促进了堆肥化进程,提高了堆肥产品质量。
(3)总纤维素含量与Laccase,FPase,CMCase活性相关性分别为0.836 7,0.760 8,0.389 3,这说明Laccase及FPase活性可以反映纤维素的降解效果,相关性较强,Laccase可以降解木质素,FPase可以降解不溶性纤维素及半纤维素,CMCase可以降解可溶性纤维素及半纤维素,也就是说,以固态纤维素类为降解底物的酶,其活性可以反映总纤维素类物质的降解效果。
[1]MAYSD,TERMAN G,DUGGAN J.Municipal compost:Effects on crop yields and soil properties[J].Journal of En⁃vironmental Quality,1973,2(1):89-92.
[2]LITTERICK A,HARRIER L,WALLACE P,et al.The role of uncomposted materials,composts,manures,and com⁃post extracts in reducing pest and disease incidence and severity in sustainable temperate agricultural and horticul⁃tural crop production-review[J].Critical Reviews in Plant Sciences,2004,23(6):453-479.
[3]杜艳艳,赵蕴华.农业废弃物资源化利用技术研究进展与发展趋势[J].广东农业科学,2012(2):192-196.
[4]汪建飞,于群英,陈世勇,等.农业固体有机废弃物的环境危害及堆肥化技术展望[J].安徽农业科学,2006,34(18):4720-4722.
[5]鲁伦慧.农业废物堆肥中木质素降解功能微生物群落结构研究[D].长沙,湖南大学,2014.
[6]HUANGH L,ZENGG M,TANGL,et al.Effect of biodel⁃ignification of rice straw on humification and humus quali⁃tybyPhanerochaetechrysosporiumandStreptomycesbadius[J].InternationalBiodeterioration&Biodegradation,2008,61(4):331-336.
[7]李瑞鹏.秸秆与奶牛场废弃物混合堆肥及其应用研究[D].南京:南京农业大学,2012.
[8]沈萍,范秀容,李广武.微生物学实验(第二版)[M].北京:高等教育出版社,1989.
[9]田伟.牛粪高温堆肥过程中的物质变化,微生物多样性以及腐熟度评价研究[D].南京:南京农业大学,2012.
[10]GARCIA C,HERNANDZE T,COSTA F,et al.Evalua⁃tion of the maturity of municipal waste compost using sim⁃ple chemical parameters[J].Communications in Soil Sci⁃ence and Plant Analysis,1992,23(13/14):1501-1512.
[11]YU R T,WANG L S,DUAN X Y.Isolation of cellulolytic enzymes from moldy silage by new culture-independent strategy[J].Biotechnology letters,2007,29(7):1037-1043.
[12]李兴华.纤维素酶产生菌的筛选及纤维素酶基因在家蚕中的表达研究[D].杭州,浙江大学,2011.
[13]李世忠.柑橘皮渣降解菌的筛选及其相关特性研究[D].重庆,西南大学,2014.
[14]中华人民共和国农业部.有机肥料标准:NY525-2012[S].北京:中国标准出版社,2012.
[15]中华人民共和国农业部.复合微生物肥料:NY/T 798-2015[S].北京:中国标准出版社,2015.
[16]BERNAL M,ALBURQUERQUE J,MORAL R.Compost⁃ing of animal manures and chemical criteria for compost maturity assessment.A review[J].Bioresource Technology.2009,100(22)5444-5453.
[17]SUNDBERG C,SMÅRS S,JÖNSSONH.Low pH as an in⁃hibiting factor in the transition from mesophilic to thermo⁃philicphaseincomposting[J].BioresourceTechnology,2004,95(2):145-150.
[18]BREZNAK J A,BRUNE A.Role of microorganisms in the digestion of lignocellulose by termites[J].Annual Review of Entomology,1994,39:453-487.
[19]ROBERTS S A,WEICHSEL A,GRASS G,et al.Crystal structure and electron transfer kinetics of CueO,a multi⁃copper oxidaserequiredforcopperhomeostasisinEscherich⁃iacoli[J].Proceedings of the National Academy of Sciences of the United States of America,2002,99(5):2766-2771.
[20]SHERIF M,WAUANG D,KORBECI B,et al.Biochemi⁃cal studies of the multicopper oxidase(small laccase)from Streptomyces coelicolor using bioactive phytochemicals and site-directed mutagenesis[J].Microbial biotechnology,2013,6(5):588-597.
[21]张丽丽.整合宏组学方法揭示天然木质纤维素堆肥中的关键功能微生物群落[D].济南,山东大学,2016.
[22]卢秉林,王文丽,李娟,等.牛粪与小麦秸秆混合高温堆肥的腐熟进程研究[J].环境污染与防理,2010,32(1):30-34.
[23]王亚飞,李梦婵,邱慧珍,等.不同畜禽粪便堆肥的微生物数量和养分含量的变化[J].甘肃农业大学学报,2017,52(3):37-45.

