Vasorin基因稳定敲除HepG2细胞株的建立及其生物学功能研究
耿介,王超男,李少华,丁红梅,李慧,黄皑雪,李洁,李达,白琛俊,张坦,董洁,邵宁生
军事医学研究院 军事认知与脑科学研究所,北京 100850
人vasorin(VASN)蛋白又称slit-like2(SLITL2)蛋白,是一种Ⅰ型跨膜糖蛋白,其N端胞外结构域可以被去整合素-金属蛋白酶17(a disintegrin and metalloprotease 17,ADAM17)酶解为可溶性VASN(soluble VASN,sVASN),释放至体液中[1]。已有文献报道,人VASN蛋白在主动脉的血管平滑肌细胞有较高水平的表达,在肾脏、胎盘组织也有表达,并且在乳腺癌细胞、肝癌组织及细胞中也有高表达[2]。
关于VASN蛋白的生物学功能已有报道,TGF-β能够与可溶性VASN蛋白结合,抑制TGF-β介导的上皮-间质转化(epithelial-to-mesenchy⁃mal transition,EMT),提示VASN蛋白可能参与了肿瘤的发生发展[3]。而我们实验室的前期工作提示VASN蛋白可能是潜在的肝癌血清标志物[4],并且对VASN蛋白的生物学功能进行了初步探讨。细胞中VASN蛋白有促进肝癌细胞增殖和迁移的作用[4];而VASN蛋白存在于HepG2细胞来源的外泌体中,其可被转运至人脐静脉内皮细胞(hu⁃man umbilical vein endothelial cells,HUVEC)中,对HUVEC的迁移也有促进作用[5]。基于以上结果,深入探讨VASN蛋白的生物学功能及其分子机制,对于研究肿瘤的发生机制非常有意义。因此,我们拟构建VASN基因稳定敲除的细胞株,为深入研究VASN蛋白的生物学功能奠定基础。
我们利用基因编辑技术CRISPR/Cas9,将潮霉素B的抗性基因插入VASN基因,从而破坏了VASN的读框,使VASN蛋白的表达发生异常;然后再利用潮霉素B抗性筛选获得稳定敲除VASN的HepG2细胞株;进而,利用稳定敲除VASN的HepG2细胞株研究VASN的生物学功能和分子机制。
1 材料和方法
1.1 材料
HepG2细胞由本室保存;表达载体pCas-guide和pSilencer2.1-U6hygro由军事医学研究院郑晓飞教授惠赠;pBackZero-T载体、平末端PCR产物加A试剂盒购自TaKaRa公司;pfu酶购自北京全式金生物技术公司;感受态大肠杆菌DH5α、T4DNA连接酶、柱式基因组DNA提取试剂盒、琼脂糖凝胶DNA回收试剂盒及质粒小提试剂盒购自天根生化科技有限公司;限制性核酸内切酶BamHⅠ、BsmBⅠ购自Thermo Scientific公司;PRIME jet转染试剂购自PolyPlus公司;潮霉素B购自罗氏公司;VASN抗体由本室自行制备;引物由生工生物技术公司合成;CCK-8购自碧云天生物技术有限公司;2×SYBR PCR Mix(ROX)购自康为公司;TRIzol试剂购自Sigma公司。
1.2 构建pCas-gRNA质粒
运用Crispr Design程序(http://crispr.mit.edu/)设计针对VASN基因序列的指导 RNA(guide RNA,gRNA)的3对引物序列(表1),送生工公司合成。gRNA引物退火,用BamHⅠ和BsmBⅠ双酶切,将酶切的退火产物与具有相同粘性末端的载体pCas-guide连接,20℃连接4 h,连接产物转化大肠杆菌DH5α感受态细胞,于含氨苄西林的LB培养板上于37℃过夜培养,挑取细菌单克隆PCR鉴定,分别选取2个阳性克隆测序。
1.3 构建供体DNA质粒pBackZero-T-VASN
收集HepG2细胞,按照基因组提取试剂盒说明书提取HepG2细胞基因组;以提取的细胞基因组作为PCR模板,分别以VASN-LF/VASN-LR、VASN-RF/VASN-RR为引物,扩增VASN左、右同?源臂片段VASN-L和VASN-R;以Hy-F/Hy-R为引物,质粒pSilencer2.1-U6hygro为模板,扩增潮霉素B抗性基因片段Hy;将片段VASN-L、Hy和VASNR混合作为模板,以VASN-LF和VASN-RR为引物进行重叠PCR,扩增目的片段VASN-KO;用平末端PCR产物加A将单个碱基A加在VASN-KO片段末端,进而与pBackZero-T载体连接,连接产物转化大肠杆菌感受态细胞DH5α,挑取细菌单克隆PCR鉴定,选取4个阳性克隆测序。

表1 合成的引物序列
1.4 细胞转染及VASN稳定敲除细胞株筛选
将HepG2细胞以1×105/mL接种于6孔细胞板中,当细胞生长至约40%时转染1 μg pCasgRNA质粒,48 h后再转染1.5 μg pBackZero-TVASN质粒;约5 d后,将转染后的HepG2细胞以6×104/mL的密度接种到100 mm2细胞培养皿中,待细胞完全贴壁后加入潮霉素B(300 μg/mL)进行抗性筛选,2~3 d换液一次;培养至第10 d在显微镜下观察细胞培养皿,可以看到已有单克隆形成,将其转移至6孔板中继续扩大培养。
无限稀释法筛选VASN稳定敲除的HepG2单克隆细胞株。胰酶消化细胞,以新鲜培养基稀释细胞浓度为10/mL,将稀释的细胞悬液接种至96孔板,100 μL/孔,培养1周后显微镜下观察,选取单克隆细胞扩大培养,扩大培养至24孔板时,培养基中加入300 μg/mL潮霉素B继续培养。
1.5 Western印迹检测VASN敲除细胞株中的VASN蛋白含量
用含潮霉素B的培养基培养1周,收集细胞,提取细胞总蛋白,BCA法定量蛋白,每泳道40 μg蛋白进行SDS-PAGE,Western印迹鉴定,一抗为本室自制的鼠源VASN抗体(终浓度1 μg/mL),4℃孵育整夜,二抗为HRP标记的羊抗小鼠IgG,室温孵育约1 h,ECL显影。
1.6 RT-PCR检测VASN敲除细胞株中VASN mRNA水平
用含潮霉素B的培养基培养1周,收集细胞,TRIzol提取细胞总RNA,取1 μg RNA,以Oligo dT为引物,用反转录酶将RNA反转成cDNA。20 μL体系中,以1 μL cDNA为模板,VASN-F/ VASN-R为引物进行RT-PCR实验,检测VASNmRNA表达水平。
1.7 细胞增殖实验
细胞生长曲线可以直观地反映细胞的增殖能力。胰酶消化对数生长期的VASN稳定敲除的细胞和野生型HepG2细胞,用新鲜培养基将细胞稀释至104/mL,按100 μL/孔种于96孔板。细胞贴壁时记为零点,分别在0、24、48、72、96 h时加入10 μL CCK-8试剂,细胞培养箱中孵育1.5 h,测定不同时间点的D450nm值,绘制细胞生长曲线。
1.8 Tranwell细胞迁移实验
将VASN稳定敲除的HepG2细胞和野生型HepG2细胞培养至对数生长期,胰酶消化,收集细胞,用新鲜培养基重悬细胞至2×105/mL;取200 μL细胞悬液种于Transwell小室的上层,小室下层加入500 μL新鲜培养基,细胞培养箱中培养12 h;用棉签擦去Transwell小室上层内侧细胞,用0.1%结晶紫染色,室温放置30 min;将多余的结晶紫冲洗干净,显微镜下观察细胞迁移情况并拍照;用30%的醋酸酒精洗脱穿膜的细胞,测定D450nm值。
1.9 统计学方法
用SAS软件分析数据,采用Student'st检验进行统计学分析,P<0.05视为具有统计学差异。
2 结果
2.1 构建pCas-gRNA质粒
用Crispr Design程序设计gRNA,将靶位点序列设定在VASN编码基因起始位点后200~400 bp。为了降低脱靶的可能,共选取了3条gRNA序列。将合成的3对DNA片段分别退火形成双链,进而双酶切,然后与具有相同粘性末端的pCAS-guide载体连接,获得重组质粒pCAS-gRNA。重组子分别转化感受态细胞,LB平板培养,氨苄西林抗性筛选,挑取单克隆进行菌落PCR,鉴定为阳性的克隆测序(图1),结果表明3个pCAS-gRNA质粒均构建成功。
2.2 构建供体DNA质粒pBackZero-T-VASN
以HepG2细胞基因组为模板,分别以VASNLF/VASN-LR、VASN-RF/VASN-RR为引物,扩增VASN左、右同源臂片段VASN-L和VASN-R;以Hy-F/Hy-R为引物,质粒pSilencer2.1-U6hygro为模板,扩增潮霉素B抗性基因片段Hy(约1100 bp)(图2A)。将片段VASN-L、Hy和VASN-R混合作为模板,以VASN-LF和VASN-RR为引物扩增VASN同源臂供体DNA片段VASN-KO(图2B)。将单个碱基A添加在VASN-KO片段末端,进而与pBackZero-T载体连接,连接产物转化大肠杆菌感受态细胞DH5α,菌落PCR鉴定为阳性的克隆测序(图3)。序列比对结果显示,同源臂供体质粒pBackZero-T-VASN构建成功。

图3 菌液PCR鉴定阳性克隆M:DNA marker DL2000;1~8:单克隆;NC:阴性对照;PC:阳性对照
2.3 基因组水平鉴定转染细胞株
将pCas-gRNA与pBackZero-T-VASN共转染HepG2细胞,基因组发生同源重组,潮霉素B抗性基因插入VASN基因的特定位点,使VASN不能正确表达。提取转染的细胞基因组DNA,以KO-F/ KO-R为引物进行PCR鉴定。结果显示2个重组质粒转染的细胞基因组DNA经PCR扩增后在750 bp处出现目的条带,而野生型HepG2细胞则无条带,证明潮霉素B抗性基因正确插入VASN基因的特定位点(图4),VASN读框已被破坏,VASN蛋白不能表达。

图4 基因组PCR鉴定M:DNA marker DL5000;NC:阴性对照;1、3、4:插入潮霉素B基因后片段
2.4 Western印迹鉴定VASN稳定敲除的单克隆细胞株
用无限稀释法筛选VASN敲除的细胞单克隆,培养约1周后显微镜下观察,将含有单克隆细胞的孔继续培养,并加入潮霉素进行抗性筛选。当细胞数量足够时,取出部分细胞提取总蛋白,Western免疫印迹鉴定,结果显示1~5号克隆的VASN蛋白表达水平均明显下调,1、4号最为显著(图5)。
2.5 RT-PCR鉴定VASN稳定敲除的单克隆细胞株
经过Western印迹鉴定,1号(1#)和4号(4#)VASN稳定敲除细胞中的VASN蛋白含量最低,因此将筛选出的1#、4#细胞做基因水平鉴定。收集细胞提取总RNA,反转录为cDNA,qPCR鉴定其VASNmRNA表达。1#细胞的VASNmRNA表达水平最低,只有野生型HepG2细胞(WT)的1/7(图6),统计学分析表明二者有明显差异,说明1#单克隆细胞中的VASN基因被基本敲除。

图5 Western印迹检测单克隆细胞株中VASN的表达

图6 RT-PCR鉴定VASN的mRAN水平WT为野生型HepG2细胞,1#、4#为VASN稳定敲除细胞
2.6 VASN稳定敲除的细胞株增殖能力下降
为了验证VASN蛋白对细胞增殖能力的影响,利用CCK-8法检测VASN敲除细胞和野生型细胞的增殖情况。将筛选出的1#VASN敲除细胞和野生型细胞培养至对数生长期,以1000/孔的浓度种于96孔板,贴壁后分别于0、24、48、72、96 h加入10 μL CCK-8,37℃孵育1.5 h后测定D450nm值,得到细胞生长曲线(图7)。可以看出野生型HepG2细胞的生长速度明显高于VASN敲除细胞株,并且两者的差距随着时间的延长逐渐增大(P<0.05)。此结果提示VASN蛋白可能参与细胞增殖过程。

图7 细胞生长曲线WT为野生型HepG2细胞,1#为VASN稳定敲除细胞
2.7 VASN稳定敲除的细胞株迁移能力下降
细胞迁移是反应细胞运动能力的重要指标,而且与侵袭和转移能力密切相关。我们利用Transwell实验检测了1#VASN敲除细胞和野生型HepG2细胞的迁移能力。结果显示,VASN敲除的细胞在膜上的覆盖面积明显小于野生型HepG2细胞(图8)。将穿过小室的细胞用30%醋酸洗脱,酶联仪测定D450nm值(图9),野生型HepG2细胞穿膜的细胞数约为VASN敲除细胞的2倍,VASN敲除细胞的迁移能力明显减弱(P<0.05)。此结果提示VASN可能参与细胞的迁移过程。
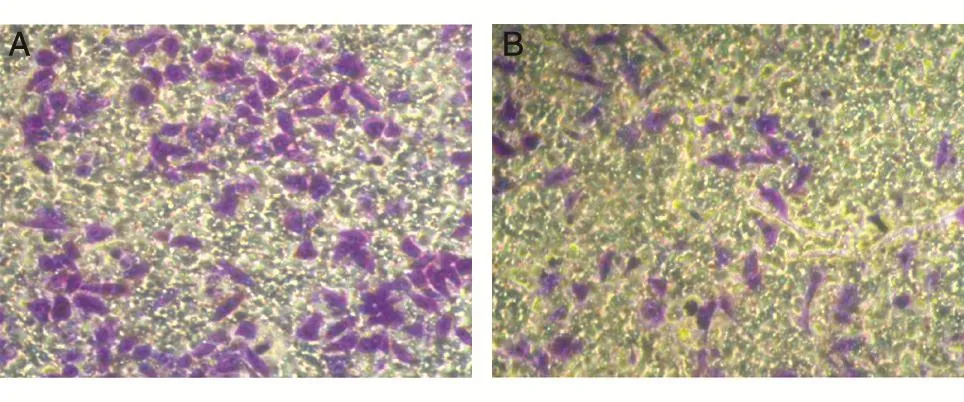
图8 结晶紫染色观察细胞迁移(400×)A:野生型HepG2细胞;B:1#VASN稳定敲除细胞
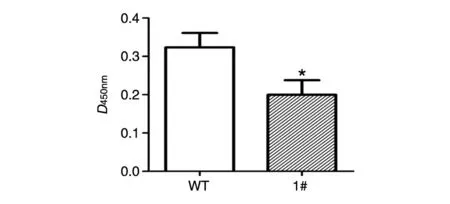
图9 穿过Transwell小室的细胞吸光度A:野生型HepG2细胞;B:1#VASN稳定敲除细胞
3 讨论
自2004年Yuichi Ikeda等首次鉴定出VASN蛋白,迄今相关研究较少。已有报道显示,VASN蛋白可能与机体发育、血管损伤修复及肿瘤的发生发展相关。我们的前期工作表明,VASN不仅可能是一种新型的肝癌血清标志物,而且可能在肝癌的发生发展中具有重要作用[3]。
CRISPR/Cas9是新兴的基因编辑技术[6],具有构建简单、剪切高效的特点[7]。向导RNA通过碱基互补配对,精确靶向目的基因序列,募集Cas9核酸内切酶到达目的基因,剪切基因组DNA。细胞通过2种修复机制,即同源重组修复和非同源末端连接修复,修复断裂的双链DNA[8-9],本研究采用了精确度相对高的同源重组修复策略[10],并且在提供同源重组所需的同源臂的同时,将潮霉素B抗性基因及终止子插入VASN基因起始位点下游,破坏VASN基因的开放读框,VASN蛋白不能正常表达,而抗性基因的表达为后续细胞筛选提供了便利。
在建立VASN稳定敲除HepG2细胞株后,我们开展了VASN蛋白生物学功能的初步探索和验证。利用CCK-8法和Transwell实验分别对比分析了VASN稳定敲除细胞株和野生型HepG2细胞间在增殖和迁移能力上的差异,结果显示缺失VASN蛋白可导致细胞增殖、迁移能力减弱,与已有研究结果相符,也进一步证明VASN缺失细胞株构建成功。这为深入阐释VASN的生物学功能及其分子机制奠定了基础。
[1] Malapeira J,Esselens C,Bech-Serra J J,et al.AD⁃AM17(TACE)regulates TGF-β signaling through the cleavage of vasorin[J].Oncogene,2010,30:1912-1922.
[2] Moon P G,Lee J E,You S,et al.Proteomic analysis of urinary exosomes from patients of early IgA ne⁃phropathy and thin basement membrane nephropathy[J]. Proteomics,2011,11(12):2459-2475.
[3] Ikeda Y,Imai Y,Kumagai H,et al.Vasorin,a trans⁃forming growth factor-β binding protein expressed in vascular smooth muscle cells,modulates the arterial re⁃ sponse to injury in vivo[J].Proc Natl Acad Sci USA, 2004,101(29):10732-10737.
[4] Li S,Li H,Yang X,et al.Vasorin is a potential se⁃rum biomarkerand drug targetofhepatocarcinoma screened by subtractive-EMSA-SELEX to clinic pa⁃tient serum[J].Oncotarget,2015,6(12):10045-10059.
[5] Huang A,Dong J,Li S,et al.Exosomal transfer of va⁃sorin expressed in hepatocellular carcinoma cells pro⁃motes migration of human umbilical vein endothelial cells[J].Int J Biol Sci,2015,11(8):961-969.
[6] Han J Q,Wroblewski G,Xu Z,et al.Sensitivity of hepatitis C virus RNA to the antiviral enzyme ribonu⁃clease L is determined by a subset of efficient cleav⁃agesites[J].JInterferon CytokineRes,2004,24(11): 664-676.
[7] Jinek M,Chylinski K,Fonfara I,et al.A programma⁃ble dual-RNA-guided DNA endonuclease in adaptive bacterial immunity[J].Science,2012,337(6096):816-821. [8] Li K,Wang G,Andersen T,et al.Optimization of ge⁃nomeengineeringapproacheswiththeCRISPR/Cas9 system[J].PloS One,2014,9(8):e105779.
[9] Trevino A E,Zhang F.Genome editing using Cas9 nickases[J].Methods Enzymol,2014,546:161-174.
[10]Sasaki H,Yoshida K,Hozume A,et al.CRISPR/Cas9-mediated gene knockout in the ascidian Ciona intesti⁃nalis[J].Dev Growth Differ,2014,56(7):499-510.

