实验室硫酸铜制备的绿色化改进
张洪香,王洪玲,李晓亚
(沧州师范学院 化学与化工学院,河北 沧州 061001)
绿色化学实验从源头上减少、阻止污染,从而保护我们的环境,但是实验过程中新产物的生成不可必免地伴随着污染物的产生,因此实验试剂的选用和实验方法的设计尤为重要[1].五水合硫酸铜的实验室制备及表征是高校实验教学中综合性较强的一个实验,其制备方法的改进也是一个重要的实验探究.实验教材中一是以浓硝酸做氧化剂与铜和稀硫酸进行反应[2],实验中热的浓硝酸的挥发和分解,严重污染室内环境;再是加热单质铜为氧化铜与稀硫酸反应[3-4],但是课上同时使用多个喷灯存在安全隐患.本实验方案是利用绿色环保的强氧化剂过氧化氢与铜粉和稀硫酸作用制备五水合硫酸铜[5-6],Cu+H2O2+H2SO4=CuSO4+2H2O依电极电势,反应向右进行完全,该反应在热力学上是可以进行的,且实验过程安全、无有害物质生成,更适合实验教学.用热重分析法测定产品硫酸铜的结晶水数目,采用间接碘量法测定铜离子含量,并用X射线衍射分析法对产品进行定性分析,确定产品的结构.
1 实验
1.1 实验原理
1.1.1五水合硫酸铜的制备
本实验使用绿色氧化剂过氧化氢在稀硫酸溶液中氧化铜粉反应来制备五水合硫酸铜,其反应方程式为:
Cu+H2O2+H2SO4=CuSO4+2H2O
五水合硫酸铜在水中的溶解度随温度变化较大,采用重结晶法,将杂质除去,得到高纯的硫酸铜晶体.
1.1.2产品中结晶水含量的测定
实验采用重量分析法来测定产品中结晶水的含量.所用公式:
(1)
(2)
式中:n(CuSO4)—CuSO4的物质的量,单位:mol;
m—恒重后CuSO4质量,单位:g;
M(CuSO4)—CuSO4的相对分子质量,单位:g/mol;
n(H2O)—H2O的物质的量,单位:mol;
m1—CuSO4·5H2O质量,单位:g;
M(H2O)—H2O的相对分子质量,单位:g/mol.
1.1.3产品中铜离子含量的测定
采用间接碘量法测定产品中Cu2+的含量.
在弱酸性溶液中,Cu2+与过量的KI作用,生成CuI沉淀,同时析出I2;析出的I2可用Na2S2O3标准溶液滴定,以淀粉为指示剂,反应式如下:
2Cu2++4I-=2CuI↓+I2↓
由此计算出铜的含量.
1.1.4X射线衍射分析
X射线可以将晶体看作是空间衍射光栅,当X射线照射到晶体上时,晶体中原子产生的散射波相互干涉,进而产生衍射.而这些衍射波又相互叠加,使得射线强度在某些方向上更强,在其他方向上就相应的减弱了.通过对衍射的结果进行分析,就可以获得晶体的组成.并且X射线衍射符合布拉格公式.本实验采用X射线衍射法测得产品的衍射图谱,并对图谱进行分析,确定产品组成.
1.2 实验内容
1.2.1溶液的配制
Cu2+标准溶液:称取1.5934g铜粉(AR),置于250ml洁净烧杯中,加入约40mL6mol/L的HCl溶液.在摇动下加入30%H2O2至铜粉反应完全.加热将多余的H2O2分解除尽,然后定量转入250ml容量瓶中,加蒸馏水稀释至刻度线,摇匀,从而制得0.1003mol/L Cu2+标准溶液.
0.1mol/L Na2S2O3溶液:称取约25gNa2S2O3·5H2O于洁净的烧杯中,并向其加入350mL新煮沸并冷却的去离子水,再加入约0.1gNa2CO3,搅拌使其完全溶解,继续加去离子水至1L后,搅拌均匀,转移至棕色试剂瓶中,于阴暗处存放4天再进行标定.
1.2.2产品的制备
称取约2g(精确到0.0001g)铜粉(AR)于50mL小烧杯中,向盛有铜粉的烧杯中加入10.0mL1∶3H2SO4,初始温度50℃时,向烧杯中缓慢滴加10%H2O2溶液,磁力搅拌器搅拌,至铜粉反应完全.加热将多余的H2O2分解除尽,趁热过滤,滤液承接至蒸发皿中.水浴加热、浓缩至溶液颜色变深且有晶膜出现,将蒸发皿取出,于冰水中冷却,减压过滤,用少量无水乙醇洗涤晶体,产品转移至表面皿上,室温下凉干称重.将以上制得的粗产品转移至一洁净蒸发皿中,以每克加1.2mL水的比例溶于去离子水中,用重结晶法提纯五水硫酸铜.平行三次实验,取其平均值计算产率.
1.2.3产品的检测
1.2.3.1结晶水含量的测定
水合硫酸铜是一种蓝色晶体,含有结合比较牢固的结晶水,受热时随温度升高按下列反应逐步脱水.最后得到无水硫酸铜为灰白色粉末.
CuSO4·5H2O=CuSO4·3H2O+2H2O
CuSO4·3H2O=CuSO4·H2O+2H2O
CuSO4·H2O=CuSO4+H2O
硫酸铜的分解温度为650℃,为保证五水硫酸铜的五个水全部失去,硫酸铜又不分解,本实验选择的加热温度为260℃-280℃.
取4个洁净的坩埚,放在烘箱中缓慢升温至550℃灼烧半小时后取出放入干燥器中冷却,室温后准确称量.再次将其放入550℃烘箱中继续灼烧10min,干燥冷却后称其质量,两次称量之差小于0.5mg,则坩埚已经恒重,质量记为m0.在坩埚中放入磨细的产品五水硫酸铜,准确称量坩埚和五水硫酸铜的质量为m1.将含有五水硫酸铜的坩埚放入烘箱中,缓慢升温到260℃-280℃,恒温半小时后停止加热,于干燥器中冷却至室温,称量并记录数值.再次将坩埚放入烘箱中于260℃-280℃下加热10min,并转移到干燥器中冷却,称重,恒重后质量记为m.
1.2.3.2铜含量的测定
(1)用移液管移取25.00mL Cu2+标准溶液,转移到250mL洁净干燥的碘量瓶中,加入5.0mL1∶1的HCl溶液和1g左右KI固体,塞紧瓶塞,摇匀,水封,放于暗处5min,待反应完全后,加100.0mL水.用待标定的Na2S2O3滴定至溶液呈淡黄色,滴入适量淀粉指示剂,继续滴定至溶液呈浅蓝色.然后加入100g/L KSCN溶液10.0mL,再继续滴定至溶液的蓝色恰好消失,即为到达滴定终点,记录所用Na2S2O3溶液的体积,并计算硫代硫酸钠溶液的浓度.
(2)准确称取约0.5-0.6g(精确到0.0001g)样品,置于250mL洁净的锥形瓶中,加入5.0mL 1mol/L硫酸和100mL去离子水使其溶解.再加入10.0mL100g/L的KI,立即用Na2S2O3标准溶液滴定至锥形瓶中溶液呈淡黄色后,继续加入2.0mL淀粉指示剂,并滴定至溶液呈浅蓝色,最后加入100g/L KSCN溶液10.0mL,再继续滴定至溶液的蓝色恰好消失,即为终点.平行滴定三份,记录所消耗的Na2S2O3溶液的体积,计算产品中铜的含量.
1.2.3.3晶体结构的检测
通过X射线衍射仪,采用连扫描方式对制得的产物进行XRD分析,扫描速率为0.02,扫描范围在10°-70°.
2 实验结果
2.1 产品产率
准确称取约2g(精确到0.0001g)的铜粉,加入10.0mL1∶3H2SO4溶液,在初始50℃滴加30%过氧化氢进行实验,通过三次平行实验,得出产品产量,并计算产品的平均产率,实验结果见表1.

表1 产品产率
由表1得出产品的平均产率为96.38%.
2.2 产品中结晶水含量
产品的重量分析数据的处理结果,m为恒重后的结果(见表2).
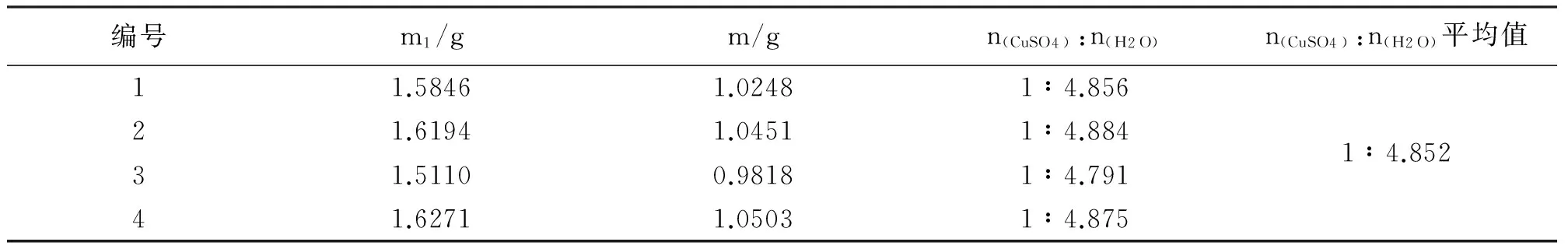
表2 产品重量分析数据的处理
据表2得n(CuSO4)∶n(H2O)=1∶4.852,所以可以得一分子硫酸铜结合五分子水.
2.3 产品中铜含量
用0.1003mol/L Cu2+标准溶液标定Na2S2O3溶液,实验结果见表3.

表3 硫代硫酸钠溶液的标定
准确称取0.5-0.6g五水硫酸铜产品,用0.1063mol/L Na2S2O3溶液滴定,记录所耗体积,计算出产品中铜的含量,实验结果见表4.

表4 产品中铜含量的测定
由表4进行的三次平行滴定,计算出产品中铜含量为25.04%.
2.4 产品的XRD检测结果
采用连扫描方式对产物进行XRD分析,扫描速率为0.02,扫描范围在10°-70°(见图1).
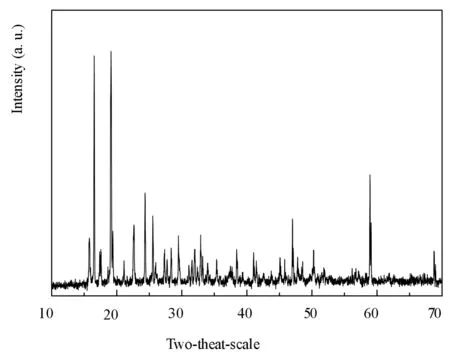
图1 产品的XRD图谱
如图1所示,检测结果与标准卡片对照,产品图谱与标准卡片01-070-18230相一致,表明所制得产品的物相结构为五水合硫酸铜.
3 结论
在初始温度50℃下,用30%双氧水氧化铜粉(AR)和稀硫酸反应,制备五水合硫酸铜.实验制得产品产率达96.38%.通过X射线衍射法,结果表明产品图谱与标准卡片01-070-1823相符,证明产物结构是五水合硫酸铜.采用间接碘量法测得产品中Cu的含量为25.04%.用热重分析法测定产品中含有五个结晶水.此方案制备过程的转化率较高、制得产品产量高、纯度好.本实验的方案设计符合绿色化学理念,首先选用了过氧化氢替代教材中的浓硝酸作氧化剂,能满足氧化能力要求,且它被还原的产物是水,对反应体系来说,不会引入任何杂质离子,也无有毒物质生成,室内环境好,对师生健康无危害.再有制备实验操作简单、便捷,可使学生在规定时间内完成教学任务.此实验设计提高了学生的实验兴趣,提升了同学们的创新意识,并且对无机实验教学有一定的实用价值,可以推广应用到实验教学中.
参考文献:
[1]周宁怀.微型化学实验[J].大学化学,1990,5(5):37-41.
[2]赵新华,张其颖,祝心德,等.化学基础实验[M].北京:高等教育出版社,2009.
[3]林敏.硫酸铜晶体的制备及结晶水含量的测定[J].中学化学教学参考,2009,38(10):43-44.
[4]吴萍,陈维,唐亚文,等.五水硫酸铜晶体制备实验优化条件的探究[J].江苏教育学院学报(自然科学版),2013,30(5):51-52+75.
[5]宋鑫明,刘丹霞,郑彩霞,等.水合硫酸铜制备实验的改进[J].化学教学,2015,37(6):68-69.
[6]纪明中,刘卫华.硫酸铜制备实验的改进[J].化学教学,2006,27(2):6-7.

