亚麻籽环肽混合物抑制霉菌生长繁殖活性
刘尊, 汪勇, MARTIN J T REANEY, FIORENTY OCTAVIA SUGIWAN,NANDA AYU YULISTYANITA,张宁*
1(广东高校油脂生物炼制工程技术研究中心,暨南大学 食品科学与工程系,广东 广州,510632)2(暨南大学 萨斯喀切温大学 “油料生物炼制与营养”联合实验室,广东 广州,510632)3(加拿大萨斯喀切温大学 农业与生物资源学院,加拿大 萨斯卡,S7N5A8)
亚麻又称胡麻,属一年生或多年生草本植物,为我国重要油料经济作物。亚麻籽中含有多种生理活性物质,除了亚麻籽胶和木酚素外,还有一类疏水性环形多肽[1-4]。亚麻籽环肽(flaxseed cyclolinopeptide, FCLPs)主要由异亮氨基酸、亮氨酸、脯氨酸、缬氨酸、苯丙氨酸、色氨酸组成[5]。已从植物、真菌、细菌以及海洋生物中分离得到具有生物活性的环肽[6-8]。相比普通直链小分子肽,环肽的环状结构更具稳定性,高效的抗菌活性以及抗肿瘤、消炎等生理活性[9-12]。亚麻籽环肽A展现了一定的免疫抑制活性[13],亚麻籽环肽B和环肽E也被报道对细胞分裂素具有抑制作用[14-15]。但亚麻籽环肽对霉菌的抑制作用及机理尚未有报道。
据联合国粮食及农业组织(Food and Agriculture Organization, FAO)统计,全球约有25%的粮作物受真菌毒素的污染[16-17]。岳淑丽等[18]研究了桉叶精油对酵母菌、细菌和霉菌的抑菌性能,桉叶精油具有良好的抑菌效果,且抑菌性与伞花烯、柠檬烯和桉叶素等抑菌成分有关。HOU等[19]研究了甘氨酸基本多肽在新鲜湿面的应用和抗真菌特性,结果表明随着甘氨酸基本多肽浓度的提高,对黑曲霉和青霉菌的菌丝生长和孢子萌芽的抑制效果越好。
本文主要通过对宛氏拟青霉和黄曲霉的菌落生长、孢子形成和孢子萌发的抑制作用来评价FCLPs的抗霉菌活性;FCLPs进行经高温灭菌和未加热灭菌不同处理,探究环肽的热稳定性;并初步分析了霉菌培养后,培养基中FCLPs的变化。
1 材料与方法
1.1 材料与试剂
1.1.1试验材料
亚麻籽环肽标准品(环肽A、环肽C、环肽E、环肽D)、亚麻籽环肽混合物(纯度>60%,其余成分主要为脂肪酸),Prairie Tide Chemical Inc.;无水乙醇(分析纯),天津市富宇精细化工有限公司;甲醇(色谱纯),MREDA TECHNOLOGY INC.。
1.1.2培养基及试验菌株
培养基:马铃薯葡萄糖琼脂(potato dextrose agar,PDA), 广州环凯微生物科技有限公司。
试验菌株:宛氏拟青霉(AS 3.776),广东省微生物菌种保藏中心;黄曲霉(CICC 2476),中国工业微生物菌种保藏管理中心。
1.2 仪器与设备
THZ-98A 型恒温振荡箱,上海一恒科技有限公司;HPS-280型生化培养箱,广州万宝特种制冷设备有限公司;高温灭菌锅,广州合众生物科技有限公司;超净台,苏州苏洁净化设备有限公司;HC-2518高速离心机,科大创新股份有限公司;DZF-6020真空干燥机,上海博迅实业有限公司;LC-20AD 高效液相色谱仪,日本岛津公司; Diamonsil C18分析柱(5 μm,150 mm×4.6 mm),迪马公司。
1.3 方法
1.3.1亚麻籽环肽混合物溶液制备
称取亚麻籽环肽混合物粉末溶解于95%的乙醇中,制备得到质量浓度为100 mg/mL的溶液。
1.3.2霉菌孢子悬浮液的配制
将试验菌株接种于PDA斜面培养基上25 ℃培养7 d。量取10 mL无菌水于试管中,然后用无菌接种环轻轻刮下表面孢子,用无菌水稀释,充分振荡摇匀,显微镜计数,使菌悬浮液浓度达106CFU/mL。
1.3.3亚麻籽环肽混合物抑制菌落生长活性测定
分别于121 ℃高温15 min灭菌前、后向PDA平板中添加亚麻籽环肽混合物溶液,使质量浓度梯度为2.4、1.2、0.6、0.3、0.15、0.075 mg/mL。对照组则添加等量等浓度乙醇溶液。用移液枪精确吸取5 μL试验菌种孢子悬浮液在培养基平板上每120°点种,每组重复3次。待菌液风干后,于25 ℃的恒温倒置培养, 48 h或72 h十字交叉法测量菌落直径,取平均值,计算抑制菌落生长活性:

(1)
式中:I为抑制菌落生长活性;d1为对照组菌落直径;d2为亚麻籽环肽组菌落直径。
1.3.4亚麻籽环肽混合物抑制霉菌孢子形成测定
取1.3.3 培养了72 h后的菌落平板,加入10 mL无菌水,用涂布棒将平板上孢子轻刮下来制成孢子悬浮液,孢子悬浮液经过梯度稀释,采用倾注法平板计数,按公式(2)计算孢子形成抑制率,用EXCEL统计软件求出亚麻籽环肽混合物对孢子形成的IC50值。

(2)
式中:I′为孢子形成抑制率;C1为对照组孢子数;C2为亚麻籽环肽组孢子数。
1.3.5亚麻籽环肽混合物抑制霉菌孢子萌芽率
取50 mL的三角瓶加入20 mL的察氏液体培养基,加入适量的亚麻籽环肽混合物溶液配制最终质量浓度为0.6 mg/mL。随后移取适量孢子悬浮液至察氏液体培养基中,置于30 ℃下振荡恒温培养48 h。取1滴培养液于载玻片上后在高倍镜下观察孢子发芽情况,取平均值。乙醇作为对照。按公式(3)计算亚麻籽环肽混合物对孢子萌发的抑制率。

(3)
1.3.6霉菌PDA中环肽的提取
从抑菌试验PDA平板培养物中提取亚麻籽环肽,对比亚麻籽环肽在培养霉菌前后的变化。培养霉菌的PDA平板取0.3 g培养基,转移至2 mL离心管,加入1.4 mL 100%无水乙醇溶液振荡破碎获均匀悬浮液。悬浮液以4 000 r/min,离心10 min,取上清液在真空干燥箱中放置6 h除去乙醇。干燥后样品溶于1 mL色谱纯甲醇,0.45 μL过滤膜过滤后作为高效液相色谱分析样品待用。
1.3.7高效液相色谱分析亚麻籽环肽组分
使用 Diamonsil C18色谱柱(150 mm×4.6 mm, 5 μm); 流动相A为乙腈,流动相B为蒸馏水,柱温为35 ℃,紫外检测波长为214 nm,进样体积为10 μL,采用梯度洗脱,外标法定量。HPLC梯度洗脱程序如下[20]: 0 min,50%A-50%B;0~6 min,50%A-50%B;6~7 min,65%A+35%B;7~19 min,65%A+35%B;19~22 min,66%A+34%B;22~23 min,70%A+30%B;23~24 min,100%A; 24~31 min,50%A-50%B;31~41 min,50%A+50%B。0~23min内,流速均为0.5 mL/min,24~41 min内的流速均为1 mL/min。
2 结果与分析
2.1 亚麻籽环肽混合物对宛氏拟青霉的抑制作用
表1和表2分别为不同质量浓度的FCLPs对宛氏拟青霉的菌落生长和孢子形成的抑制结果。
由表1可知,随着FCLPs的增加,宛氏拟青霉菌落生长和孢子的抑制效果增强,未高温灭菌的FCLPs在质量浓度为1.2 mg/mL时,对菌落生长抑制率I(48.5%)和孢子形成抑制率I′(77.3%)均达最大抑制活性。72 h的抑制率I( 36.0%)相比48 h (48.5%)略有下降,表明培养时间的延长会减弱抑菌效果。FCLPs对宛氏拟青霉孢子形成的抑制率高于对菌落生长的抑制率,推测FCLPs可能抑制了菌丝的分化。经高温灭菌和未高温灭菌的FCLPs对宛氏拟青霉孢子形成的半数抑制浓度IC50值分别为0.53 mg/mL和0.34 mg/mL。相同质量浓度下,高温灭菌后FCLPs对宛氏拟青霉的抑制率I和I′的抑制活性最多分别降低23.2%(0.15 mg/mL)和23.3%(0.6 mg/mL),说明高温处理(121 ℃, 15 min)后的FCLPs仍可保持76.5%左右的抑菌活性。
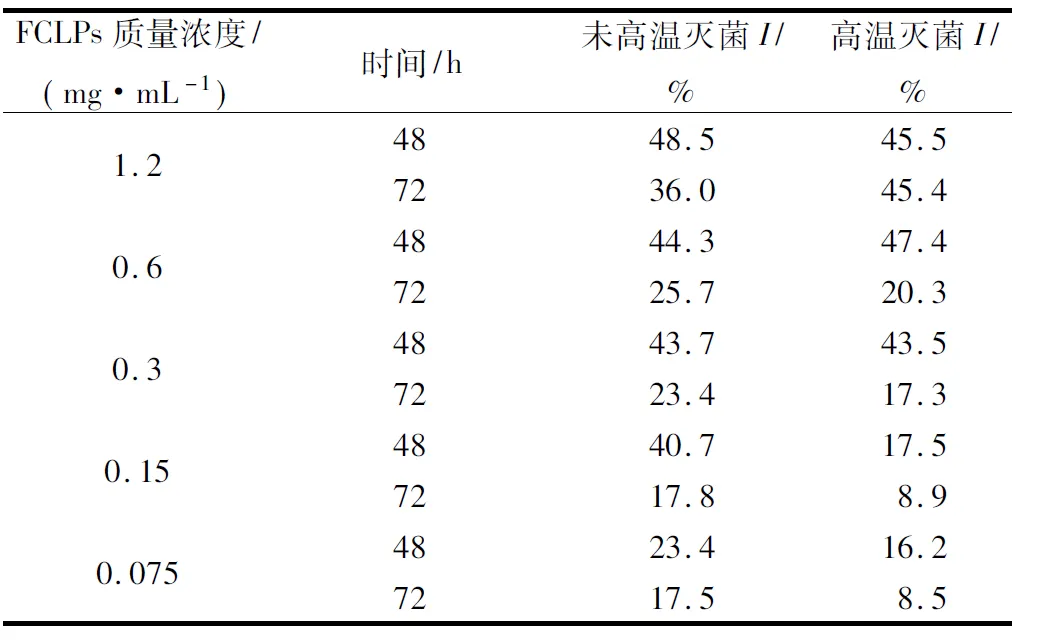
表1 不同质量浓度的亚麻籽环肽混合物对宛氏拟青霉菌落生长的抑制效果Table 1 Inhibition of FCLPs on the radial growth ofPaecilomyces varioti Bainier
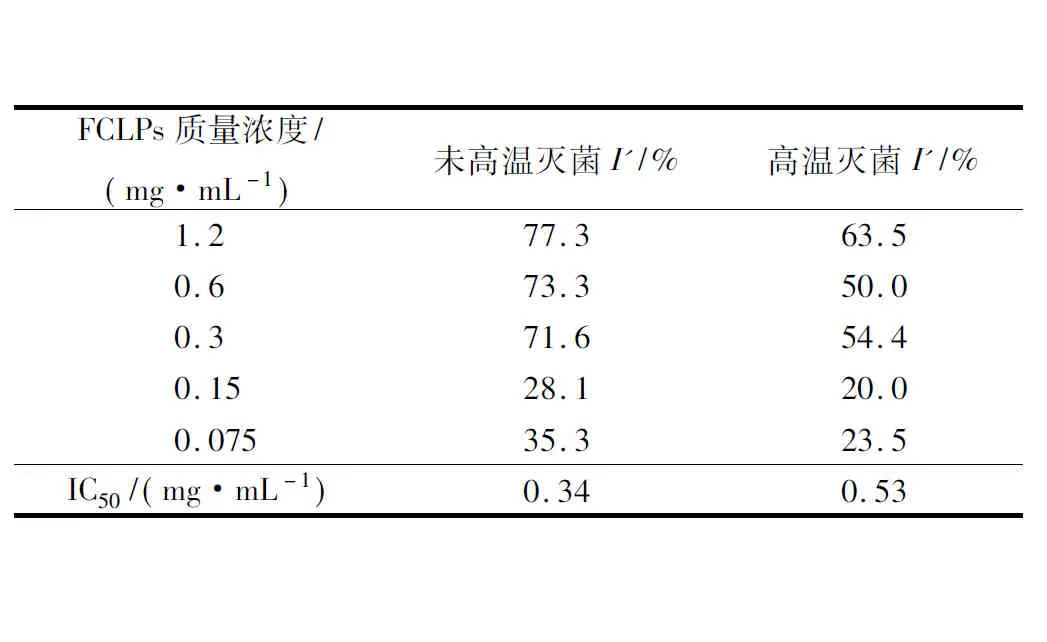
表2 不同质量浓度的亚麻籽环肽混合物对宛氏拟青霉孢子形成的抑制效果Table 2 Inhibition of FCLPs on spores formation ofPaecilomyces varioti Bainier
2.2 亚麻籽环肽混合物对黄曲霉的抑制作用
亚麻籽环肽混合物对黄曲霉菌落生长和孢子形成的抑制作用见表3和4。未高温灭菌的FCLPs对黄曲霉的抑制率I和I′都在2.4 mg/mL时最高,分别为32.9%和86.8%。48 h时抑制活性I(32.9%)高于72h (26.9%),同宛氏拟青霉实验结果一致。经高温灭菌和未高温灭菌的FCLPs对黄曲霉孢子形成的IC50值分别为0.31和0.24 mg/mL。与宛氏拟青霉的抑菌效果相比,FCLPs对黄曲霉的抑制率I远低于宛氏拟青霉,但是抑制率I′略高于宛氏拟青霉。可以推测,FCLPs对宛氏拟青霉和黄曲霉的抑制机理,可能不是抑制营养菌丝体的生长,而是通过抑制气生菌丝体的孢子分化,从而可以解释FCLPs对2株霉菌的孢子生长抑制率要高于对菌落生长的抑制率。高温灭菌处理使FCLPs的抑制活性部分丧失,最低可保持 41.7%(抑制孢子形成)的活性。
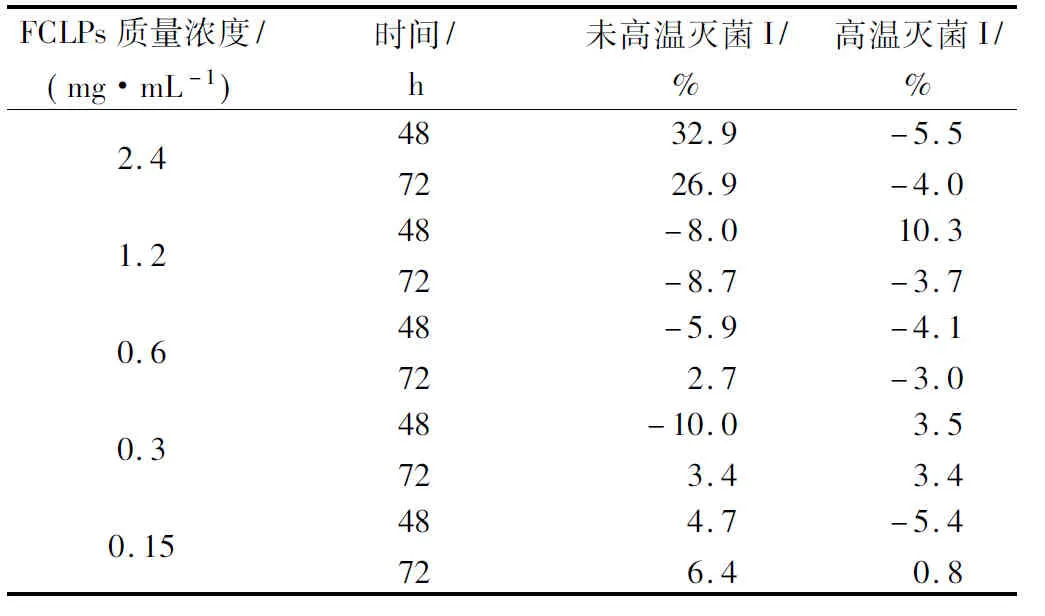
表3 不同质量浓度的亚麻籽环肽混合物对黄曲霉菌落生长的抑制效果Table 3 Inhibition of FCLPs on the radial growth ofAspergillus flavus
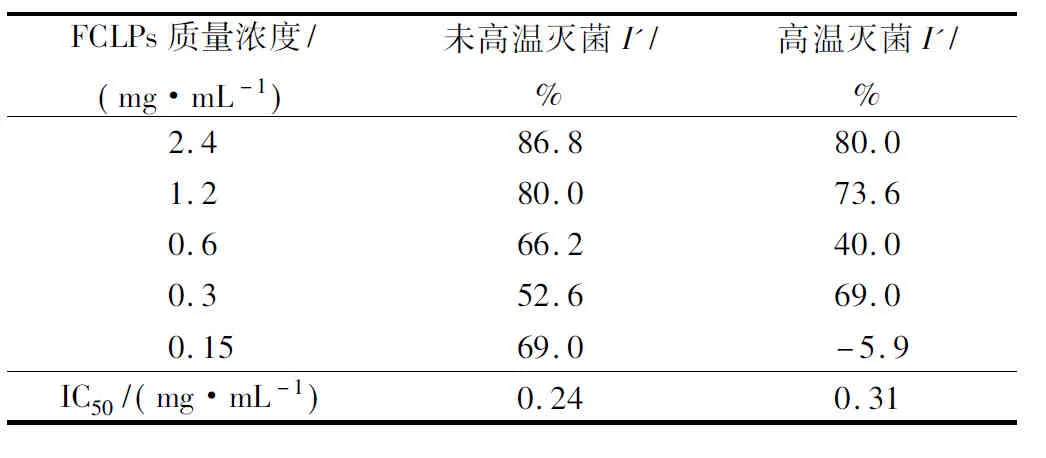
表4 不同质量浓度的亚麻籽环肽混合物对黄曲霉孢子形成的抑制效果Table 4 Inhibition of FCLPs mixtures on spores formationof Aspergillus flavus
2.3 亚麻籽环肽混合物对霉菌孢子萌芽的抑制作用
未高温灭菌的FCLPs(0.6 mg/mL),对宛氏拟青霉和黄曲霉的孢子萌芽的抑制作用结果见表5。相比对照组,FCLPs对宛氏拟青霉和黄曲霉都表现了对霉菌孢子萌芽的抑制效果,平均抑制率分别为8.22%和18.5%,黄曲霉组的孢子萌芽率要明显高于宛氏拟青霉,说明FCLPs对宛氏拟青霉孢子发芽的抑制作用要强于对黄曲霉孢子。
2.4 霉菌培养基中残留环肽的分析
图1为从培养宛氏拟青霉的PDA培养基中提取的FCLPs,图2是从黄曲霉的PDA培养基中提取的FCLPs。参照左洋等[21-22]所做的标准品的HPLC结果,环肽C信号峰的保留时间为15 min左右,随后出峰的是环肽E(19 min左右)、环肽D(20 min左右)、环肽A(27 min左右),其保留时间及出峰顺序与标准样品是基本一致的,结果表明经过霉菌培养后,FCLPs的已知的4种环肽的比例没有发现明显的变化,也没有发现培养基中环肽霉菌代谢物的产生。但是对比高温灭菌和未经高温灭菌的FCLPs,可以看到热处理过后的FCLPs中的4种环肽的峰面积较未经热处理的有所降低,这表明高温热处理降低了环肽C、E、D和A的含量,这可能影响了FCLPs的抑菌活性,这与前面发现的高温处理导致FCLPs的抑菌活性下降的结果是一致。

表5 亚麻籽环肽混合物对霉菌孢子萌芽的抑制作用Table 5 Inhibition of FCLPs against fungal spore germination
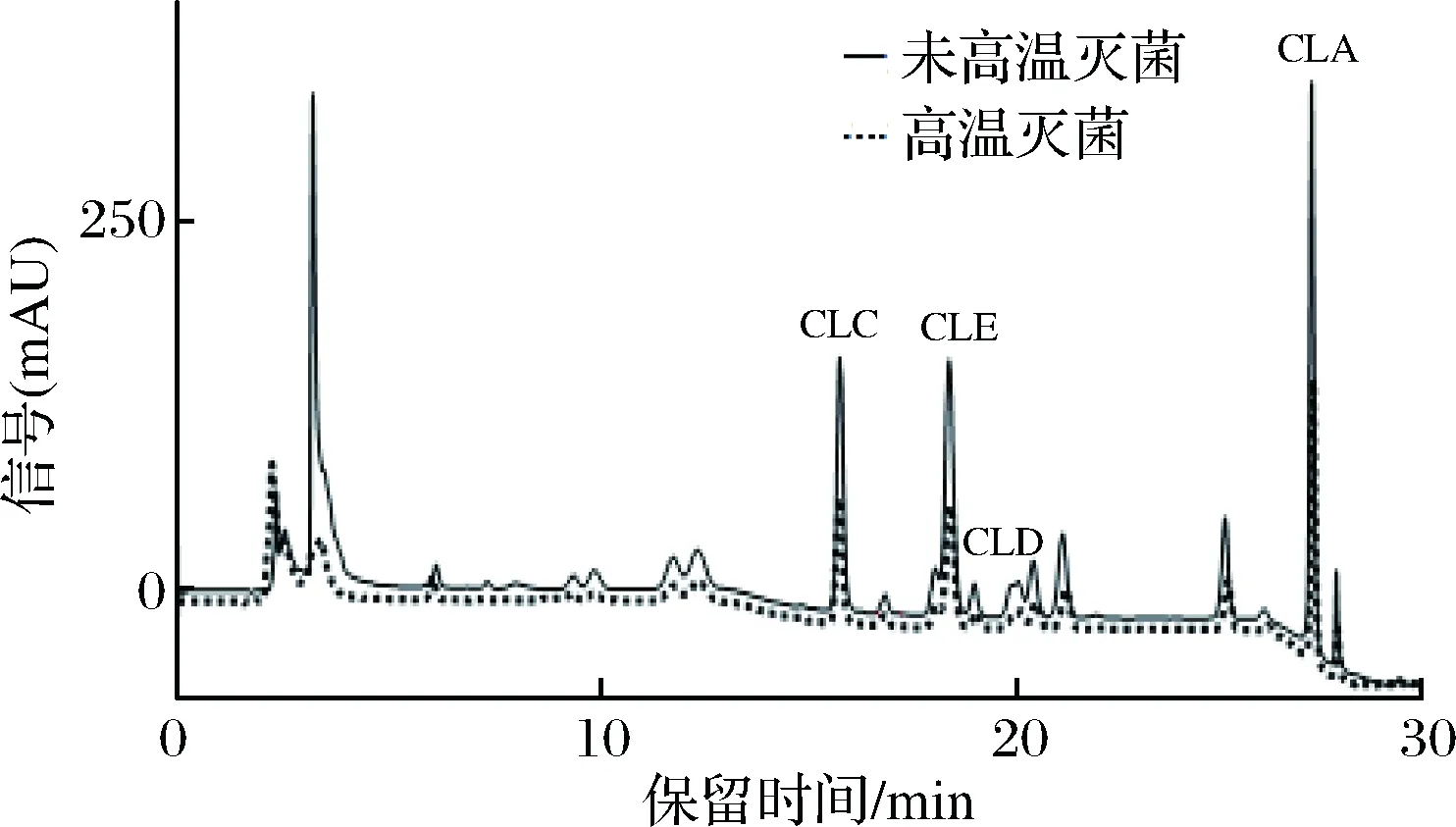
图1 1.2 mg/mL宛氏拟青霉PDA提取亚麻籽环肽(未高温灭菌和高温灭菌)的HPLC谱图Fig.1 HPLC of 1.2 mg/mL FCLPs (not autoclaved andautoclaved) extracted from Paecilomyces variotibainier PDA
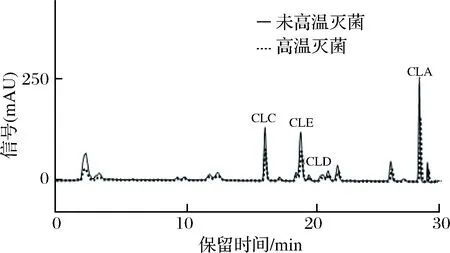
图2 2.4 mg/mL黄曲霉PDA提取亚麻籽环肽(未高温灭菌和高温灭菌)HPLC谱图Fig.2 HPLC of 2.4 mg/mL FCLPs (not autoclaved andautoclaved) extracted from Aspergillus flavus PDA
3 结论
本文选取宛氏拟青霉和黄曲霉2株霉菌作为试验菌株,通过菌落生长直径、孢子计数和孢子萌芽率评价121 ℃高温灭菌前后不同浓度的FCLPs对霉菌的抑制活性。结果表明,FCLPs的抑菌活性随浓度升高而增强,对宛氏拟青霉的抑制活性最高达48.5% (菌落生长)和77.3% (孢子形成);对于黄曲霉,抑制活性最高分别为32.9% (菌落生长)和86.8% (孢子形成)。FCLPs对宛氏拟青霉孢子的IC50值分别为0.53 mg/mL(经高温灭菌)和0.34 mg/mL(未高温灭菌);对黄曲霉孢子的IC50值则分别为0.31 mg/mL(经高温灭菌)和0.24 mg/mL(未高温灭菌)。高温灭菌后FCLPs保持了部分抑菌活性。通过孢子萌芽试验发现,FCLPs对2株霉菌的孢子萌芽都有明显的抑制效果,且对宛氏拟青霉孢子萌芽的抑制率高于对黄曲霉孢子的抑制率。通过高效液相色谱对霉菌PDA培养基中提取的FCLPs的分析,发现对比已知的亚麻籽环肽标准样品图谱,环肽A、C、D和E在霉菌培养前后没有产生新的环肽代谢物,但是高温热处理会降低环肽的含量,从而导致抑菌活性有所减弱。综上所述,FCLPs具有抑制宛氏拟青霉和黄曲霉孢子形成、萌发和菌丝生长活性,高温灭菌后还能保持部分活性,表明其具有良好的热加工适应性,有潜力成为新型天然防腐剂。
[1]BOG Y S, REANRY M J T. Distribution of cyclo-linopeptides in flaxseed fractions and productions[J]. Agriculture Food Chemistry, 2012, 60(35):8 580-8 589.
[2]魏长庆,刘文玉,许程剑.胡麻籽活性成分研究应用进展[J].粮食与油脂,2012,25(4):6-8.
[3]张金.胡麻籽的营养保健价值与产业前景[J].中国食品加工,2006(3):32-34.
[4]孟甜.胡麻油营养分析及应用研究进展[J].粮食与油脂,2015,28(5):5-8.
[5]YOUN Y S, BO G, YONG W, et al. Flaxseed (LinumusitatissimumL) oil pocessing and slected poducts[J]. Trends in Food Science & Technology, 2015,43(2):162-177.
[6]许文彦,赵思蒙,曾广智,等.一些重要天然活性环肽化学和生物活性研究进展[J]. 药学学报, 2012,47(3):271-279.
[7]NETO J X S, PEREIRA M L, OLIVEIRAl J T A, et al. A chitin-binding protein purified from moringa oleifera seeds presents anticandidal activity by increasing cell membrane permeability and reactive oxygen species production[J]. Frontiers in Microbiology, 2017, 8(980):1-12.
[8]KANEDA T, YOSHIDA H,NAKAJIMA Y, et al. AE nugroho cyclolinopeptides, cyclic peptides from flaxseed with osteoclast differentiation inhibitory activity[J]. Bioorganic & Medicinal Chemistry Letters ,2016, 26(7):1 760-1 761.
[9]FELIX A, EWA S, ROMAN P. Flaxseed cyclolinopeptides: analysis and storage stability[J].Journal Amrican Chemistry Socience, 2013,90(3):419-428.
[10]BO G,YOUN Y S, REANEY M J T, et al, Distribution of cyclolinopeptides in flaxseed fractions and products[J]. Agriculture Food & Chenistry, 2012,60(35):8 580-8 589.
[11]GUI B, SHIM Y Y, DATLA R S, et al. Identification and quantification of cyclolinopeptides in five flaxseed cultivars[J]. J Agric Food Chem, 2012, 60(35):8 571-8 579.
[12]SHIM Y Y, GUI B, AMISON P G, et al. Flaxseed (Linumusitatissimum, L.) bioactive compounds and peptide nomenclature: Areview [J]. Trends in Food Science & Technology, 2014, 38(1):5-20.
[13]GUI B, SHIM Y Y, REANEY M J T. Distribution of cyclolinopeptides in flaxseed fractions and products[J]. Journal Agricuture Food Chemisty, 2012, 60(35):8 580-8 589.
[14]BOLESLAW P, MAREK C, JANUSZ Z, et al.Cyclopeptides ofLinumusitatissimum[J]. Journal of Peptide Science an Official Publication of the European Peptide Society.,2006,12(9):569-574.
[15]MORITA H,SHIAHIDO A,MATSUMOTO T, et al. Cyclolinopeptides B-E, new cyclic peptides from linum usitatissimums B-E, new cyclic peptides from linumusitati[J].Tetrahedron,1999,55(4):967-976.
[16]李培武,丁小霞,白艺珍,等.农产品黄曲霉毒素风险评估研究进展[J].中国农业科学,2013,46(12):2 534-2 542.
[17]张楠, 杨勇, 孙霞,等. 肉制品中真菌毒素污染现状与控制研究进展[J]. 食品与发酵工业, 2016, 42(10):243-249.
[18]岳淑丽, 任小玲, 陈霞,等. 桉叶精油包埋前后抑菌性能及成分比较研究[J]. 食品科学, 2017, 38(11):155-159.
[19]HOU J, LI Y Q, WANG Z S, et al. Applicative effect of glycinin basic polypeptide in fresh wet noodles and antifungal characteristics[J]. LWT-Food Science and Technology, 2017, 83(32):267-274.
[20]连莹君,江紫琦,陆学茸,等.HPLC外标法测定亚麻籽油中4种环肽含量的研究[J].中国油脂, 2015, 40(5):90-94.
[21]左洋,陆学茸,滕英来,等.亚麻籽环肽HPLC分析和氧化还原产物研究[J].中国油脂, 2015,40(8):32-36.
[22]OLIVIA C M, BURNETT P G, OKINYO-OWITI D P, et al. Rapid reversed-phase liquid chromatography separation of cyclolinopeptides with monolithic and microparticulate columns[J]. J Chromatogr B Anlyt Technol Biomed Life Sci, 2012, 904(9):128-134.

