个体化剂量长方案降调节在IVF-ET中的应用
龙惠东,邓伟芬,王凤
(深圳武警医院生殖中心,深圳 518000)
体外受精-胚胎移植(IVF-ET)技术发展至今,促排卵方案已呈现多元化的局面,包括长效长方案、短效长方案、拮抗剂方案、微刺激方案、黄体期促排等,以期在不同的人群中应用达到最佳的促排效果及成本效益(cost-effective)。经典的长效长方案因其应用方便、卵泡发育同步性好、周期取消率低等优点,目前仍是应用最为广泛的方案。促性腺激素释放激素激动剂(GnRH-a)有不同的药物剂型、用药途径及用药方案,使周期启动更灵活。短效剂型(0.1 mg)需患者每天注射以维持有效的药物浓度,治疗麻烦且费用较高;长效制剂使用更方便有效。长效GnRH-a的标准计量为3.75 mg,这一设计主要用于治疗子宫内膜异位症、激素依赖型癌症及子宫肌瘤[1],但在辅助生殖治疗中使用全量甚至半量(1.85 mg)都会显著增加促性腺激素(Gn)的用药时间及剂量,影响临床妊娠结局,增加患者的经济及心理负担。长效GnRH-a根据其使用剂量的不同,临床应用方案多元化,各种不同剂量的降调节方案在不同人群是否都能达到理想的妊娠结局有待进一步评估。本文通过回顾性分析本中心2015年1~12月不同剂量降调节方案的周期参数,评估个体化剂量长方案降调节的有效性。
资料与方法
一、研究对象
选择2015年1~12月在本院生殖中心进行IVF-ET治疗的不孕不育症夫妇为研究对象,共3 639个周期。纳入标准:女性患者年龄≤40岁,基础窦卵泡数(AFC)>5个,抗苗勒管激素(AMH)>1.1 ng/ml。不育原因包括输卵管因素、男方因素、盆腔粘连、子宫内膜异位症、排卵障碍及不明原因不育等。排除标准:以博洛尼亚标准诊断为卵巢低反应患者。
二、促排方案
根据患者的年龄、卵巢储备功能、体重指数(BMI)和既往促排历史,按照临床经验选择降调剂量。AFC≤10个者予低剂量(0.5~1.1 mg)降调节,结合患者AFC、AMH及BMI给予降调剂量:AFC 5~6个、AMH 1.1~1.5 ng/ml者予0.50~0.70 mg;AFC 7~8个、AMH 1.6~2.5 ng/ml者予0.75~0.80 mg;AFC 9~10个、AMH 2.5~3.5 ng/ml者予0.90~1.10 mg;正常反应者(AFC>10个,AMH>3.5 ng/ml)及高反应人群(AFC>30个,AMH>15 ng/ml)予常规剂量(1.25~1.40 mg)降调节;既往常规剂量降调不全(启动日窦卵泡直径>5 mm,FSH、LH、E2达不到降调标准)或轻度子宫内膜异位症者予1.80~2.50 mg;或合并中重度子宫内膜异位症者或腺肌症者予3.75 mg降调节,以上分组根据BMI具体稍做调整。黄体中期使用长效GnRH-a(达菲林,Triptorelin,博福-益普生,法国)肌肉注射进行垂体降调节。根据GnRH-a剂量的不同分为:A组(41个周期)0.50~0.75 mg,B组(589个周期)0.75~0.80 mg,C组(64个周期)0.90~1.10 mg,D组(2 873个周期)1.25~1.40 mg,E组(41个周期)1.80~2.50 mg,F组(31个周期)3.75 mg。A~D组患者降调后14~16 d回诊,E~F组降调后25~28 d回诊,达到降调标准后开始使用FSH(果纳芬,默克-雪兰诺,德国)100~300 U/d诱导卵泡发育。理想的降调标准为FSH<5 U/L、LH<5 U/L、E2<183 pmol/L、窦卵泡直径均≤5 mm、子宫内膜厚度≤5 mm、孕酮(P)<2.54 nmol/L。促排卵过程采用阴道超声检查和血清激素水平监测,当2~3个主导卵泡径线≥18 mm,当晚20~21时予HCG 6 000~10 000 U肌肉注射扳机,36 h后取卵。
三、IVF-ET
取卵后进行体外培养和授精,男方严重少弱精症者行卵胞浆内单精子注射(ICSI)受精,取卵后48~72 h进行ET。获卵数≥20个或HCG日P>4.76 nmol/L或E2水平连续两天>14 640 pmol/L时采取全胚冷冻,取消鲜胚移植。取卵后第2次月经第3天视卵巢恢复情况安排冻融胚胎移植(FET)。移植后采用HCG 2 000 U隔日肌肉注射或黄体酮40 mg每日肌肉注射或阴道栓剂行黄体支持。移植胚胎后第14天测定血清β-HCG,第30天进行阴道超声检查,B超显示有孕囊和胎心搏动者确定为临床妊娠。
四、观察指标
降调节后启动日及HCG日测定血清LH、E2、P水平,血清性激素水平检测采用美国贝克曼全自动化学发光免疫分析仪。统计HCG注射日Gn总用量、获卵数、MⅡ卵母细胞数(以ICSI周期为准)、正常受精率(2PN数/IVF获卵数或ICSI的MⅡ数)、卵裂率、可利用胚胎率及优胚率。统计取卵后首次移植的临床妊娠率、流产率、着床率及活产率,妊娠率=妊娠周期数/移植周期数×100%,流产率=流产数/妊娠周期数×100%,活产率=活产周期数/移植周期数×100%。
五、统计学处理
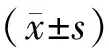
结 果
一、各方案组患者基本情况比较
A组患者年龄显著高于其余各组(P<0.05),A组及B组的AMH值显著低于其余各组(P<0.05),A组、B组及C组AFC数显著低于其余各组(P<0.05),A组及B组基础FSH水平显著高于D组及F组(P<0.05),D组及E组LH水平显著高于A、B、C组(P<0.05)。不育年限、BMI、基础E2水平在各组间无显著差异(P>0.05)(表1)。

表1 各组患者基本情况及血清激素水平比较(-±s)
注:与其余各组比较,aP<0.05;与D、F组比较,bP<0.005;与A、B、C组比较,cP<0.05
二、各组降调节程度及Gn用量比较
启动日各组激素水平无显著差异(P>0.05)。HCG日LH水平A组及B组显著高于D组及E组,HCG日E2水平D组显著高于A组、B组及C组,HCG日P水平D组显著高于B组(P<0.05)。Gn总用量各组间无显著性差异(P>0.05)(表2)。
三、各组患者IVF-ET周期实验室情况比较
A组、B组及C组获卵数显著少于其余3组(P<0.05);ICSI的MⅡ卵母细胞率各组间比较无显著性差异(P>0.05);IVF-2PN率E组显著低于B组、C组及D组(P<0.05);可利用胚胎率F组显著低于其余各组(P<0.05);ICSI-2PN率、卵裂率及优胚率在各组间无显著差异(P>0.05)(表3)。
四、各组妊娠结局比较
全胚冷冻率D组显著高于B组及C组(P<0.005);首次移植临床妊娠率B组显著低于D组(P<0.005);着床率D组及F组显著高于A组及B组(P<0.05);活产率B组显著低于C组及D组,E组显著低于C组(P<0.05);平均移植胚胎数及流产率在各组间无显著差异(P>0.05)(表4)。

表2 各组降调情况与Gn使用量比较(-±s)
注:与D、E组比较,aP<0.005;与D组比较,bP<0.005

表3 各方案组患者IVF-ET周期实验室情况比较 [(-±s),%]
注:与D、E、F组比较,aP<0.05;与B、C、D组比较,bP<0.05;与其余各组比较,cP<0.05

表4 各方案组患者IVF-ET周期妊娠结局比较 [(-±s),%]
注:与B、C组比较,aP<0.005;与D组比较,bP<0.005;与A、B组比较,cP<0.05;与C、D组比较,dP<0.05;与C组比较,eP<0.05
讨 论
GnRH-a是具有很强生物活性的九肽化合物,与垂体前叶腺体的GnRH受体有很高的亲和力,具有较长的半衰期,结合后可刺激分泌FSH及LH“一过性升高”(“flare up”)效应,持续作用7~10 d后会引起GnRH受体减少,进而内源性的GnRH不能再刺激产生FSH及LH,随着时间的延长,FSH、LH降至基础值以下,呈药物去垂体状态,卵巢内卵泡停止生长和发育,体内的雌激素水平处于卵泡早期甚至达绝经期水平,实现降调节[2]。自1984年Porter等[3]首次引入GnRH-a用于IVF-ET以来,GnRH-a一直被广泛应用于垂体降调节-卵巢促排卵中。早期曾提出半量的GnRH-a足以抑制早熟内源性LH峰,降低周期取消率,改善卵巢反应[4]。随着现今IVF-ET技术的发展,发现降调节方案的应用可以多元化,在不同人群应用不同剂量的降调节,加上恰到好处的促排用药,可实现良好的妊娠结局。理想的降调节是个体化应用GnRH-a制剂,使垂体脱敏,既可抑制LH峰的早发,但又不过度抑制卵巢对Gn的反应,以获得优质的卵母细胞、胚胎和良好的妊娠结局。本文通过综合评估患者的年龄、BMI、AFC、基础FSH水平及既往促排历史,给予不同人群不同剂量的降调方案,结果显示均能获得理想的降调节状态,结果与张学红等[5]报导的结论相似。
由于降调节有剂量依赖性和时间依赖性,大剂量的GnRH-a对下丘脑和垂体产生过度抑制,导致卵巢低反应及增加Gn用量,过低剂量的GnRH-a又会出现降调不全导致早发LH峰出现,影响妊娠结局[6]。早在1996年Broekmans等[7]探讨了GnRH-a降调节的剂量效应,发现降调的剂量依赖性主要以LH表现明显,FSH无剂量依赖性。本文发现,基础LH在高反应人群(D、E组)中更高,而HCG日的LH水平在A、B组反而更高,提示跟降调剂量有关。促排期间LH的水平过低会影响卵泡发育、卵母细胞质量及受精率[8];LH还可直接作用于子宫内膜LH受体,支持内膜的发育[9],LH过低会降低子宫内膜的容受性,所以LH对于促排期间卵泡正常发育和内膜容受性都至关重要[10],卵泡期稍高的LH水平对高龄或低卵巢储备患者可能更有利。因此,寻找合适剂量的个体化的降调剂量对提高IVF-ET的妊娠率至关重要。
李洁等[11]曾报导0.375 mg低剂量的降调会出现降调不全而出现早发LH峰案例。因此本中心最低剂量降调是0.5 mg(A组),用于高龄或窦卵泡数较少的患者,未发现有早发LH峰现象。A、B、C组的获卵数显著减少,通过年龄、AMH、AFC及基础FSH的数据反映出是由于自身卵巢储备下降所致。A、B组的临床妊娠结局稍差于其他组特别是D组,分析原因与该组患者年龄增大及卵母细胞质量下降有关。大剂量降调可使子宫内膜异位症患者的盆腔内环境得以改善,有利于改善卵母细胞质量及子宫内膜容受性,但F组的获卵数及着床率与D组相当而可利用胚胎率却低于D组,E组的活产率也低于C组,其原因可能是因子宫内膜异位症所致。张雯碧等[12]报导子宫内膜异位症主要通过影响卵母细胞质量间接影响胚胎质量,与卵母细胞的线粒体结构异常及线粒体数量减少、DNA复制减少、卵母细胞质量下降有关,可能与卵母细胞发育的微环境(卵泡液)氧化应激反应相关;郭艺红等[13]报导应根据不同类型内膜异位症特点制定不同方案,提示子宫内膜异位症人群可能需要更加细化的降调方案或连续多次降调节,而本文纳入对象仅为一次降调的患者。常规剂量1.25~1.40 mg方案适用人群最广,常用于卵巢储备正常或者储备高的多囊卵巢综合征(PCOS)患者,D组的实验室结果及临床结局都较理想,但全胚冷冻率偏高,主要由于获卵数较多,HCG日的E2及P水平更高,特别是PCOS患者。Chen等[14]报导PCOS患者冻胚移植的妊娠结局比鲜胚移植更佳,提示全胚冷冻及后期冻胚移植可能是高反应人群获得理想妊娠的更佳治疗方案。促排期间的Gn用量与卵母细胞的发育潜能及子宫内膜容受性的关系最近也开始受到关注。有文献报道过高的Gn量会导致活产率下降[15-16]。本文统计发现,通过使用不同剂量的降调节方案可避免垂体性腺抑制过深,减少促排时Gn的用量,各组间Gn的总量并无显著性差异,从而有利于改善临床结局。本研究中各组间的MⅡ率、卵裂率、优胚率、流产率均无统计学差异,说明根据患者的卵巢反应给予不同的降调剂量,可达到垂体降调节,又无过度抑制卵巢功能,是值得选择的一种降调节方式。而结果中活产率有所不同,一方面可能与纳入人群的偏移有关,另一方面卵巢功能稍差的患者其临床结局可能受到一定的影响。
综上所述,不同的患者个体情况各异,对GnRH-a的反应性也不尽一致。灵活应用个体化剂量的长方案降调节既可以有效抑制早发LH峰,又能在不同反应人群达到理想的降调水平,获得较好的妊娠结局。
【参考文献】
[1]张翔,郑伟. GnRHa治疗子宫内膜异位症的研究进展[J].国际妇产科学杂志,2005,32:243-246.
[2]周灿权,钟依平.促性腺激素释放激素激动剂的临床应用[J].中国实用妇科与产科杂志,1999,15:754-756.
[3]Porter RN,Smith W,Craft IL,et al. Induction of ovulation for in-vitro fertilization using buserelin and gonadotropins[J].Lancet,1984,2:1284-1285.
[4]Dal Prato L,Borini A,Coticchio G,et al. Half-dose depot triporelin in pituitary suppression for multiple ovarian stimulation in assisted reproduction technology:a randomized study[J].Hum Reprod,2004,19:2200-2205.
[5]张学红,李丽斐,赵丽辉,等. 应用不同剂量长效GnRH-a(达菲林)降调节的临床效果分析[J].生殖与避孕,2005,25:435-437.
[6]Balasch J,Gómez F,Casamitjana R,et al. Pituitary-ovarian suppression by the standard and half-doses of D-Trp-6-luteinizing hormone-releasing hormone depot[J].Hum Reprod, 1992,7:1230-1234.
[7]Broekmans FJ,Hompes PG,Lambalk CB,et al. Short term pituitary desensitization:effect of different doses of the gonadotrophin-releasing hormone agonist triptorelin[J].Hum Reprod,1996,11:55-60.
[8]Fleming R,Lloyd F,Herbert M,et al. Effects of profound suppression of luteinizing hormone during ovarian stimulation on follicular activity,oocyte and embryo function in cycles stimulated with purified follicle stimulating hormone[J].Hum Reprod,1998,13:1788-1792.
[9]杨婷,李丽斐. 促性腺激素释放激素激动剂对子宫内膜容受性的调控[J].国际生殖健康/计划生育杂志,2012,31:479-483.
[10]Wiesak T. Role of LH in controlled ovarian stimulation[J].Reprod Biol,2002,2:215-227.
[11]李洁,詹雪君,高军,等. 在IVF-ET中低剂量长效GnRH-a与短效GnRH-a长方案降调节的评价[J].生殖医学杂志,2015,24:828-833.
[12]张雯碧,徐丛剑. 子宫内膜异位症对胚胎和子宫内膜的影响[J].中国计划生育和妇产科,2017,9:1-3.
[13]郭艺红,孙莹璞. 不同类型子宫内膜异位症降调节方案及、Gn启动时间、剂量[J].生殖医学杂志,2015,24:820-824.
[14]Chen ZJ,Shi Y,Sun Y,et al. Fresh versus frozen embryos for infertility in the polycystic ovary syndrome[J].N Engl J Med,2016,11:523-533.
[15]Munch EM,Sparks AE,Zimmerman MB,et al. High FSH dosing is associated with reduced live birth rate in fresh but not subsequent frozen embryo transfers[J].Hum Reprod,2017,32:1402-1409.
[16]Baker VL,Brown MB,Luke B,et al. Gonadotrophin dose is negatively correlated with live birth rate:analysis of more than 650,000 assisted reproductive technology cycles[J].Fertil Steril,2015,104:1145-1152.

