猪轮状病毒TaqMan实时荧光定量RT-PCR方法的建立
陈如敬, 章秋月, 陈秋勇, 修金生, 吴学敏, 严 山, 周伦江
(1.福建省农业科学院畜牧兽医研究所/福建省畜禽疫病防治工程技术研究中心,福建 福州 350013;2.南平市星星畜牧有限公司,福建 南平 363000;3.福建农林大学动物科学学院,福建 福州 350002)
猪轮状病毒(porcine rotavirus, PoRV)属呼肠孤病毒科(Reoviridae)轮状病毒属(Rotavirus),该病原是导致仔猪或其他幼龄动物(包括婴幼儿)腹泻的主要病原之一.不同日龄仔猪(10~60日龄)均易感,表现为厌食、腹泻、呕吐和水样粪便,严重时可导致动物因脱水死亡[1-2].
PoRV为不连续的双链RNA(dsRNA)、二十面体对称的无囊膜结构病毒,其直径约为70 nm.PoRV中央为致密的六角形核芯,直径约为40 nm.检测PoRV感染的常见方法有RT-PCR方法[3]、SYBR GreenⅠ实时荧光定量RT-PCR方法[4]和基于单克隆抗体的免疫荧光技术[5]等.但RT-PCR检测方法存在敏感性不高的问题;SYBR GreenⅠ实时荧光定量RT-PCR方法可能存在非特异性扩增及受引物二聚体等的影响而导致假阳性结果[6];而基于单克隆抗体的免疫荧光技术由于单克隆抗体仅识别单一抗原表位,可能对部分PoRV毒株检测出假阴性结果.
PoRV主要外层衣壳为VP4和VP7,中间为VP6,内层为VP2[7-9].结构蛋白VP6是PoRV基因组的核心蛋白,其占病毒蛋白的50%左右.VP6不像结构蛋白VP4和VP7那样具有较强的抗原性和免疫性,且研究证实VP6蛋白没有中和轮状病毒的血清学抗体活性[10-12].但VP6基因是参与介导轮状病毒粘膜免疫学反应的特异性抗原[13-14],具有较强的诊断学意义和疫苗开发价值[15-17].本试验根据VP6基因序列特征,建立检测PoRV TaqMan 探针的实时荧光定量RT-PCR方法,该方法较SYBR GreenⅠ染料法特异性强,其荧光信号只来源于目标序列,不受非特异性扩增及引物二聚体的影响,为开展PoRV的流行病学调查及感染水平的定量分析提供新的检测手段.
1 材料与方法
1.1 材料
1.1.1毒株PoRV、猪流行性腹泻病毒(porcine epidemic diarrhea virus, PEDV)、猪传染性胃肠炎病毒(transmissible gastroenteritis virus, TGEV)、猪瘟病毒(classical swine fever virus, CSFV)和猪流行性乙型脑炎病毒(Japanese encephalitis virus, JEV)均由福建省农业科学院畜牧兽医研究所分离、鉴定并保存.
1.1.2主要仪器与试剂Premix Ex TaqTM(Probe qPCR)、One Step PrimeScriptTMRT-PCR Kit (Perfect Real Time)、MiniBEST Viral RNA/DNA Extraction Kit Ver.4.0、PrimeScriptTMOne Step RT-PCR Kit Ver.2 (Dye Plus)、pMD18-T和DL2000 Marker均购自宝生物工程(大连)有限公司,胶回收试剂盒、质粒小量抽提试剂盒和克隆感受态细胞均购自天根生化科技(北京)有限公司,其他试剂均为商业公司购买的分析纯.
1.2 阳性标准品的制备
采用病毒提取试剂盒MiniBEST Viral RNA/DNA Extraction Kit Ver.4.0,按照说明书操作提取PoRV(RV-FJ2014-01株)的RNA,用针对PoRVVP6基因的特异性引物(VP6F:5′-TCTTCGACATGGAGGTTCTGTA-3′,VP6R1289:5′-GAAATCACACCCTTACTTGTAGA-3′,预期扩增片段长度约1 289 bp)获得VP6基因全长.RT-PCR扩增体系为50 μL体系,配置如下:2 μL PrimeScript One Step Enzyme Mix、25 μL 2×One Step Buffer(Dye Plus)、上/下游引物(VP6F和VP6R1289,浓度为20 μmol·L-1)各1 μL、2 μL提取RNA,补充灭菌去离子水至终体积为50 μL.RT-PCR反应条件为:50 ℃反转录30 min; 94 ℃预变性5 min后进行PCR循环(共循环35次),条件为:94 ℃变性50 s、53 ℃退火30 s、72 ℃延伸80 s;PCR循环结束后,于72 ℃再延伸10 min.对目的片段使用胶回收试剂盒切胶回收后克隆到T载体上,提取相应的质粒,经序列测定验证符合试验预期后的质粒作为本试验的阳性标准品质粒(记为PoRV-VP6).将获得的阳性标准品用超微量紫外可见分光光度计对阳性质粒进行定量,计算拷贝数并进行10倍连续稀释,置于-20 ℃冰箱中保存备用.
1.3 TaqMan实时荧光 RT-PCR方法的建立
1.3.1荧光定量引物的设计参考GenBank中登陆的PoRVVP6基因特征,利用DNAStar软件进行分析比较,明确VP6基因保守区,利用Oligo 7软件,设计特异性的引物和探针.采用BLAST工具进行检索,初步验证其特异性,引物由宝生物工程(大连)有限公司合成.pF1:5′-GACCACCAAATATGACAC-3′;pR1:5′-GTCCTACTGGTATAGCATA-3′.探针序列pTaqMan-probe:5′-CCGCAAGCACCACCATTCAT-3′,其中, 5′端以FAM标记,3′端以Eclipse标记.
1.3.2反应条件的优化采用Premix Ex TaqTM(Probe qPCR)试剂盒说明书推荐的条件,配置TaqMan实时荧光定量RT-PCR方法的反应液.以出现最高的荧光值(△Rn)、最小的循环阈值(Ct)为指标,对退火温度(56~64 ℃)、引物终浓度(0.1~1 μmol·L-1)和探针终浓度(0.05~0.5 μmol·L-1)进行条件优化.
1.3.3标准曲线的建立以阳性标准品连续10倍系列稀释(10-2~10-8)的质粒为模板,以“1.3.2”的优化后条件进行扩增,获得扩增动力学曲线.以不同浓度标准品(PoRV-VP6质粒)拷贝数的常用对数为横坐标,以Ct为纵坐标,推导计算出标准线性回归方程,建立标准曲线.
1.3.4特异性检测用“1.3.2”的优化后条件分别检测PoRV、PEDV、TGEV、CSFV和JEV的RNA,评价所建立的实时荧光定量RT-PCR方法的特异性.
1.3.5可重复性与再现性评估将阳性标准质粒(PoRV-VP6)设3个重复,用“1.3.2”的优化后条件进行检测,计算组内变异系数;将阳性标准质粒置-20 ℃冰箱中保存.每隔两周重检一次,连续检测3次,计算组间变异系数.
1.4 临床样品的检测
对福建地区收集的79份仔猪腹泻病料按照常规方法处理后,利用病毒提取试剂盒提取其相应的RNA后,分别用本试验建立的TaqMan实时荧光定量 RT-PCR方法和文献报道的RT-PCR方法[3]进行检测,评价两种方法之间的符合率.
2 结果与分析
2.1 优化后的TaqMan实时荧光定量RT-PCR检测条件
优化后TaqMan实时荧光定量RT-PCR检测条件为: 95 ℃变性10 s,60 ℃退火/延伸20 s,循环40次.优化后的20 μL最佳反应体系为:10 μL Premix Ex Taq(Probe qPCR)(2×)、上/下游引物(5 μmol·L-1)各0.3 μL、0.6 μL探针(10 μmol·L-1)、2 μL待检样品核酸, 补充灭菌去离子水至终体积为20 μL.
2.2 TaqMan实时荧光定量RT-PCR方法的动力学扩增曲线和标准曲线
基于TaqMan实时荧光定量PCR方法检测PoRVVP6基因在1.92×102~1.92×108拷贝·μL-1有很好的线性关系,检测的最低值为1.92×102拷贝·μL-1.所获得标准曲线线性方程为:y=-3.248x+39.453,相关系数(R2)为0.999.获得的动力学扩增曲线见图1,推导的标准曲线见图2.
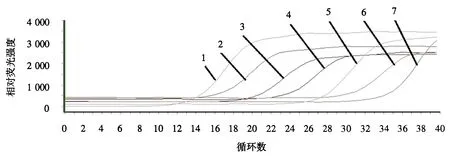
1-7:标准品质粒浓度分别为1.92×108、1.92×107、1.92×106、1.92×105、1.92×104、1.92×103和1.92×102拷贝·μL-1.图1 TaqMan实时荧光定量RT-PCR的动力学扩增曲线Fig.1 The kinetic curve for TaqMan based real-time PCR method
2.3 TaqMan实时荧光定量RT-PCR方法的特异性

图2 TaqMan实时荧光定量RT-PCR的标准曲线Fig.2 The standard curve for TaqMan based real-time PCR method
建立的基于TaqMan实时荧光定量RT-PCR方法仅对PoRV扩增出阳性信号,对猪常见病原(如PEDV、TGEV、CSFV和JEV)均未检测到扩增信号(图3).
2.4 TaqMan实时荧光定量RT-PCR方法的重复性与再现性
建立的基于TaqMan实时荧光定量PCR方法检测阳性标准品的组内变异系数为0.25%~1.26%,组间变异系数0.31%~1.49%(表1).

阴性对照(PEDV、TGEV、CSFV和JEV)未见阳性扩增信号,肉眼难以区分.图3 TaqMan实时荧光定量RT-PCR的特异性Fig.3 The specificity for TaqMan based real-time PCR method

标准品质粒浓度拷贝·μL-1组内变异系数CtSDCV/%组间变异系数CtSDCV/%1.92×10812.520.080.6012.550.090.741.92×10715.800.080.5115.860.100.621.92×10618.990.110.5819.060.120.621.92×10522.480.060.2522.610.130.471.92×10425.220.110.4225.330.080.311.92×10328.900.240.8229.070.351.201.92×10231.980.401.2632.030.481.49
2.5 临床样品的检测结果
对79份猪腹泻病料进行常规RT-PCR检测,检测出阳性样品4份,阳性率为5.06%(4/79);对这79份病料进行TaqMan实时荧光定量 RT-PCR检测,检测出阳性样品6份,阳性率为7.59%(6/79).同时,4份经RT-PCR检测为阳性的样品经TaqMan实时荧光定量RT-PCR检测,结果均为阳性,符合率达100%.
3 讨论
轮状病毒感染是婴幼儿较为常见的感染,在人医上作为引起腹泻的病原之一被广泛关注[18-19].国内外关于猪群感染轮状病毒的研究起步较晚,随着近年来猪群的“顽固性腹泻”病原学研究而成为研究热点[20-21].对轮状病毒VP6基因的研究表明,不同宿主(人源、猪源和大熊猫源)轮状病毒VP6基因之间的核苷酸同源性较高,在90.5%以上[22];且遗传进化分析表明其并无明显的宿主一致性,推测人源和猪源轮状病毒可相互感染.RNA病毒的跨种感染和传播常常会导致病毒基因序列的重组以便能更好地适应宿主的免疫作用,当前有跨多种属的基因重配轮状病毒的报道[23],提示我们应加强对生猪养殖业工作人员相关病原的流行病学跟踪,防止相互交叉感染[24].
本试验建立的TaqMan实时荧光定量RT-PCR方法针对VP6基因保守区域设计,其荧光信号针对VP6基因保守区,不受非特异性扩增及引物二聚体的影响,对常见猪群病原(如PEDV、TGEV、CSFV和JEV)检测均未见阳性扩增信号,特异性强;建立的方法敏感性高,最低检测限为192拷贝·μL-1;扩增相关系数为0.999,组内和组间变异系数低(均低于1.50%),表明建立的TaqMan实时荧光定量RT-PCR方法特异性强、敏感性高、重复性好.对临床收集的79份猪腹泻病料进行检测发现,常规RT-PCR方法检测为阳性的样品,经TaqMan实时荧光定量 RT-PCR方法检测均为阳性,符合率达100%.可见,本试验建立的检测PoRV感染的TaqMan实时荧光定量 RT-PCR方法,可有效用于临床开展PoRV感染的分子流行病学研究.
[1] 姜晶,吴丹,李男.猪轮状病毒的分子流行病学研究进展[J].吉林畜牧兽医,2015,36(4):24-28.
[2] 胡帅,周庆安,李军,等.2013—2014年广西省主要猪病毒性传染病流行病学调查[J].中国畜牧兽医,2016,43(6):1 618-1 623.
[3] 张坤,何启盖.猪流行性腹泻病毒、猪传染性胃肠炎病毒和猪A群轮状病毒多重RT-PCR检测方法的建立及临床应用[J].畜牧兽医学报,2010,41(8):1 001-1 005.
[4] 陈小金,陈建飞,时洪艳,等.猪轮状病毒SYBR GreenⅠ实时荧光定量PCR检测方法的建立[J].中国兽医科学,2010,40(2):174-179.
[5] 边亚娟,林长水,田志军,等.应用PRV VP6蛋白McAb间接免疫荧光法检测猪轮状病毒[J].中国兽医杂志,2007,43(4):36-37.
[6] 袁亚男,刘文忠.实时荧光定量PCR技术的类型、特点与应用[J].中国畜牧兽医,2008,35(3):27-30.
[7] HU L, CRAWFORD S E, HYSER J M, et al. Rotavirus non-structural proteins: structure and function [J]. Curr Opin Virol, 2012,2(4):380-388.
[9] 杨盟,周建国,马海利.A组轮状病毒的基因组及其蛋白研究进展[J].中国动物传染病学报,2012,20(2):75-80.
[10] WEN X, WEI X, RAN X, et al. Immunogenicity of porcine P[6], P[7]-specific △VP8 rotavirus subunit vaccines with a tetanus toxoid universal T cell epitope [J]. Vaccine, 2015,33(36):4 533-4 539.
[11] PARBHOO N, DEWAR J B, GILDENHUYS S. Sequence analysis and structural implications of rotavirus capsid proteins [J]. Acta Virol, 2016,60(3):260-270.
[12] MALM M, HEINIMKI S, VESIKARI T, et al. Anti-VP6 VHH: an experimental treatment for rotavirus A-associated disease [J]. PLoS One, 2016,11(9):e0162351.
[13] 刘阳阳,冉旭华,闻晓波.轮状病毒拮抗宿主先天性免疫机制研究进展[J].中国人兽共患病学报,2016,32(7):659-664.
[14] VILLENA J, VIZOSO-PINTO M G, KITAZAWA H. Intestinal innate antiviral immunity and immunobiotics: beneficial effects against rotavirus infection [J]. Front Immunol, 2016,7:563.
[15] NAIR N, NEWELL E W, VOLLMERS C, et al. High-dimensional immune profiling of total and rotavirus VP6-specific intestinal and circulating B cells by mass cytometry [J]. Mucosal Immunol, 2016,9(1):68-82.
[16] NAVARRO R, AUNG M S, CRUZ K, et al. Whole genome analysis provides evidence for porcine-to-simian interspecies transmission of rotavirus-A [J]. Infect Genet Evol, 2017,49:21-31.
[17] MAFFEY L, VEGA C G, MIO S, et al. Rotavirus capsid VP6 tubular and spherical nanostructures act as local adjuvants when co-delivered with norovirus VLPs [J]. Clin Exp Immunol, 2017,189(3):331-341.
[18] BIALOWAS S, HAGBOM M, NORDGREN J, et al. Rotavirus and serotonin cross-talk in diarrhoea [J]. PLoS One, 2016,11(7):e0159660.
[19] BURNETT E, JONESTELLER C L, TATE J E, et al. Global impact of rotavirus vaccination on childhood hospitalizations and mortality from diarrhea [J]. J Infect Dis, 2017,215(11):1 666-1 672.
[20] 陈强,曾丽莉,俞伏松,等.规模化猪场仔猪腹泻4种病原的感染情况调查[J].福建农业学报,2010,25(1):8-13.
[21] VLASOVA A N, AMIMO J O, SAIF L J. Porcine rotaviruses: epidemiology, immune responses and control strategies [J]. Viruses, 2017,9(3):E48.
[22] LIE Y, CHEN S, WANG C, et al. Molecular cloning and sequence analysis of VP6 gene of giant panda rotavirus strain CH-1 [J]. African Journal of Biotechnology, 2011,10(65):14 329-14 336.
[23] ESONA M D, ROY S, RUNGSRISURIYACHAI K, et al. Characterization of a triple-recombinant, reassortant rotavirus strain from the Dominican Republic [J]. J Gen Virol, 2017,98(2):134-142.

