永生化绵羊肺成纤维细胞系的构建及鉴定
刘 腾,董丹丹,张 莉,朱 杰,缪秋红,刘光清
(中国农业科学院上海兽医研究所,上海 200241)
传代细胞系是开展动物病毒应用和基础研究的重要平台,然而有许多动物病毒缺乏能支持其稳定增殖的本源宿主细胞系,例如小反刍兽疫病毒和兔瘟病毒,严重阻碍了这些病毒的分子生物学研究和疫苗研制工作。而某些原代细胞有限的传代次数使得研究工作进展缓慢,因此原代细胞永生化技术应时而生。
细胞永生化方法有很多,主要有病毒感染法及端粒酶法。有研究表明,利用病毒感染或者重要基因片段转染靶细胞以延长细胞寿命,或是使细胞永生化的方法所获得的永生化细胞是有限的永生化并且存在核型不稳定性,贴壁性降低,失去部分原代细胞特性、潜在诱发肿瘤危险等缺点[1-5]。其作用机制是因为其表达产物与转录因子P53或者PRb相互作用,使P53或PRb状态发生变化,最终实现有限的永生化。如大T抗原通过其一级结构101~108位点的氨基酸所形成的独特的空间结构位点与PRb-E2F复合物结合,使得E2F从PRb-E2F复合体上解离下来,从而激活下游信号通路使细胞永生化[6]。而利用端粒酶建立的永生化细胞系除了可以维持正常细胞的生理特性外,这些细胞还具有更快的生长速度及同原代细胞相同的核型,单层抑制生长等特点[7-10]。
因此,本研究旨在利用含有hTERT基因的慢病毒表达系统建立过表达hTERT基因的绵羊肺成纤维稳转细胞系,为将来开展本源病毒分子致病机制及疫苗的研制工作提供有效的生物材料。
1 材料与方法
1.1 材料和试剂 pBabe-neo-hTERT质粒、慢病毒表达载体pLOV-GFP-3Flag、包膜蛋白质粒psPAX2、包装质粒pMD2.G、293T细胞和原代绵羊肺成纤维细胞均由本实验室保存;Infusion连接酶购自全式金生物公司;NotI等限制性内切酶购自NEB公司;基因组提取试剂盒和Reverse Transcriptase M-MLV试剂盒购自生物工程大连有限公司;DMEM培养基、MEM 培养基、1×PBS购自Hyclone 公司;胎牛血清购自Gibco公司;磷酸钙钙转染试剂由本实验室保存;CaCl2和 HEPES购自Sigma 公司;嘌呤霉素(Puromycin)购自Sigma 公司;HRP 标记的山羊抗鼠 IgG购自Santa Cruz 公司;质粒小量提取试剂盒购自QIAGENE公司;hTERT多克隆抗体购自abcam公司;上下游引物及DNA测序均由上海华津生物有限公司完成。
1.2 重组慢病毒载体(pLOV-puro-hTERT)的构建 根据pBabe-neo-hTERT模板质粒序列信息及NCBI(NM_198253.2)hTERT基因cDNA序列设计1对引物。InFu-hTERT-NotI (+):5'- GCTCTAG ATAACTGAGCGGCCGCCATGCCGCGCGCTC CC-3';InFu-hTERT-NotI(-):5'- CCCTCGAC GCCTAGGGGCGGCCGCTCAGTCCAGGATGGT CTTGAA-3'。在上下游引物中均添加了NotI酶切位点(下划线)及保护碱基。hTERT基因 PCR扩增反应程序:95℃预变性5 min;94℃变性1 min,60℃退火45 s,72℃延伸3 min 30 s,12℃ 终止反应。PCR扩增片段大小为3400 bp,PCR产物经过胶回收纯化后与pLOV-GFP-3Flag慢病毒载体利用NotI酶切,胶回收后,通过In fusion技术进行连接,构建 pLOV-puro-hTERT重组质粒,构建的重组质粒经双酶切鉴定为阳性,然后送上海华津生物技术有限公司测序,确定插入基因正确。
1.3 制备重组慢病毒 转染前1 d,将 293T 细胞饲养于细胞培养皿中,过夜培养,待细胞密度大约为 50%时进行转染,转染前 1 h更换新鲜无血清培养基;制备DNA-CaCl2复合物:将psPAX2(10 μg)、pMD2.G(15 μg)与pLOV-purohTERT(25 μg)/ pLOV-GFP-3Flag(25 μg)分别加至相应装有66 μL 2.5 mol/L CaCl2溶液的2 mL离心管中,然后用无菌水将体积补至660 μL,充分混匀,室温静置3 min;取660 μL加热至 37℃的2×HBS 缓冲液(pH7.01)(由140 mmol/L NaCl、1.5 mmol/L Na2HPO4·2H2O、50 mmol/L HEPES缓冲溶液组成),迅速滴加至DNA-CaCl2混合液中,并立即吹打充分混匀,室温孵育10 min;将制备好的转染液均匀滴加至293T细胞培养基表面,并在显微镜下观察是否形成细小颗粒;转染 16 h 后,用新鲜的含有5%FBS的完全培养基更换含转染颗粒的培养基;转染24 h和48 h后,分别收集含慢病毒颗粒的培养上清液,0.45 μm滤器过滤后分装,-80℃保存备用。
1.4 原代绵羊肺成纤维细胞的分离和培养 三月龄绵羊麻醉后处死,用75%乙醇消毒皮肤,取出肺组织,剪去血管等组织,用含有100 U/mL青链霉素的FBS反复冲洗肺组织,去除血污和组织碎片,用眼科剪将肺组织剪成约1 mm3大小的组织块后置于三角锥形瓶中,加入适量胰酶在37℃水浴锅中消化5~10 min,然后加入1 mL FBS终止消化,接着用8~10纱布过滤至离心管中,300×g离心5 min,弃去上清。用含10%FBS的DMEM重悬细胞,然后置于37℃、5%CO2培养箱中培养。当原代绵羊肺成纤维细胞生长至80%~90%汇合度时,用PBS清洗细胞,加入适量胰酶消化45 s~1 min,当细胞开始变圆,细胞间隙变宽时弃去胰酶,加入适量完全培养基轻轻吹打混匀后,按照1∶2的比例传代培养。
1.5 最佳嘌呤霉素筛选浓度确定 细胞培养液:将嘌呤霉素在0~5 μg/mL范围内按500 ng/mL一个梯度,用培养液稀释嘌呤霉素制成筛选培养液;嘌呤霉素筛选:弃掉培养孔中培养液,PBS清洗2次,每孔加入不同浓度筛选培养液,每个梯度3个重复;确定最佳筛选浓度:每12 h,记录一次细胞生长状况,3~5 d内能够杀死所有细胞的最小嘌呤霉素浓度即为最佳筛选浓度。最终确定最佳的嘌呤霉素筛选浓度为2 μg/mL。
1.6 RT-PCR鉴定重组慢病毒中hTERT基因 取200 μL重组慢病毒液提取RNA进行RT-PCR,扩增条件同1.2。
1.7 重组慢病毒感染原代绵羊肺成纤维细胞 将原代绵羊肺细胞制成细胞悬液并接种于T25培养瓶中,培养24 h后细胞汇合度在80%左右,PBS清洗2次。然后,取500 μL浓缩重组慢病毒液,加入8 μg/mL 聚凝胺,6 h后换成新鲜培养液培养48 h后,更换为含有10%FBS的DMEM完全培养基,内含2 μg/mL嘌呤霉素,约4 d后,对照组细胞大面积死亡,将嘌呤霉素维持在1 μg/mL将细胞扩大培养并连续传代,约14 d后,转染组细胞形成细胞集落,然后将筛选出来的阳性克隆转移至48孔板,继续在1 μg/mL嘌呤霉素的条件下,维持扩大培养,命名为绵羊肺成纤维(sheep lung fibroblast,SLT)细胞。
1.8 基因组水平以及转录水平检测hTERT基因 将培养状态良好的第10代和第20代SLT细胞,用胰酶消化离心,取沉淀,提取细胞总基因组DNA和RNA,提取过程参照生工生物(上海)股份有限公司试剂盒操作说明书。获得的RNA进行反转录获得cDNA,分别以cDNA和抽提的细胞基因组DNA为模板,F-qpcr:5'- CGTGGTTTCTGTGTGGTGTC-3'和R-qpcr:5'- CCTTGTCGCCTGAGGAGTAG-3'为鉴定引物。PCR扩增片段大小为214 bp。同时以Hela细胞为阳性对照。PCR反应程序:95℃预变性5 min;94℃变性1 min,56℃退火30 s,72℃延伸20 s;12℃终止反应。
1.9 Western blot检测SLT细胞中hTERT 取第10代和第20代SLT细胞,并取Hela细胞作为阳性对照,弃掉培养基,用PBS清洗2次,加入细胞裂解液200 μL/瓶,冰上孵育5 min,用细胞刮快速刮下细胞于1.5 mL离心管中,加入5×蛋白上样缓冲液,100℃金属浴10 min,使蛋白变性,10 786×g离心5 min,取上清进行SDS-PAGE凝胶电泳后转至PVDF膜。5%脱脂乳,4℃封闭过夜,1∶1000稀释hTERT一抗,37℃孵育2 h,PBST清洗3次,15 min/次,1∶5000稀释HPR标记山羊抗鼠的二抗,室温作用1 h,PBST清洗3次,15 min/次,电化学发光(electrochemiluminescence,ECL)技术显色试剂盒进行化学显色及分析。
2 结果
2.1重组质粒酶切鉴定 重组慢病毒质粒载体pLOV-puro-hTERT经NotI单酶切鉴定,在大约3400 bp处有条带(图1)。目的片段测序后与NCBI数据库中hTERT参考序列(NM_198253.2)进行比对分析,结果显示,两者同源性100%;表明重组慢病毒载体pLOV-puro-hTERT构建成功。

图1 酶切鉴定重组慢病毒载体pLOV-puro-hTERTFig.1 Identi fi cation of recombinant lentivirus plasmid pLOV-puro-hTERT digested with NotI
2.2 RT-PCR检测重组慢病毒中hTERT基因 取200 μL重组慢病毒液提取RNA进行RT-PCR检测重组慢病毒中hTERT基因,同时以重组质粒pLOV-purohTERT为阳性对照,见图2。
2.3 永生化绵羊肺成纤维细胞的形态 原代绵羊肺成纤维细胞经过重组慢病毒感染和嘌呤霉素筛选后所得的阳性细胞与原代细胞相比具有相似的形态,为长梭形,具有典型的纤维细胞特征,见图3。

图2 RT-PCR检测重组慢病毒中hTERT基因Fig.2 hTERT gene in recombinant lentivirus detected by RT-PCR

图3 SLT细胞的形态Fig.3 Morphology of SLT cells
2.4 PCR及RT-PCR检测SLT中的hTERT基因 PCR
及RT-PCR在第 10、20代SLT细胞的基因组DNA及cDNA中均能检出 hTERT基因,而原代SLT细胞未检测出,见图4。结果表明,hTERT 基因成功插入到原代绵羊肺细胞基因组中,并且能够转录成mRNA。
2.5 Western blot 分析hTERT基因的表达 分别选取
第10代和第20代SLT细胞并以Hela细胞做阳性对照,进行Western blot检测。以人源端粒酶抗体为一抗,β-actin为内参蛋白。如图5所示,hTERT在第10代和第20代SLT细胞中均得到有效表达,从而表明SLT细胞能够稳定表达hTERT。
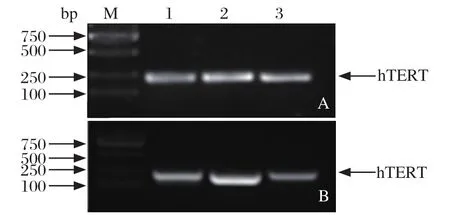
图4 SLT细胞中hTERT基因的检测Fig. 4 Identi fi cation of hTERT in SLT cells

图5 Western blot检测SLT中hTERT蛋白Fig.5 hTERT protein expressed in SLT cells detected by Western blot
3 讨论
原代细胞永生化难度比较大,应用普通的逆转录病毒载体介导细胞实现永生化存在的主要缺陷是无法感染处于非分裂期的细胞,并且在表达外源基因时常常发生片段丢失;此外,其只容纳小片段外源基因,难以兼容多个启动子,同时还会受到转录沉默的影响,从而导致较低的感染效率和较差的稳定性,这些缺陷在一定的程度上限制了逆转录病毒的应用[11]。
然而,慢病毒载体是基于人类免疫缺陷病毒-I型为基础改造而来的一种新型病毒载体,携带外源基因的慢病毒载体经过包装质粒和包装细胞系的共同作用下,重组为具有感染力的病毒颗粒,通过感染靶细胞将外源基因插入靶细胞基因组,从而实现外源基因在细胞中的稳定表达。高滴度的慢病毒可以感染处于分裂期和非分裂期的细胞并且对正常细胞的表型不会产生影响,其感染能力较强,可以用于感染原代细胞,并且可将目的基因有效整合到宿主基因组中并实现目的基因在宿主中的长期稳定的表达。相对于腺病毒和普通的逆转录病毒而言,使宿主产生较低的免疫反应[12]。此外,由于hTRET的编码基因含有较高GC含量,从细胞中克隆难度较大,所以本研究以质粒pBabe-neo-hTERT为模板,采用infusion技术将hTERT片段克隆至pLOV-CMV-eGFP载体上,从而高效快捷地构建了过表达慢病毒载体pLOV-puro-hTERT。
因此,本研究利用慢病毒系统的优点,采用携带hTERT基因的重组慢病毒来介导原代绵羊肺成纤维细胞的永生化,经过嘌呤霉素的抗性筛选后所获得的阳性克隆细胞,具有与原代细胞相似的表型和细胞形态,PCR、RT-PCR和Western blot检测结果均显示hTERT在传代细胞组高效表达。目前,永生化绵羊肺成纤维细胞已经传代至第48代,后续还将对该永生化细胞继续传代并进行生物学特性检测。
总之,本研究利用携带hTERT基因的慢病毒系统成功建立了稳定表达hTERT基因的绵羊肺成纤维细胞系,为后续研究羊源病毒,如小反刍兽疫病毒等分子致病机制和新型疫苗等提供良好平台。
[1] Bryan T M, Reddel R R. SV40-induced immortalization of human cells [J]. Crit Rev Oncog, 1994, 5(4): 331-357.
[2] Chrusciel M, Bodek G, Kirtiklis L,et al. Immortalization of swine umbilical vein endothelial cells (SUVECs) with the simian virus 40 large-T antigen[J]. Mol Reprod Dev,2011, 78(8): 597-610.
[3] Reddel R R, De Silva R, Duncan E L,et al. SV40-induced immortalization and ras-transformation of human bronchial epithelial cells[J]. Int J Cancer, 1995, 61(2):199-205.
[4] Furukawa T, Duguid W P, Rosenberg L,et al. Longterm culture and immortalization of epithelial cells from normal adult human pancreatic ducts transfected by the E6E7 gene of human papilloma virus 16[J]. Am J Pathol,1996, 148(6): 1763-1770.
[5] Tsao Y P, Kuo S W, Li S F,et al. Human papillomavirus 11 E5a delays the growth restriction induced by temperature shift in temperature-sensitive simian virus 40 T antigen-immortalized keratinocytes[J]. Biochem Biophys Res Commun, 1995, 217(3): 712-720.
[6] Srinivasan A, McClellan A J, Vartikar J,et al. The amino-terminal transforming region of simian virus 40 large T and small t antigens functions as a J domain[J].Mol Cell Biol, 1997, 17(8): 4761-4773.
[7] Bai H, Sakurai T, Bai R,et al. Establishment and characterization of immortalized bovine endometrial epithelial cells[J]. Anim Sci J, 2014, 85(8): 799-804.
[8] Zhou K, Koike C, Yoshida T,et al. Establishment and characterization of immortalized human amniotic epithelial cells[J]. Cell Reprogram, 2013, 15(1): 55-67.
[9] Dong F, Huang Y, Li W,et al. The isolation and characterization of a telomerase immortalized goat trophoblast cell line[J]. Placenta, 2013, 34(12): 1243-1250.
[10] Moffatt-Jauregui C E, Robinson B, de Moya A V,et al. Establishment and characterization of a telomerase immortalized human gingival epithelial cell line[J]. J Periodontal Res, 2013, 48(6): 713-721.
[11] Lois C, Hong E J, Pease S,et al. Germline transmission and tissue-specific expression of transgenes delivered by lentiviral vectors[J]. Science, 2002, 295(5556): 868-872.
[12] Kafri T, van Praag H, Gage F H,et al. Lentiviral vectors:regulated gene expression[J]. Mol Ther, 2000, 1(6): 516-521.

