温度胁迫对岩扇贝幼贝抗氧化酶活力的影响
曹善茂,王潇,刘钢,李晓雨,刘阳
(大连海洋大学辽宁省海洋生物资源恢复与生境修复重点实验室,辽宁大连116023)
岩扇贝Crassadoma gigantea隶属于软体动物门Mollusca、瓣鳃纲Lamellibranchia、珍珠贝目Pterioida、扇贝科Pectinidae,自然分布在北美太平洋沿岸,成年岩扇贝闭壳肌的大小、风味与其他几种养殖扇贝相比有很大优势。目前,岩扇贝已经被大连海洋大学引入中国并成功完成了室内全人工育苗及海上试养殖工作[1],并对其代谢[2-3]、营养成分[4]等进行了研究。岩扇贝作为新引进品种,幼贝能否在养殖地区的海域顺利生长发育是非常关键的环节[5]。贝类致病、致死等情况涉及贝类抗氧化防御系统对环境因子的响应[6],尤其在幼贝阶段。扇贝稚贝和幼贝期生长速度和成贝相比较快[7],稚贝和幼贝生长发育受环境因子的影响相比成贝也更明显[8-9],因此,研究环境因子对岩扇贝幼贝抗氧化系统的响应,对岩扇贝的养殖具有一定的参考意义。
贝类的抗氧化系统比较简单,易受外界胁迫影响,其中超氧化物歧化酶 (SOD)、过氧化氢酶(CAT)和总抗氧化能力 (T-AOC)在很多对贝类环境胁迫的研究中被认为可以作为检测指标[10]。影响这些酶活力的环境因子有温度[11-12]、pH[13-14]、盐度、规格和饵料等,在这些因子中温度是影响抗氧化酶活力的重要因素。之前关于温度对抗氧化酶活力的影响研究大多数集中在离体粗酶液提取后反应温度对抗氧化酶活性的影响上[15],这些研究结果对确定不同物种生物抗氧化酶活力的测定方法有参考价值,但与外界环境温度变化对贝类体内抗氧化酶活力的实际影响不同。关于温度胁迫对贝类抗氧化酶活力影响的报道,也集中在以适宜贝类生长发育的水温 (通常为15~20℃)为对照,通过升温或者降温来完成温度胁迫[16],这些研究对象都是成贝,而以低温为起点逐渐升温的温度胁迫对幼贝抗氧化酶活力影响的研究很少。岩扇贝最适宜的生长温度为15℃,在15℃条件下岩扇贝生长发育速度最快[1]。为此,本研究中在实验室模拟扇贝生长海域的温度,从最低温开始逐步升温,检测了岩扇贝幼贝鳃组织中3种抗氧化酶活力在一定时期随温度的变化情况,旨在为岩扇贝幼贝养殖技术的完善和推广、养殖生产中分苗时机的把握,以及对幼贝的养殖管理提供参考。
1 材料与方法
1.1 材料
试验用岩扇贝亲贝于2015年11月自加拿大温哥华引进,亲贝于2016年2月经人工育苗得到稚贝,稚贝经海上中间育成,于2016年5月将所得子一代幼贝移至大连市龙王塘海域养殖至12月龄,取壳长为(36.39±4.45)mm、壳高为(37.62±6.37)mm的幼贝400枚,于大连海洋大学辽宁省海洋生物资源恢复与生境修复重点实验室进行试验。试验用海水经过沙滤罐过滤,用循环水控温装置进行控温,饵料来自圆柱形高密度饵料培养装置。
1.2 方法
1.2.1 暂养与管理 将试验用400枚岩扇贝幼贝暂养在实验室海水循环水控温装置中,水温为(4.1±0.2)℃,盐度为 (31.3±0.2),pH 为(8.14±0.15)。暂养期间连续充气,循环水,每天全量更换海水1次,每天4:00、10:00、16:00、22:00投喂新月菱形藻、湛江等边金藻混合饵料,第二天虹吸出幼贝残饵、粪便等杂质,及时清理死贝,暂养7 d后开始试验。
1.2.2 温度处理及取样 根据对大连市龙王塘海区2015年全年海水温度追踪测量 (全年水温变化在3.8~23.8℃), 设定 5、 10、 15(对照)、 20、25℃ 5个温度试验组,实测平均温度分别为(5.2±0.2)、 (9.7±0.2)、 (15.2±0.2)、 (20.4±0.2)、 (25.3±0.2)℃,每个温度组设3个平行,每个平行试验组放25枚幼贝。水温从 (4.1±0.2)℃开始,以每天1℃的幅度进行升温,到达设定温度时开始计时,分别在计时后1、6、12、24、48 h时随机挑选幼贝进行抗氧化酶活力测定试验,每个温度组的每个时间点设3组平行试验。1.2.3 内脏、鳃组织上清液的制备 从每个平行组随机取3枚幼贝,然后在冰盘上取幼贝的内脏组织和鳃组织,分别称其质量,按质量体积比为1 mg∶4 mL加入预冷的生理盐水,用电动匀浆机(10 000 r/min)在冰浴条件下匀浆3 min,匀浆液经离心机以3500 r/min离心10 min,取上清液备用。由于内脏组织每个温度时间点上的酶活力测定值误差偏差较大,故本试验中仅选用岩扇贝鳃组织上清液进行酶活力测定。
1.2.4 抗氧化酶活力的测定 对鳃组织上清液分别进行SOD、CAT活力和T-AOC能力的测定。酶活力的测定使用南京建成科技有限公司试剂盒。根据计算要求,每次测量设置空白对照管、标准对照管、测定管,每管设置3个平行,计算方法和原理均参照试剂盒说明书。
1.3 数据处理
采用SPSS 20.0软件对试验数据进行分析,用Duncan进行多重分析,试验数据均用平均值±标准差表示,显著性水平设为0.05。
2 结果与分析
2.1 温度胁迫下岩扇贝幼贝鳃组织中SOD活力的变化
从图1可见:温度在5℃时,SOD活力相对于其他温度组均较低,各个时间点SOD活力均显著低于其他温度组 (P<0.05);随着温度逐渐升高,10、15、20、25℃组SOD活力保持较高值,比较稳定;在温度胁迫1 h时,10℃组与15℃组无显著性差异 (P>0.05),20℃与25℃组无显著性差异 (P>0.05),其他温度组间均有显著性差异(P<0.05);胁迫时间超出6 h时,上述4个温度组间均无显著差异 (P>0.05)。
在受胁迫的48 h内,5℃组SOD活力略有下降;10、15℃组SOD活力随着试验时间的延长相对稳定;20℃组SOD活力在温度胁迫12 h时最高;25℃组SOD活力在温度胁迫24 h时最高。
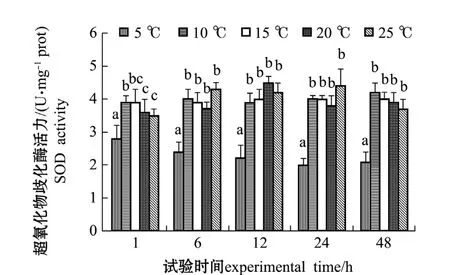
图1 温度渐变对岩扇贝幼贝SOD酶活力的影响Fig.1 Impact of gradual change in temperaturet on SOD activity in rock scallop Crassadoma gigantea
2.2 温度胁迫下岩扇贝幼贝鳃组织中CAT活力的变化
从图2可见:在温度逐渐升温的过程中,5、10、15、20℃组CAT活力比较稳定且组间无显著性差异 (P>0.05),这4个组的CAT活力均小于25℃组;温度胁迫1 h时,仅20℃和25℃组的CAT活力有显著性差异 (P<0.05);温度胁迫6 h时,5个温度组均无显性著差异 (P>0.05);温度胁迫12 h时,5、20℃组均与25℃组有显著性差异 (P<0.05);温度胁迫24 h时,仅5℃与25℃组的CAT活力有显著性差异 (P<0.05);温度胁迫48 h时,5、10、15℃均与25℃组有显著性差异 (P<0.05)。
在温度胁迫的48 h内,5℃组的CAT活力略有下降后基本不变;10、15、20℃组的CAT活力基本稳定;25℃组CAT活力缓慢上升。

图2 温度渐变对岩扇贝幼贝CAT酶活力的影响Fig.2 Impact of gradual change in temperaturet on CAT activity in rock scallop Crassadoma gigantea
2.3 温度胁迫下岩扇贝幼贝鳃组织中T-AOC能力的变化
从图3可见:在温度逐渐升温的过程中,15℃组幼贝鳃组织中T-AOC能力均显著高于其他温度组 (P<0.05);温度胁迫1~6 h时,15℃组TAOC能力显著高于其他4组 (P<0.05),5℃组显著低于其他4组 (P<0.05);胁迫12~48 h时,15℃组T-AOC能力显著高于25℃组 (P<0.05),二者均显著高于10、20℃组 (P<0.05),而5℃组显著低于其他4组 (P<0.05)。可见,温度从15℃升高或降低,T-AOC能力都会显著下降 (P<0.05),温度从15℃降低至5℃时,T-AOC能力的下降幅度显著高于温度从15℃升高至25℃时T-AOC能力的下降幅度 (P<0.05)。
在受胁迫的48 h内,5、10、20℃组T-AOC能力较稳定,15、25℃组的T-AOC能力略有升高。

图3 温度渐变对岩扇贝幼贝T-AOC能力的影响Fig.3 Impact of gradual change in temperaturet on TAOC capacity in rcok scallop Crassadoma gigantea
3 讨论
3.1 水温胁迫对岩扇贝幼贝鳃组织抗氧化酶活力的影响
温度是水生生物尤其是贝类生存环境的关键因素之一,海洋生物的生长、繁殖和抗氧化能力等都与海水温度密切相关,尤其在夏季持续高温和春季水温从低温回升时,贝类死亡率明显增加,很容易造成大面积死亡的现象。温度过高或者过低都会在贝类体内产生过多的自由基,这些自由基在体内积累会对贝类造成一定损伤甚至死亡。在贝类的抗氧化体系中,主要依靠SOD、CAT来清除过多的自由基,尤其是SOD,其活力和生物体免疫水平息息相关[17]。SOD是一种还原酶,存在多种异构体,能够直接作用于超氧阴离子(O2-·),并与其发生歧化反应,生产危害较低的过氧化氢和分子氧,减轻自由基对机体的损害。CAT与SOD具有协同作用,可将SOD催化生成的过氧化氢催化生成氧气和水,以消除超氧阴离子等中间产物对细胞的毒害。T-AOC是体现抗氧化体系的抗氧化能力总和,包含了直接作用在自由基或是间接消耗掉容易生成自由基的物质,防止自由基在机体内发生进一步反应。
本研究中设计了5组不同温度试验组,从低温逐步升温完成温度胁迫试验,涵盖了大连市龙王塘海域2015年全年海水温度跨度范围 (全年水温变化在3.8~23.8℃),探究了水温胁迫对岩扇贝幼贝鳃组织中抗氧化酶活力的变化。本研究中发现,随着温度的升高,当温度为15~25℃时,岩扇贝鳃幼贝组织中SOD活力无显著性差异,CAT活力缓慢上升,在25℃时CAT活力达到最高,T-AOC水平在温度超过15℃时显著下降,这与贲月等[18]发现温度从15℃渐变升温到26℃过程中,随着温度升高虾夷扇贝体腔液中CAT活力显著升高、SOD活力差异不显著、T-AOC能力先显著下降后逐渐回复的结果基本一致。本研究中还发现,随着温度的降低,当温度从15℃降至5℃时,温度变化对CAT活力影响不明显,这与时少坤[19]对杂交鲍抗氧化酶研究结果中温度由18℃降至6℃时CAT活力与对照组18℃无显著性差异的结果也是一致的。本研究中,5℃时SOD活力显著低于10、15、20、25℃组,可见低温对岩扇贝幼贝鳃组织中SOD活力有着明显的抑制作用;T-AOC水平在温度从15℃降至5℃时显著下降,下降幅度大于从15℃升到25℃时T-AOC的下降水平,这表明低温对岩扇贝幼贝鳃组织中T-AOC活力有着明显的抑制作用。
3.2 水温胁迫试验中影响岩扇贝幼贝鳃组织抗氧化酶活力的其他因素
温度变化的过程中往往会引起抗氧化酶表达和活力增加[20-22],但是抗氧化酶的变化涉及到很多复杂的因素交互影响。一是,试验物种的不同会导致温度对生物体的抗氧化酶活力影响的不同,王文文[23]、孔祥会等[24]研究表明,菲律宾蛤仔Ruditapes philippinarum、锯缘青蟹Scylla serrata在低温下可以保持高水平的抗氧化酶活力,低温下菲律宾蛤仔、锯缘青蟹体内SOD、CAT活性水平已经高出其生长发育最适温度下的活性,这与温度对扇贝抗氧化酶活力影响的研究结果不符[18];二是,试验对象发育时期不同,如本试验中使用小规格幼贝,小规格贝类单位组织干重耗氧率和排氨率较大,代谢作用与成贝相比较强[25],受温度的波动及低温和高温等恶劣环境的影响较大,高振锟等[26]研究证明了小规格虾夷扇贝在受一定温度波动后死亡率高于大规格扇贝,成贝能够适应一定范围的水温变化,尤其是对低温环境的适应能力尤为明显,成贝和幼贝的抗氧化酶活力对低温的响应也不一样[16,26];三是,试验设定温度范围、降温方式和胁迫时间不同,很多研究是以适温 (15℃左右)作为对照,分别升温、降温来完成的,而在低温胁迫条件下,很多研究得出的结果与在常温下的结果不一致甚至相反[27],类似结果不一致的还有一些急性恶劣条件对贝类抗氧化酶活力的研究[26-29],生物体若受到轻度逆境胁迫,其体内的SOD活力往往会升高[30-31],若受到重度或长时间逆境胁迫,SOD活力通常降低,这就促使生物体内积累活性氧,从而对生物体造成损害[32-33]。本研究中的低温和高温就是一种逆境,在低温条件下SOD活力、T-AOC能力均低于15℃时的活力。综合温度对3种抗氧化酶活力的影响,结果表明,15℃条件下岩扇贝幼贝抗氧化酶活力较高,从抗氧化酶活力变化证明15℃是岩扇贝生长的最适宜温度。
综上所述,在每天升温1℃的条件下,高温对岩扇贝幼贝鳃组织中SOD活力影响不明显,对CAT活力有着明显的诱导作用,对T-AOC能力有着明显的抑制作用;低温对岩扇贝幼贝鳃组织中CAT活力影响不明显,对SOD、T-AOC能力有着明显的抑制作用,其中低温对T-AOC能力抑制程度比高温大。综合温度对3种抗氧化酶活力的影响表明了15℃为岩扇贝幼贝抗氧化酶活力最高的温度。总之,15℃岩扇贝幼贝抗氧化酶活力最高,温度过低或过高对岩扇贝幼贝的抗氧化酶活力均产生显著影响,这表明抗氧化酶活力可以作为岩扇贝对温度胁迫检测的指标,本研究结果可为岩扇贝幼贝养殖技术的完善和推广、养殖生产中分苗时间的把握及幼贝的养殖管理提供参考。
参考文献:
[1] 曹善茂,汪健,王谦,等.岩扇贝人工育苗的初步研究[J].大连海洋大学学报,2017,32(1):1-6.
[2] 曹善茂,梁伟锋,刘钢,等.不同生态因子对岩扇贝幼贝耗氧率和排氨率的影响[J].大连海洋大学学报,2017,32(3):280-286.
[3] 曹善茂,梁伟锋,汪健,等.岩扇贝幼贝滤食率的基础研究[J].大连海洋大学学报,2016,31(6):612-617.
[4] 曹善茂,王昊,陈炜,等.岩扇贝闭壳肌营养成分的分析及与中国3种扇贝的比较[J].大连海洋大学学报,2016,31(5):544-550.
[5] 陆红法,方美娟,张晓锋.高山薄壳田螺的引种试验[J].浙江海洋学院学报:自然科学版,2011,30(5):458-461.
[6] 马洪明,刘晓伟,麦康森,等.盐度突降对栉孔扇贝(Chlamys farreri)抗病力指标的影响[J].高技术通讯,2006,16(7):746-751.
[7] Leighton D L,Phleger C F.The purple-hinge rock scallop:a new candidate for marine aquaculture[J].Journal of the World Aquaculture Society,1977,8(1-4):457-469.
[8] 林笔水,吴天明,黄炳章.温度和盐度对菲律宾蛤仔稚贝生长及发育的影响[J].水产学报,1983,7(1):15-23.
[9] 尤仲杰,陆彤霞,马斌,等.温度对墨西哥湾扇贝幼虫和稚贝生长与存活的影响[J].水产科学,2003,22(1):8-10.
[10] 牟海津,江晓路,刘树青,等.免疫多糖对栉孔扇贝酸性磷酸酶、碱性磷酸酶和超氧化物歧化酶活性的影响[J].青岛海洋大学学报,1999,29(3):463-468.
[11] 樊甄娇.环境因子和外源刺激对栉孔扇贝免疫活性的影响[D].青岛:中国海洋大学,2005.
[12] 朱晓闻.温度、盐度、pH对马氏珠母贝稚贝生理学特征的联合效应研究[D].湛江:广东海洋大学,2012.
[13] 张硕,赵艳.栉孔扇贝蛋白酶和淀粉酶活力的初步研究[J].大连水产学院学报,1997,12(1):15-20.
[14] Areekijseree M,Engkagul A,Kovitvadhi U,et al.Temperature and pH characteristics of amylase and proteinase of adult freshwater pearl mussel,Hyriopsis(Hyriopsis)bialatus Simpson 1900[J].Aquaculture,2004,234(1-4):575-587.
[15] 孙业勇,高如承,温扬敏,等.温度对中国血蛤、双线血蛤肝脏中水解酶和抗氧化酶活性的影响[J].水产科学,2008,27(10):543-544.
[16] 钱佳慧,栗志民,陈树河.温度和盐度对华贵栉孔扇贝幼贝淀粉酶和 Na+/K+-ATP酶活性的联合效应[J].水产科学,2015,34(5):269-276.
[17] 张立颖,赵萌,王跃智.水生生物超氧化物岐化酶的研究进展[J].江西农业大学学报,2012,34(4):800-804.
[18] 贲月,郝振林,丁君,等.高温对虾夷扇贝体腔液免疫酶活力的影响[J].水产学报,2013,37(6):858-863.
[19] 时少坤.环境因子对贝类几种免疫因子影响的研究[D].上海:上海海洋大学,2013.
[20] 张朝霞,王军,丁少雄,等.贝类免疫学研究新进展[J].厦门大学学报:自然科学版,2006,45(S2):90-96.
[21] 刘敏.不同温度和盐度对施氏獭蛤消化酶和免疫酶活力的影响[D].湛江:广东海洋大学,2015.
[22] 李晓英,沈睿杰,董志国,等.温度骤升和窒息胁迫对青蛤抗氧化酶活性的影响[J].中国饲料,2009(1):39-42.
[23] 王文文.干露胁迫对菲律宾蛤仔免疫指标和基因表达的影响[D].大连:大连海洋大学,2016.
[24] 孔祥会,王桂忠,李少菁.低温驯化锯缘青蟹鳃抗氧化防护、ATPase及膜脂肪酸组成变化[J].水生生物学报,2007,31(1):59-66.
[25] 聂鸿涛,霍忠明,侯晓琳,等.温度和盐度突变对菲律宾蛤仔斑马蛤耗氧率和排氨率的影响[J].水生生物学报,2017,41(1):121-126.
[26] 高振锟,张继红,李敏,等.温度波动对不同规格虾夷扇贝(Patinopecten yessoensis)生理和免疫指标的影响[J].渔业科学进展,2017,38(3):148-154.
[27] 胥贤,杨凤,朱恒涛,等.低温对3种壳色菲律宾蛤仔幼贝耗氧率和排氨率的影响[J].大连海洋大学学报,2015,30(6):627-633.
[28] 于庆云,王悠,徐彦,等.镉和铅对菲律宾蛤仔脂质过氧化及抗氧化酶活性的影响[J].生态毒理学报,2013,8(4):504-512.
[29] 张林宝,吴惠丰,孙伟,等.菲律宾蛤仔对镉、铜暴露的蓄积作用及其抗氧化酶系统的响应研究[J].南方水产科学,2013,9(5):64-70.
[30] 李桂峰,钱沛锋,孙际佳,等.维生素C对胡子鲶血清免疫相关酶活性的影响[J].大连水产学院学报,2004,19(4):301-305.
[31] 周鲜娇,邱德全,刘文珍.温度变化对凡纳滨对虾心率和肝胰腺抗氧化酶活性的影响[J].渔业现代化,2007,34(5):5-7.
[32] 时少坤,王瑞旋,王江勇,等.盐度胁迫对近江牡蛎几种免疫因子的影响[J].南方水产科学,2013,9(3):26-30.
[33] 孙学亮,刑克智,陈成勋,等.急性温度胁迫对半滑舌鳎血液指标的影响[J].水产科学,2010,29(7):387-392.

