线粒体自噬在糖尿病肾病肾组织巨噬细胞表型转化中的作用
赵 宇 郭银凤 朱小东 姜彧滕 刘玉秋 刘必成 张晓良
糖尿病肾病(DN)是一种慢性炎症性疾病,巨噬细胞浸润是其重要病理特征[1]。最近研究发现,决定DN发展方向的主要因素是局部组织中巨噬细胞的活化状态[2]。巨噬细胞主要分为两种不同的活化状态,即经典活化型巨噬细胞(M1 型)和替代活化型巨噬细胞(M2 型)[3]。其中M1型巨噬细胞具有促进炎症与组织损伤的作用,M2型则介导抗炎和组织修复作用。我们前期研究发现DN肾组织存在M1/M2巨噬细胞表型失衡并以M1型浸润为主[4]。因此调节巨噬细胞表型已成为防治DN的重要研究方向。
自噬是一种由溶酶体介导的细胞内过多或异常蛋白质的降解过程[4-5]。线粒体是细胞发生自噬的重要场所。研究发现肾脏固有细胞线粒体自噬的异常在DN的发生发展中起重要作用[6-7]。然而,对于DN状态下巨噬细胞线粒体自噬的变化及其生物学意义尚不清楚。因此,本研究拟通过体内、体外实验探讨DN大鼠肾组织线粒体自噬特征与巨噬细胞M1/M2表型的相关性及在其分化中的作用。
材料与方法
材料和试剂健康雄性SD大鼠55只(上海 斯莱克),6周龄,体质量180~220g,链脲菌素(STZ,美国Sigma)。血糖仪(德国 罗氏),CD68(美国Santa Cruz)。RAW264.7小鼠巨噬细胞(上海 博古生物科技)。RPMI-1640培养基(美国Gibco),胎牛血清(美国Sciencell)。右旋葡萄糖、甘露醇、3-甲基腺嘌呤(3-MA)、雷帕霉素 (RAPA)(美国 Sigma),CD68 (英国 Abcam),自噬微管相关蛋白轻链3 (LC3)(美国 Sigma),Beclin-1 (英国 Abcam),P62 (美国 Cell Signaling),电压依赖性阴离子通道(VDAC)(英国 Abcam),一氧化氮合酶(iNOS)(英国 Abcam),肿瘤坏死因子(TNF-α)(美国 Santa Cruz),甘露糖受体(MR) (英国 Abcam),精氨酸酶1 (Arg-1) (美国 Santa Cruz),山羊抗兔二抗(美国 Jackson),驴抗小鼠二抗(美国 Jackson),驴抗兔二抗(美国 Jackson),山羊抗小鼠(美国,Cell Signaling)。
糖尿病大鼠模型建立与分组大鼠适应性喂养1周,禁食12 h,随机分为正常对照(NC)组(n=10)、DN组(n=45),DN组大鼠采用 STZ 58 mg/kg一次性腹腔注射法制备DN大鼠模型,NC组腹腔注射等量柠檬酸缓冲液。72h后尾静脉采血测定随机血糖,以血糖>16.7 mmol/L为造模成功,未成模5只剔除。定期监测体重、血糖,24h尿蛋白。8周、12周、18周、24周末处死,留取血和肾组织样本。
血尿生化指标检查血糖、血清尿素氮、肌酐采用全自动生化分析仪(日本日立)测定,24h 尿蛋白量采用双缩脲法测定。
肾脏病理学检查肾组织常规石蜡包埋,切成2 μm厚切片后行PAS、Masson染色。光镜下观察肾小球大小,基膜与系膜基质增生情况,每张切片随机选取20个完整肾小球。
免疫组织化学石蜡切片脱蜡水化,微波修复,SP法免疫组化试剂盒检测肾组织 CD68巨噬细胞数量。所有操作按照说明书进行。用 PBS 代替一抗作为阴性对照。
RAW264.7细胞培养和实验分组在37℃、5%CO2培养箱中培养RAW264.7细胞。当细胞达70%~80%融合时,按照1×105个/ml细胞接种于六孔板,待细胞生长至70%融合时改为无血清培养,12h使其生长同步化后实验。
Western印迹法组织、细胞加裂解液后匀浆、离心,取上清液测蛋白浓度。取等量蛋白样本变性后进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳电泳,转入聚偏二氟乙烯膜,5%封闭专用脱脂牛奶(美国BD)封闭,分别与特异性一抗抗体4℃孵育过夜(均为1∶ 500稀释)。TBST洗膜后加入辣根过氧化物酶标记的二抗(1∶ 1000),室温孵育1~2 h后洗膜。电化学发光(ECL)显色(美国GE Heahhcare),胶片扫描后用Quantity One软件分析灰度值,并计算其与β-actin的比值。
免疫荧光PBS洗后,4%多聚甲醛固定,PBS洗,0.5%Triton-X100通透,PBS洗后1%BSA封闭,加入稀释的一抗,4℃过夜,次日PBS冲洗,加入稀释的二抗,避光孵育,PBS冲洗,最后加入DAPI核染液(碧云天)孵育,PBS洗净。激光共聚焦显微镜下观察LC3、VDAC,iNOS,MR表达,用Image-ProPlus 6.0软件对荧光结果进行半定量分析。
透射电子显微镜待检测的组织或细胞经2.5%的戊二醛固定,制片,用透射电子显微镜(日本,日立)观察线粒体及线粒体自噬体形成及降解的过程。
统计学处理使用SPSS 17.0软件进行数据分析,计量资料以均数±标准差表示,多组比较采用One-Way ANOVA,两两比较采用SNK法检验,两变量间的相关分析采用Pearson相关分析,P<0.05为差异有统计学意义。
结 果
不同时间点实验大鼠血、尿检测,病理特征及巨噬细胞浸润情况随着时间推移,DN组大鼠体重逐渐下降,24h尿蛋白定量、血糖、肾重/体重比值、肌酐和尿素氮显著高于NC组,差异有统计学意义(P<0.05)(表1)。病理染色结果显示DN大鼠肾小球系膜增生,基膜增厚。DN组大鼠肾间质中CD68+巨噬细胞浸润数量显著增多,且随时间延长进行性增加(图1)。

表1 各组大鼠不同时间点指标比较
KW/BW:肾重/体重;SCr:血清肌酐;BUN:尿素氮;NC:正常对照组;*:与NC组比较,P<0.05
DN大鼠肾间质组织自噬与巨噬细胞M1/M2表型密切相关随着DN进展,自噬蛋白LC3在第8周达到最大值而p62达到最低值,提示自噬体生成在8周达到最高峰,且自噬溶酶体降解正常,表明自噬流通畅。8周后,自噬体LC3蛋白逐渐降低,p62升高,提示自噬流障碍。同时,M1标记蛋白iNOS与M2标记蛋白MR的比值随时间延长逐渐升高,且iNOS与LC3呈负相关(r=-0.617,P<0.05),iNOS与p62呈正相关(r=0.894,P<0.05)(图1)。这些结果提示DN大鼠肾组织巨噬细胞M1/M2表型活化与自噬存在密切关系。
DN大鼠肾间质巨噬细胞线粒体形态改变且存在线粒体自噬障碍电镜结果显示正常大鼠肾间质巨噬细胞线粒体结构正常(图1H),存在完整的线粒体自噬过程(图1J~N)。18WDN大鼠肾间质巨噬细胞线粒体肿胀、线粒体嵴消失或数量降低(图1I),自噬体和溶酶体数量显著降低,未观察到完整的线粒体自噬过程(图1O~P)。免疫荧光共聚焦结果显示,DN大鼠肾间质线粒体标记蛋白VDAC和自噬蛋白LC3较NC组降低,共定位表达减少(图1Q),DN组自噬蛋白LC3较NC组降低,而巨噬细胞标记蛋白CD68较NC组升高(图1R)。
高糖干预条件下,RAW264.7细胞向M1型转化且存在线粒体自噬障碍体外研究发现,30 mmol/L葡萄糖干预RAW264.7小鼠巨噬细胞后,M1活化标志物TNF-α、iNOS随着时间延长逐渐升高,同时LC3、Beclin-1表达显著降低,p62明显升高,VDAC逐渐降低(图2)。免疫荧光结果显示,NC组巨噬细胞LC3 和VDAC存在共定位,而30 mmol/L葡糖糖干预24h后LC3 和VDAC表达降低,共定位明显减少,提示高糖诱导的M1型巨噬细胞线粒体自噬存在障碍(图3D)。
高糖干预条件下,调节线粒体自噬能改变巨噬细胞M1/M2表型首先,选择自噬体生成抑制剂(3-MA)和自噬体生成激活剂(RAPA)最佳干预浓度(图3A、B)。1.5 mmol/L的3-MA与100 nmol/L的RAPA用于后续实验。
然后,用1.5 mmol/L的3-MA干预30 mmol/L葡萄糖预处理的巨噬细胞,发现LC3和Beclin-1表达降低,iNOS和TNF-α表达升高,提示抑制巨噬细胞自噬体生成能促进高糖诱导的巨噬细胞进一步向M1型巨噬细胞转化。用100 nmol/L的RAPA干预30 mmol/L葡萄糖预处理的巨噬细胞,发现LC3、Beclin-1、MR和Arg-1表达均升高,提示激活自噬体生成能促进高糖诱导巨噬细胞向的M2型转化(图3)。
最后,通过透射电子显微镜,我们在RAPA 干预组的巨噬细胞中观察到完整的线粒体自噬过程(图4)。
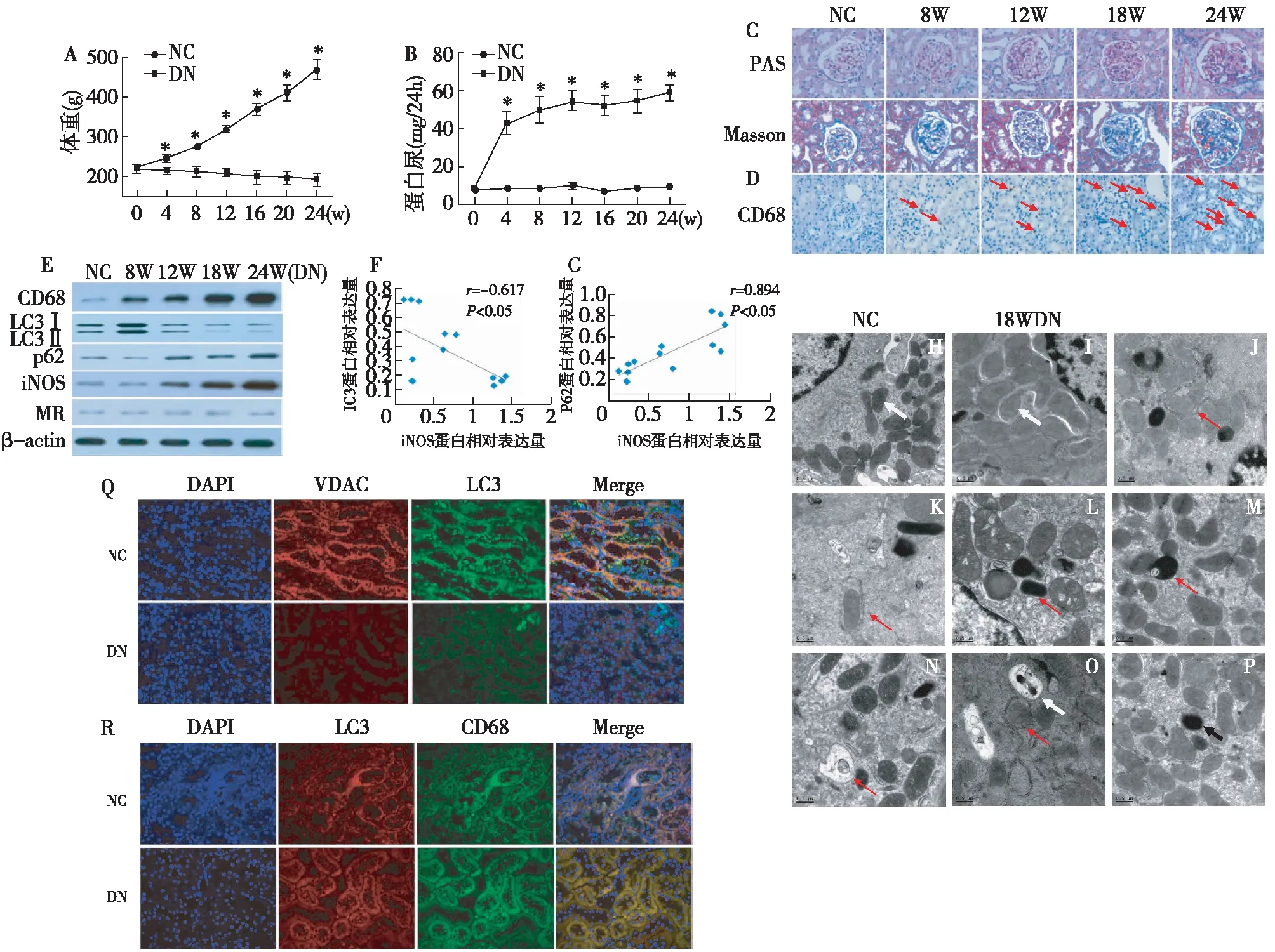
图1 实验动物的基本情况及线粒体自噬和巨噬细胞表型变化A~D:实验动物的基本情况;E~G:线粒体自噬和巨噬细胞表型变化;H~I:大鼠肾组织线粒体形态和自噬;白色箭头:线粒体(×20000);J~N:正常大鼠肾组织完整线粒体自噬过程(×20000);O~P:18W DN大鼠肾组织线粒体自噬;红色箭头:自噬体;白色箭头:自噬溶酶体;黑色箭头:溶酶体(×20000);Q~R:18W大鼠肾组织巨噬细胞线粒体自噬;白色箭头:CD68阳性巨噬细胞(×400);*:与NC组比较,P<0.05(n=10)

图2 不同时间(A)和浓度(B)高糖对RAW264.7细胞表型和线粒体自噬的影响A:在30 mmol/L高糖干预下不同时间后巨噬细胞自噬和表型的变化;B:不同浓度干预24h后巨噬细胞自噬和表型的变化;N:正常对照组,11 mmol/L葡萄糖;HG:高糖组,30 mmol/L葡萄糖;*:与NC组比较,P<0.01 (n=3)

图3 不同干预条件下巨噬细胞线粒体自噬水平及表型变化A、B:不同浓度3-MA与RAPA对RAW264.7细胞活力的影响;*:P<0.05 vs 0 mmol/L 或 0 nmol/L;#:P<0.05 vs 1.0 mmol/L 或50 nmol/L,(n=3);C~F:不同干预条件下RAW264.7细胞Western Blot及免疫荧光结果(×400);NC:正常对照组,11 mmol/L葡萄糖;HG:高糖组,30 mmol/L葡萄糖; Mannitol:等渗对照组,30 mmol/L甘露醇
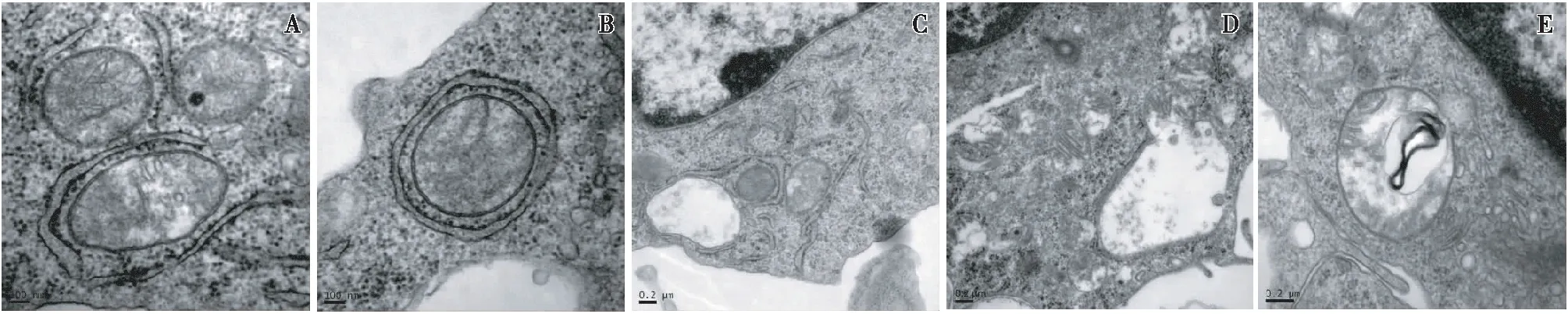
图4 巨噬细胞完整线粒体自噬过程A:隔离膜形成并延伸;B:自噬体的形成;C:溶酶体趋化;D:自噬体与溶酶体融合;E:自噬溶酶体的降解
讨 论
巨噬细胞M1/M2表型活化状态对DN转归和预后有重要影响[2]。探讨巨噬细胞在DN中的表型及其调控机制对于疾病的防治具有重要意义。近年来我们一直致力于研究慢性肾脏病巨噬细胞表型表达规律及其对肾脏病预后的影响。我们前期在DN大鼠模型研究中发现,糖尿病肾组织浸润的巨噬细胞主要以M1型活化为主,M2型巨噬细胞所占比例下降[8];同时体外研究发现,高浓度葡萄糖能诱导巨噬细胞M1型活化[9-10]。随后我们在研究DN患者肾组织标本时发现,人肾组织巨噬细胞在DN早期以M1型为主,晚期以M2型占主导地位。上述研究表明,DN肾组织浸润的巨噬细胞存在M1/M2表型失衡,特定情况下两者可以相互转化并对组织损伤与修复发挥不同作用,然而巨噬细胞表型的调节机制有待进一步研究。
自噬的变化与巨噬细胞功能的调控存在密切联系[11]。Duan等[12]发现促进巨噬细胞自噬体的生成能够修复氧化损伤,并增强巨噬细胞的吞噬功能。Guo等[13]在对db/db小鼠皮肤伤口愈合研究中发现,自噬调节剂IFN调节因子8(IRF8)通过上调巨噬细胞自噬体生成能促进皮肤伤口愈合,并增强巨噬细胞炎症应答效应。上述研究提示,自噬对巨噬细胞功能调节具有关键作用。
线粒体是细胞发生自噬的重要场所[14-15]。Lemasters早在2005年就首次提出线粒体自噬的概念并被广泛关注,为多种代谢相关疾病的研究提供了新方向,但其在肾脏疾病方面的研究仍处于起步阶段[16-17]。在阿霉素诱导的肾小球肾炎动物模型研究中发现,足细胞线粒体自噬流受抑制,肾小球硬化程度和蛋白尿水平明显加重[18]。研究表明,肾脏固有细胞线粒体自噬的异常在肾脏疾病的发生发展中起到重要作用[19-20],然而,对于病理状态下浸润的巨噬细胞线粒体自噬变化及其生物学意义尚不清楚。
本文通过STZ诱导的大鼠模型发现,随着DN的进展,巨噬细胞浸润增多,线粒体自噬水平下降,并且自噬体生成标志物LC3与M1型标志物(iNOS)成负相关((r=-0.617,P<0.05))。我们通过体外培养RAW264.7巨噬细胞,观察到高糖条件下巨噬细胞线粒体自噬水平降低,巨噬细胞向M1分化。RAPA激活自噬体的生成后我们观察到自噬体生成增多的同时巨噬细胞M2型标志物表达增高,而用3-MA抑制自噬体的生成后,巨噬细胞则表达更多的M1型标志物。综上所述,DN大鼠肾组织M1/M2表型与线粒体自噬流水平密切相关,线粒体自噬流可能参与DN大鼠肾组织巨噬细胞M1/M2表型转化。
然而目前线粒体自噬调节巨噬细胞表型的机制尚不清楚。近年来的研究发现,信号转导子和转录激活子(signal transducer and activator of transcription,STATs)是调控巨噬细胞 M1/M2 型活化的关键因子[21]。IFN-γ、LPS 等物质促进巨噬细胞M1活化,这一途径是经由STAT1介导[22]。M2巨噬细胞活化主要由STAT3介导[23]。因此,STAT1/STAT3是调控巨噬细胞 M1/M2 型活化状态的重要环节[24]。Kang等[25]在对胰腺癌的研究中发现,激活自噬能够提高线粒体STAT3的转录活性,促进胰腺癌的发展。但在糖尿病肾脏疾病中,能否通过增强线粒体自噬水平进而升高巨噬细胞STAT3的转录活性,实现巨噬细胞向M2型转化这一机制仍未有研究证明。因此,线粒体自噬调节巨噬细胞的分子学机制及特异性调节线粒体自噬的药物有待进一步研究。
1 Duran-Salgado MB,Rubio-Guerra AF.Diabetic nephropathy and inflammation.World J Diabetes,2014,5(3):393-398.
2 Mantovani A,Biswas SK,Galdiero MR,et al.Macrophage plasticity and polarization in tissue repair and remodelling.J Pathol,2013,229(2):176-185.
3 Huen SC,Huynh L,Marlier A,et al.GM-CSF Promotes Macrophage Alternative Activation after Renal Ischemia/Reperfusion Injury.J Am Soc Nephrol,2015,26(6):1334-1345.
4 Zhang X,Zhou M,Guo Y,et al.1,25-Dihydroxyvitamin D3Promotes High Glucose-Induced M1 Macrophage Switching to M2 via the VDR-PPARγ Signaling Pathway.Biomed Res Int,2015,2015:157834.
5 Xue Z,Yuan W,Li J,et al.Cyclophilin A mediates the ox-LDL-induced activation and apoptosis of macrophages via autophagy.Int J Cardiol,2017,230:142-148.
6 Zhao C,Chen Z,Xu X,et al.Pink1/Parkin-mediated mitophagy play a protective role in cisplatin induced renal tubular epithelial cells injury.Exp Cell Res,2017,350(2):390-397.
7 高聪普,白寿军.自噬与糖尿病肾病肾脏固有细胞的损伤.肾脏病与透析肾移植杂志,2017,26(1):68-71.
8 Zhang XL,Guo YF,Song ZX,et al.Vitamin D prevents podocyte injury via regulation of macrophage M1/M2 phenotype in diabetic nephropathy rats.Endocrinology,2014,155(12):4939-4950.
9 Zhang X,Zhou M,Guo Y,et al.1,25-Dihydroxyvitamin D3Promotes High Glucose-Induced M1 Macrophage Switching to M2 via the VDR-PPARγ Signaling Pathway.Biomed Res Int,2015,2015:157834.
10 Song Z,Guo Y,Zhou M,et al.The PI3K/p-Akt signaling pathway participates in calcitriol ameliorating podocyte injury in DN rats.Metabolism,2014,63(10):1324-1333.
11 Zhou H,Li D,Zhu P,et al.Melatonin suppresses platelet activation and function against cardiac ischemia/reperfusion injury via PPARγ/FUNDC1/mitophagy pathways.J Pineal Res,2017,63(4).
12 Duan WJ,Li YF,Liu FL,et al.A SIRT3/AMPK/autophagy network orchestrates the protective effects of trans-resveratrol in stressed peritoneal macrophages and RAW 264.7 macrophages.Free Radic Biol Med,2016,95:230-242.
13 Guo Y,Lin C,Xu P,et al.AGEs Induced Autophagy Impairs Cutaneous Wound Healing via Stimulating Macrophage Polarization to M1 in Diabetes.Sci Rep,2016,6:36416.
14 Zhang Y,Ling Y,Yang L,et al.Liraglutide relieves myocardial damage by promoting autophagy via AMPK-mTOR signaling pathway in zucker diabetic fatty rat.Mol Cell Endocrinol,2017,448:98-107.
15 Orhon I,Reggiori F.Assays to Monitor Autophagy Progression in Cell Cultures.Cells,2017,6(3).pii:E20.
16 Benischke AS,Vasanth S,Miyai T,et al.Activation of mitophagy leads to decline in Mfn2 and loss of mitochondrial mass in Fuchs endothelial corneal dystrophy.Sci Rep,2017,7(1):6656.
17 Huenchuguala S,Muoz P,Segura-Aguilar J.The Importance of Mitophagy in Maintaining Mitochondrial Function in U373MG Cells.Bafilomycin A1 Restores Aminochrome-Induced Mitochondrial Damage.ACS Chem Neurosci,2017,8(10):2247-2253.
18 Chuang PY,Xu J,Dai Y,et al.In vivo RNA interference models of inducible and reversible Sirt1 knockdown in kidney cells.Am J Pathol,2014,184(7):1940-1956.
19 Zhan M,Usman IM,Sun L,et al.Disruption of renal tubular mitochondrial quality control by Myo-inositol oxygenase in diabetic kidney disease.J Am Soc Nephrol,2015,26(6):1304-1321.
20 Xiao T,Guan X,Nie L,et al.Rapamycin promotes podocyte autophagy and ameliorates renal injury in diabetic mice.Mol Cell Biochem,2014,394(1-2):145-154.
21 Zhou D,Huang C,Lin Z,et al.Macrophage polarization and function with emphasis on the evolving roles of coordinated regulation of cellular signaling pathways.Cell Signal,2014,26(2):192-197.
22 Darnell JE,Kerr IM,Stark GR.Jak-STAT pathways and transcriptional activation in response to IFNs and other extracellular signaling proteins.Science,1994,264(5164):1415-1421.
23 Gordon S,Martinez FO.Alternative activation of macrophages:mechanism and functions.Immunity,2010,32(5):593-604.
24 Yue S,Rao J,Zhu J,et al.Myeloid PTEN deficiency protects livers from ischemia reperfusion injury by facilitating M2 macrophage differentiation.J Immunol,2014,192(11):5343-5353.
25 Kang R,Loux T,Tang D,et al.The expression of the receptor for advanced glycation endproducts (RAGE) is permissive for early pancreatic neoplasia.Proc Natl Acad Sci U S A,2012,109(18):7031-7036.

