抗肾小球基膜病合并 IgA 肾病或膜性肾病的临床病理特征分析
张 帆 童 玲 高二志 梁少姗 张明超 曾彩虹 王金泉
抗肾小球基膜(GBM)病是由抗 GBM 抗体介导的肾小球和(或)肺毛细血管广泛损害的自身免疫疾病。该病发病率不高,但多数患者起病急骤,病情笃重,进展迅速,预后差。抗 GBM 病常与抗中性粒细胞胞质抗体ANCA相关血管炎合并存在[1-2],与原发性肾小球肾炎合并存在者多以个案报道为主[3-7]。IgA肾病(IgAN)和膜性肾病(MN) 是临床常见的原发性肾小球疾病。临床工作中我们发现抗 GBM 疾病常与 IgAN 或 MN 合并存在,其起病相对较缓,病情相对较轻,预后相对较好。为此,我们对2004年以来在南京总医院国家肾脏疾病临床医学研究中心明确诊断的单纯抗 GBM 病与伴IgAN或 MN的抗 GBM 病进行回顾性研究,以分析其临床病理特征和预后差异。
对象和方法
病例选择选取2004年1月~2015年12月经肾活检明确诊断患者中,排除抗GBM病合并其他肾病的患者后,分为三组:单纯抗GBM病患者60例(单纯抗 GBM 病组),包括Goodpasture病20例,抗GBM肾炎40例;抗GBM病合并IgAN者10例(抗 GBM 病合并IgAN组);抗GBM病合并MN者5例(抗 GBM 病合并MN组)。
临床资料与实验室检查采集临床数据,包括一般情况、易感因素、临床表现。实验室检查包括:(1)血液检查:血红蛋白、最高血清肌酐、尿素氮、白蛋白、球蛋白、总胆固醇、IgG、补体 C3、C4、抗GBM抗体(间接免疫荧光法和(或)ELISA 法)、抗磷脂酶 A2受体(抗PLA2R)抗体等;(2)尿液检查:尿红细胞计数(RBC)、尿蛋白定量、N-乙酸-β-D-氨基葡萄糖苷酶(NAG),视黄醇结合蛋白(RBP)。
相关定义镜下血尿指尿沉渣红细胞计数≥1.0万/ml,肉眼血尿指尿中出血量超过1 ml/L,肉眼可见的血样或洗肉水样尿。急性肾炎综合征指急性起病,以血尿为主要表现,一般尿蛋白定量<3.5 g/24h,起病初期可伴有水肿,尿量减少和高血压,可有一过性氮质血症。急进性肾小球肾炎(RPGN)指在肾炎综合征基础上短期内出现少尿、无尿,肾功能急剧下降。NS定义为大量蛋白尿(尿蛋白定量≥3.5 g/24 h)和低白蛋白血症(血清白蛋白<30 g/L),伴或不伴高脂血症或重度水肿。终末期肾病(ESRD)为SCr≥530.4 μmol/L,或肾脏替代治疗超过3个月。高血压指成人静息收缩压≥140 mmHg和(或)舒张压≥90 mmHg。
组织学检查所有肾活检组织标本均常规行光镜、免疫荧光、电镜检查。合并MN患者,完善肾组织PLA2R检测。
诊断标准抗GBM病具有IgG沿GBM 线状沉积、肺泡出血和血清抗 GBM 抗体阳性者,称为Goodpasture病;仅有肾损害者称为抗GBM肾炎。抗 GBM 病合并 IgAN 诊断标准为:在符合抗 GBM 病的诊断条件下,免疫病理见肾小球系膜区有以IgA为主的免疫复合物沉积,电镜下见系膜区或系膜旁区电子致密物沉积,同时临床上排除过敏性紫癜、自身免疫性疾病等继发性 IgAN。抗 GBM 病合并 MN 的诊断标准为:在符合抗 GBM 病的诊断条件下,肾脏病理光镜下可见上皮侧免疫复合物沉积,可有钉突形成,电镜下可见GBM上皮侧电子致密物沉积,同时排除病毒、自身免疫性疾病等继发性 MN。
统计学分析所有数据采用SPSS 24.0软件分析,计量资料根据是否正态分布以均数±标准差或中位数(25%分位数~75%分位数)表示。计数资料采用百分比表示。组间均值比较采用单因素 ANOVA检验或独立样本 Kruskal-Wallis 检验,多组之间率的比较采用Fisher精确概率检验。肾存活率采取Kaplan-Meier生存分析。P<0.05为差异有统计学意义。
结 果
流行病学与临床表现合并 MN 组患者起病年龄较小,男性比例较高,单纯抗GBM病组上呼吸道感染/发热的比例相对较高,但无统计学意义(表1)。三组患者首发临床症状有多种表现,合并IgAN 组患者首发症状以肉眼血尿(50%)为主,合并 MN 组患者以水肿(60%)为主,单纯抗 GBM病组患者以肉眼血尿(28.3%)及水肿(25.0%)为主,但无统计学意义。大部分患者起病急骤,合并IgAN 组患者表现为急性肾炎综合征相对较多,合并MN组患者表现为 NS相对较多,单纯抗GBM组患者表现为 RPGN、高血压及无尿的比例明显较高,具有统计学差异(表1)。

表1 三组患者一般情况及临床特征
IgAN:IgA肾病;MN:膜性肾病;GBM:肾小球基膜;*:P为合并IgAN 组、合并MN组、单纯抗GBM组三组患者的P值,下表相同
实验室检查合并MN组患者尿蛋白定量较高,且低蛋白血症较明显,合并IgAN组尿RBC计数较高,但均无统计学性差异。单纯抗GBM病组贫血最重、血清肌酐峰值最高(P均<0.001),血尿素氮、抗GBM 抗体滴度也较高(表2)。合并 MN 组患者血液抗-PLA2R抗体均阴性。
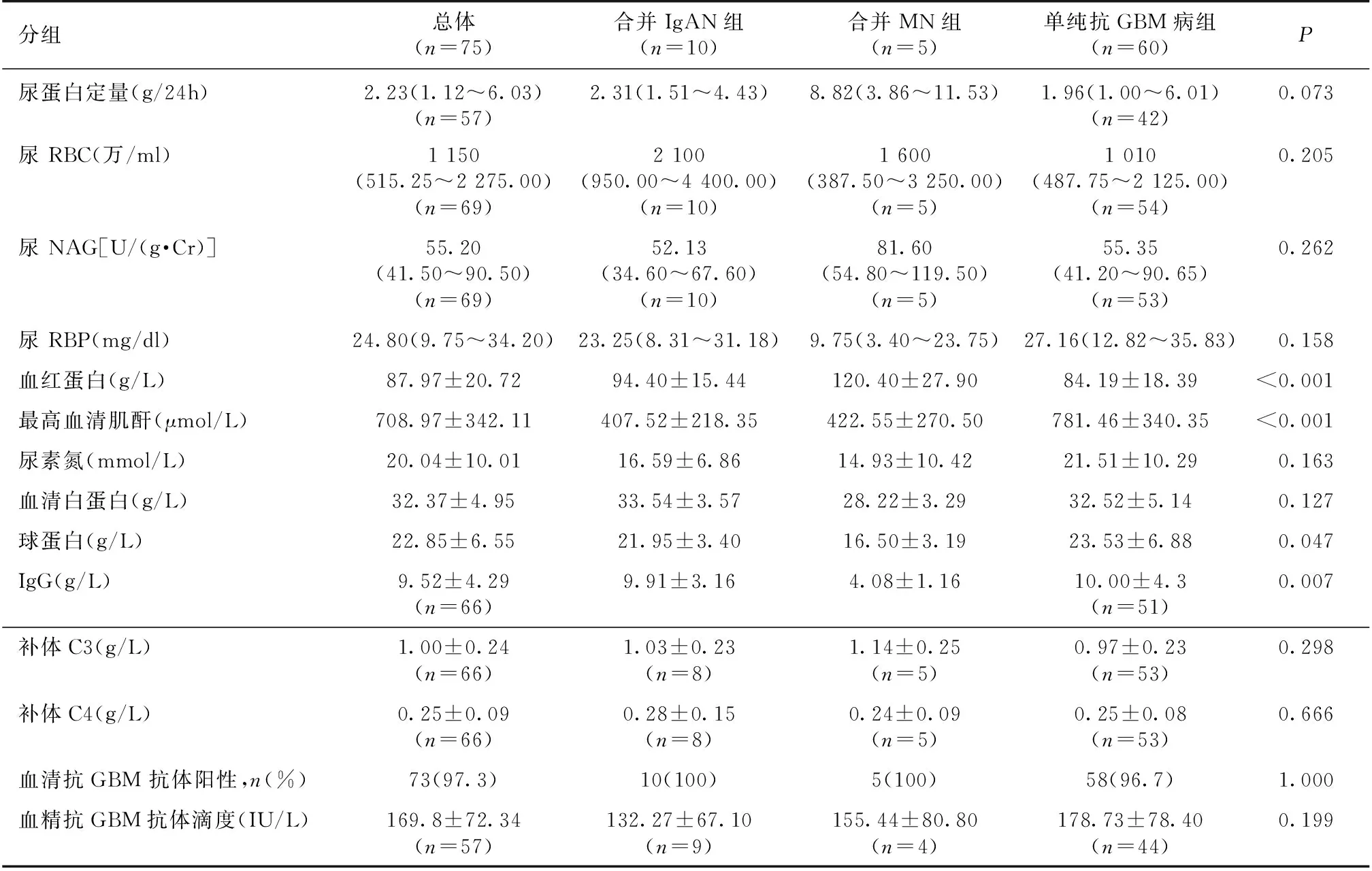
表2 三组患者实验室检查结果
尿RBC:尿沉渣红细胞计数;NAG:N-乙酰-β-D-氨基葡萄糖苷酶;RBP:视黄醇结合蛋白;GBM:肾小球基膜;MN:膜性肾病;IgAN:IgA肾病
肾脏病理合并IgAN 组和合并MN组患者中总新月体比例明显低于单纯抗 GBM病组(P=0.008)。合并IgAN 组与单纯抗GBM病组患者中包囊壁断裂及肾小管间质纤维化较合并 MN 组严重(P=0.005)(表3)。合并 MN 组中仅1例患者肾组织PLA2R阳性。
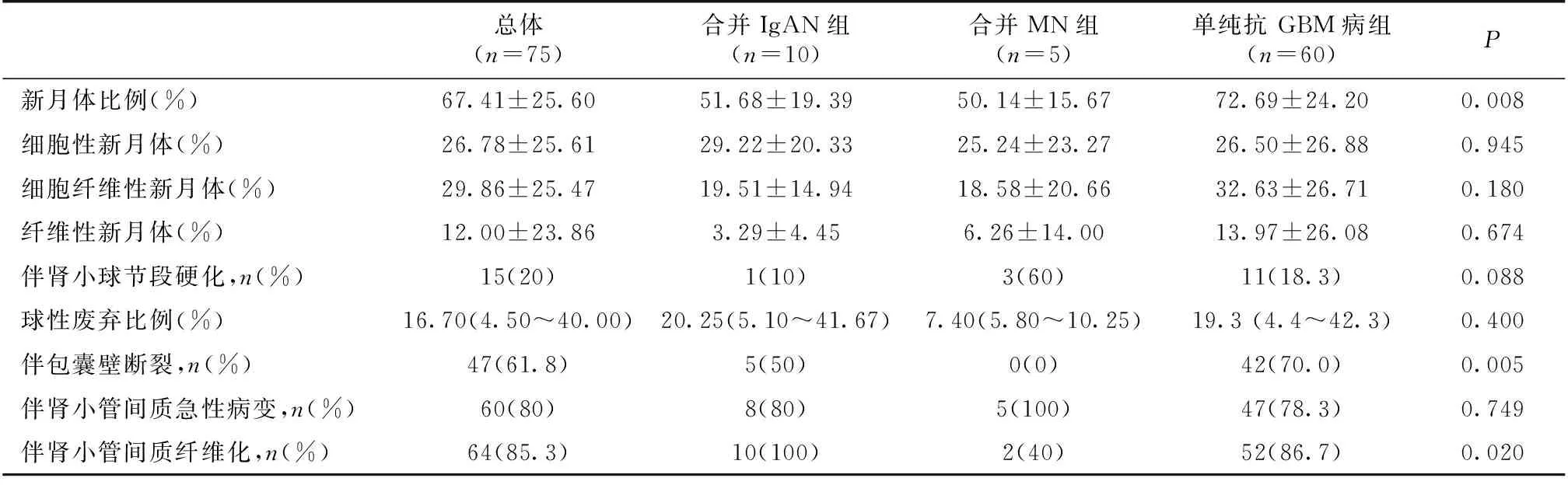
表3 三组患者组织病理学特征
GBM:肾小球基膜;MN:膜性肾病;IgAN:IgA肾病
治疗起病时单纯抗 GBM组需行连续肾脏替代治疗(CRRT)治疗比例最高(P=0.008),需要行血浆置换或免疫吸附治疗的患者最多(表4)。

表4 三组患者治疗及预后[n(%)]
CRRT:连续性肾脏替代治疗;MP:甲泼尼龙;CTX:环磷酰胺;ESRD:终末期肾病
随访及预后合并IgAN组患者4例(50%)1年内进入 ESRD,失访2例,合并 MN 组患者随访4例,1年内均未进入ESRD,1例患者在发病第4年进入 ESRD。单纯抗 GBM病组39例(86.7%)患者1年内进入ESRD患者,失访15例(表4)。单纯抗 GBM病组患者肾存活率最低,合并MN 组患者肾存活率最高(P=0.006)(图1)。
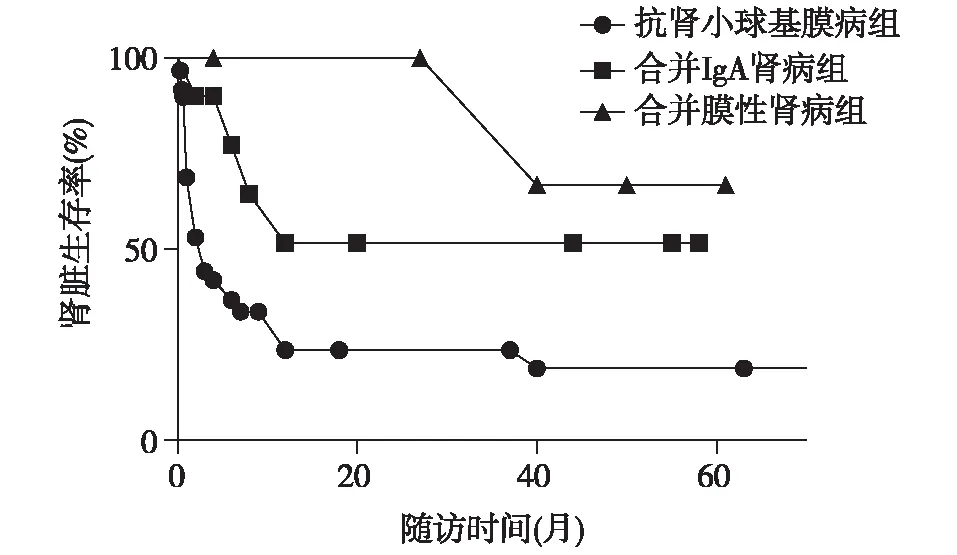
图1 三组患者肾存活率曲线
讨 论
系列研究显示抗GBM 病好发年龄呈双峰表现,30岁左右为高发年龄, 60~70岁为第二个高峰[8]。IgAN发生以青壮年为主,MN 发病年龄以>40岁多见,近年MN发病有年轻化的趋势。本研究中,单纯抗GBM病高发的两个年龄段为20~30岁及40~50岁,老年患者比例相对较少,说明抗GBM病有年轻化趋势。合并IgAN及 MN的患者发病年龄均与单纯抗GBM病相似。在西方国家,IgAN在人群中的年发病率约为10~40/10万人口[9],MN的年发病率约为(0.4~1.01)/10万人口[10]。本研究抗GBM病患者人群中IgAN 及 MN发病率远远高于普通人群。IgAN 起病通常隐匿,抗 GBM 病起病急骤,合并 IgAN 的抗 GBM 病的患者在起病前可能存在隐匿性IgAN,其肾小球局部损伤导致了 GBM隐蔽的靶抗原暴露,促进了抗GBM病的发生。MN 和抗 GBM 病可以同时发生,也可以先后发生[3-5],推测无论是何种疾病在先,均可造成 GBM 损伤,导致隐蔽的抗原决定簇暴露,从而导致另一种疾病。因而相对于没有基础肾脏病变局部因素,而单纯源于全身因素造成的抗 GBM 病,合并 IgAN 或 MN 的抗GBM病临床表现及预后相对较好。
本研究中合并IgAN组患者病程中临床表现及病理特征均较抗 GBM 病轻,肉眼血尿的发生率明显高于单纯抗 GBM 病,临床表现除RPGN外,亦有部分患者表现为急性肾炎综合征而无急性肾功能衰竭,表现出 IgAN 的特点。合并MN组较多患者首发症状为水肿,病程中可出现大量蛋白尿,水肿和低蛋白血症,表现出MN的特点。但与单纯MN不同,合并 MN 的抗 GBM 病组患者病程主要表现RPGN ,肉眼血尿比例也明显升高,兼具 MN 及抗GBM病的特点,与抗GBM病组相比,合并MN组患者病情较轻。因此,当抗 GBM 病临床症状不典型时,应考虑合并其他肾小球疾病的可能。
抗GBM病合并IgAN发病原因未明,本研究中10例患者既往无肾脏病史,均为首次确诊为抗GBM病合并IgAN。结合流行病学资料,推测这些病人既往可能有隐匿性IgAN。有研究表明DRB1*15,DRB1*04基因为抗 GBM 病及系膜增生性IgAN的共同易感基因[11-12],亦有实验发现 IgAN 中肾小球浸润的炎症细胞可以产生二十烷酸及氧自由基等物质,进一步诱导炎症及免疫反应,造成GBM损伤、隐蔽的抗原表位暴露,进而产生抗体,介导抗GBM病[13]。目前未见有抗GBM病患者在随访过程中出现病情变化,再次肾活检提示合并IgAN的病例报道,进一步证明了 IgAN 造成的局部病理改变可能为抗 GBM 病的肾脏局部致病因素。IgAN临床表现多样,若非合并抗 GBM 病,其 IgAN 可能还会隐匿。关于抗 GBM病合并MN的原因未明,本研究中5例患者血清抗PLA2R抗体均阴性,仅1例MN在先,抗GBM病在后的患者肾组织抗PLA2R抗体阳性,明显低于原发性MN中抗PLA2R抗体的阳性检出率[14],尽管该5例患者均未查血小板结构域蛋白7,但亦未找到其他引起膜性肾病的继发因素。本研究中4例MN与抗GBM病同时诊断,通常MN起病隐匿而抗GBM病起病急骤,但本研究中合并MN的患者平均发病年龄较小,好发年龄与抗GBM病相似,因此,抗GBM病与MN的关系有待于进一步研究。1例患者先发 MN 后再发抗GBM病,其肾组织PLA2R阳性,从自然病程上看,推测先有肾组织膜性病变,然后出现抗 GBM 病。
2012年KDIGO临床实践指南推荐对于抗GBM病的标准治疗主要包括血浆置换,糖皮质激素、CTX等治疗[15]。伴原发性肾小球肾炎的患者,通常采取抗GBM病的标准治疗。本中心依据病情,均采取了MP冲击治疗,血清肌酐高、抗体滴度较高及肺出血的患者采取血浆置换或免疫吸附,并建议进一步CTX治疗,但较多严重患者考虑经济因素,放弃血浆置换及CTX治疗,回当地透析治疗,预后较差。
崔昭等研究发现预示抗 GBM 病预后较差的因素:(1)患者确诊时血清肌酐>600μmol/L;(2)病程中出现少尿或者无尿;(3)肾活检提示新月体≥85%者;(4)以RPGN为首发表现者[16]。本研究中观察与之类似。本研究中发病1年内,抗 GBM 病肾脏失活率最高(86.7%),合并 IgAN 组或合并 MN 组预后均明显优于抗 GBM 病组,与Jia等[17]学者报道相似。抗 GBM 抗体是导致抗 GBM病的直接因素,其主要靶抗原为Ⅳ型胶原α3链的NC1结构域[α3(Ⅳ)NC1],部分抗体也可识别α4和α5链的 NC1结构域[18]。有学者曾报道,识别α5链的NC1结构域抗体水平与细胞性新月体比例呈正相关,可能与疾病严重程度相关[19]。Jia 等[17]发现,合并MN的患者,其抗体主要识别α3(Ⅳ)NC1,对于其他的如α4、α5链识别较少。识别α3(Ⅳ)NC1的抗体亚型以IgG2、 IgG4为主。而抗 GBM 病中IgG1与IgG3亚型致病作用较强,多见于严重的病例[20]。因此合并 MN 的患者预后优于单纯抗 GBM 病,合并IgAN预后优于单纯抗GBM 病的机制也可能与之相似。
小结:本研究表明合并IgAN或MN的抗GBM病在临床表现、实验室检查、病理及预后均不同于单纯抗GBM病。抗 GBM 病合并 IgAN 或 MN 确切机制有待于进一步研究。
(致谢:感谢国家肾脏疾病临床医学研究中心生物样本库提供病理支持)
1 Hellmark T,Niles JL,Collins AB,et al.Comparison of anti-GBM antibodies in sera with or without ANCA.J Am Soc Nephrol,1997,8(3):376-385.
2 崔昭,贾晓玉,赵明辉.合并膜性肾病的抗肾小球基底膜病患者的临床及免疫学特点.中华内科杂志,2015,54(3):223.
3 Moorthy AV,Zimmerman SW,Burkholder PM,et al.Association of crescentic glomerulonephritis with membranous glomerulonephropathy:a report of three cases.Clin Nephrol,1976,6(1):319-325.
4 Kurki P,Helve T,von BM,et al.Transformation of membranous glomerulonephritis into crescentic glomerulonephritis with glomerular basement membrane antibodies.Serial determinations of anti-GBM before the transformation.Nephron,1984,38(2):134-137.
5 梁少姗,曾彩虹,刘志红.抗肾小球基膜肾炎合并膜性肾病.肾脏病与透析肾移植杂志,2013,22(4):391-395.
6 Gao B,Li M,Xia W,et al.Rapidly progressive glomerulonephritis due to anti-glomerular basement membrane disease accompanied by IgA nephropathy:a case report.Clin Nephrol,2014,81(2):138-141.
7 Xu D,Wu J,Wu J,et al.Novel therapy for anti-glomerular basement membrane disease with IgA nephropathy:A case report.Exp Ther Med,2016,11(5):1889-1892.
8 Kluth DC,Rees AJ.Anti-glomerular basement membrane disease.J Am Soc Nephrol,1999,10(11):2446-2453.
9 Wyatt RJ,Julian BA.IgA nephropathy.N Engl J Med,2013,368(25):2402-2414.
10 Maixnerova D,Jancova E,Skibova J,et al.Nationwide biopsy survey of renal diseases in the Czech Republic during the years 1994-2011.J Nephrol,2015,28(1):39-49.
11 Fisher M,Pusey CD,Vaughan RW,et al.Susceptibility to anti-glomerular basement membrane disease is strongly associated with HLA-DRB1 genes.Kidney Int,1997,51(1):222-229.
12 赖寒,甘华.系膜增生性IgA肾病患者HLA-DRB1基因分型的研究.中国免疫学杂志,2015,(11):1528-1531.
13 Trpkov K,Abdulkareem F,Jim K,et al.Recurrence of anti-GBM antibody disease twelve years after transplantation associated with de novo IgA nephropathy.Clin Nephrol,1998,49(2):124-128.
14 Hoxha E,Kneißler U,Stege G,et al.Enhanced expression of the M-type phospholipase A2 receptor in glomeruli correlates with serum receptor antibodies in primary membranous nephropathy.Kidney Int,2012,82(7):797-804.
15 Beck L,Bomback AS,Choi MJ,et al.KDOQI US commentary on the 2012 KDIGO clinical practice guideline for glomerulonephritis.Am J Kidney Dis,2013,62(3):403-441.
16 崔昭,赵明辉,刘玉春,等.抗肾小球基底膜抗体相关疾病的预后研究.临床内科杂志,2004,21(10):677-680.
17 Jia XY,Hu SY,Chen JL,et al.The clinical and immunological features of patients with combined anti-glomerular basement membrane disease and membranous nephropathy.Kidney Int,2014,85(4):945-952.
18 Dehan P,Weber M,Zhang X,et al.Sera from patients with anti-GBM nephritis including goodpasture syndrome show heterogenous reactivity to recombinant NC1 domain of type IV collagen alpha chains.Nephrol Dial Transplant,1996,11(11):2215-2222.
19 崔昭,贾晓玉,刘畅,等.识别不同靶抗原的抗肾小球基底膜抗体与临床表型相关.中国血液净化,2010,9(3):147-151.
20 Zhao J,Yan Y,Gui Z,et al.The immunoglolin G subclass distribution of anti-GBM autoantibodies against rHalpha3(Ⅳ) NC1 is associated with disease severity. Hum Immunol, 2009,70(6):425-429.

