肾脏疾病患者继发免疫缺陷与肺孢子菌肺炎
孙 丹 许书添 郭锦洲 周玉超 董建华 刘志红 李世军
肺孢子菌肺炎(PCP)是由子囊真菌耶氏肺孢子菌(PJP)引起的机会性感染,多见于感染人免疫缺陷病毒(HIV)人群。近年来,随着器官移植患者的增多,以及免疫抑制剂广泛、大剂量、联合应用,非HIV获得性免疫缺陷PCP患者日渐增多[1]。近10年来,PCP中非HIV患者与HIV患者比例从1.7 迅速升至5.6[2]。国内外有关非HIV免疫缺陷患者PJP感染已有研究主要集中于血液系统疾病、实体肿瘤及类风湿疾病[3-4]。肾脏疾病免疫缺陷患者合并PCP仅有少量的病例报告[5-6],本研究回顾性分析慢性肾脏病(CKD)患者继发免疫缺陷与PCP的临床资料,探讨免疫功能状态与预后的关系,以提高该病的诊疗水平。
对象和方法
研究对象选取2013-10-07至2017-05-15因慢性肾脏病(CKD)接受免疫抑制治疗并发肺部感染入住国家肾脏疾病临床研究中心重症监护病房(ICU)的患者。
入选标准(1)CKD且继发性免疫缺陷患者;(2)高分辨率CT(HRCT)或胸片呈双肺弥漫性间质改变,除外肺水肿;(3)血清1,3-β-D葡聚糖试验(真菌G试验)阳性(>60 pg/ml)伴乳酸脱氢酶升高(>618 U/L)。
排除标准(1)真菌G试验阴性或缺失;(2)起病时合并其他真菌感染;(3)入院3天内放弃治疗;(4)入ICU前已予抗PCP或机械通气治疗超过1周。
相关定义临床诊断PCP:指肺部影像学呈双肺弥漫性间质改变、真菌G试验阳性且乳酸脱氢酶升高[3-4]。继发性免疫抑制:参照HIV继发免疫抑制标准,即外周血CD4+淋巴细胞<200/μl[7]。急性呼吸窘迫综合征(ARDS):指肺部急性病变导致的以低氧血症为特征的临床综合征,参考 2012年柏林标准[8],即氧合指数[动脉氧分压(PaO2)/吸入氧浓度(FiO2)]≤300 mmHg、呼吸末正压或持续气道正压≥5cmH2O;根据氧合指数将ARDS分为轻度(200~300 mmHg)、中度(100~200 mmHg)及重度(<100 mmHg)。全身性感染相关性器官功能衰竭(SOFA)评分,描述危重症患者并发症的评分,对呼吸、凝血、肝脏等六个系统或器官功能评估,参照第三次脓毒症和脓毒症休克定义国际共识[9]。加强免疫抑制治疗:在原有治疗方案基础上增加激素剂量或予大剂量激素冲击或/和加用或加强免疫抑制剂(如将他克莫司切换为吗替麦考酚酯)。
观察资料收集患者的性别、年龄、基础疾病、激素及免疫抑制剂使用情况、住院时间、起病时临床表现、胸部影像学检查结果、氧合功能、淋巴细胞计数、CD4+细胞计数、SOFA评分、降钙素原、真菌G试验、乳酸脱氢酶以及治疗转归情况等资料。
统计学方法采用SPSS 18.0统计软件进行统计分析。计量资料用均值±标准差表示。符合正态分布者,组间比较采用独立样本t检验;不符合正态分布者,组间比较采用秩和检验;定性资料以频数(%)表示,采用卡方检验、Fisher精确检验进行比较;P<0.05为差异有统计学意义。重复测量资料采用协方差分析。单因素分析采用Logistic回归分析。将单因素分析中P<0.2的变量放入多变量模型进行筛选。多因素分析前,予共线性检测,条件指数小于10时进入多因素Logistic 回归模型分析,采用后退LR方法进行多因素筛选。采用ROC曲线的曲线下面积确定阈值。
结 果
一般情况2013-10-07至2017-05-15因继发免疫抑制并发肺部感染入住ICU的CKD患者共202例,排除肺部影像学呈局灶、渗出性或空洞等非间质性改变者93例,排除真菌G试验阴性或缺失者48例,排除入院前抗PCP或机械通气治疗超过1周或入院3天内放弃治疗或合并真菌及其他病原菌感染者共9例。最后,共入组患者52例,男女各26例,平均年龄45.8±14.4岁,从发病到入住ICU的平均时间为7.3±3.6d。
基础疾病及免疫抑制剂使用史14例患者为同种异体肾移植术后;38例为自体肾脏病,包括17例肾病综合征(6例膜性肾病、4例局灶性节段性肾小球硬化、4例足细胞病、3例未行活检)、10例狼疮性肾炎、7例IgA肾病、2例过敏紫癜性肾炎、2例ANCA相关性肾炎。所有患者感染前均曾予免疫抑治疗,35例患者在感染前2~4个月加用或加强免疫抑制治疗,16例加用或加强治疗12个月内发生PCP。所有患者在感染前均使用激素治疗,16例激素联合一种免疫抑制剂,22例联合多种免疫抑制剂(表1)。
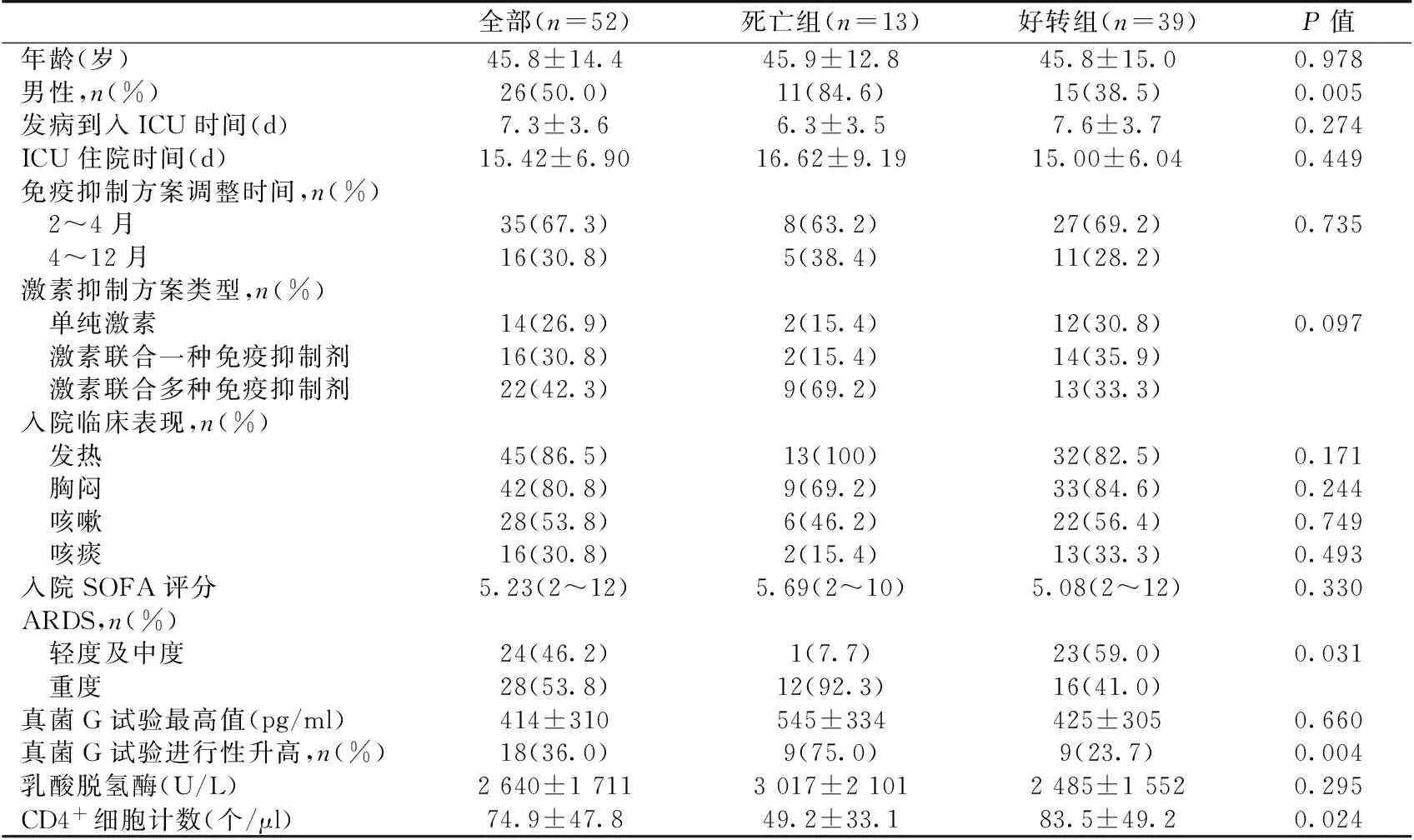
表1 入组患者的一般情况
ARDS:急性呼吸窘迫综合征;真菌G试验:真菌1,3-β-D葡聚糖试验;SOFA评分:全身性感染相关性器官功能衰竭评分
临床表现及影像检查发热、胸闷为最常见的临床症状;53.8%患者表现为咳嗽,仅30.8%患者有少量咳痰表现。所有患者均合并ARDS。有2例患者因呼吸困难不能外出仅行床边胸片检查;余均行HRCT检查。所有患者影像学均呈双肺弥漫性间质性改变,表现为双肺弥漫性磨玻璃样影、斑片影、云絮影或网状影(图1)。
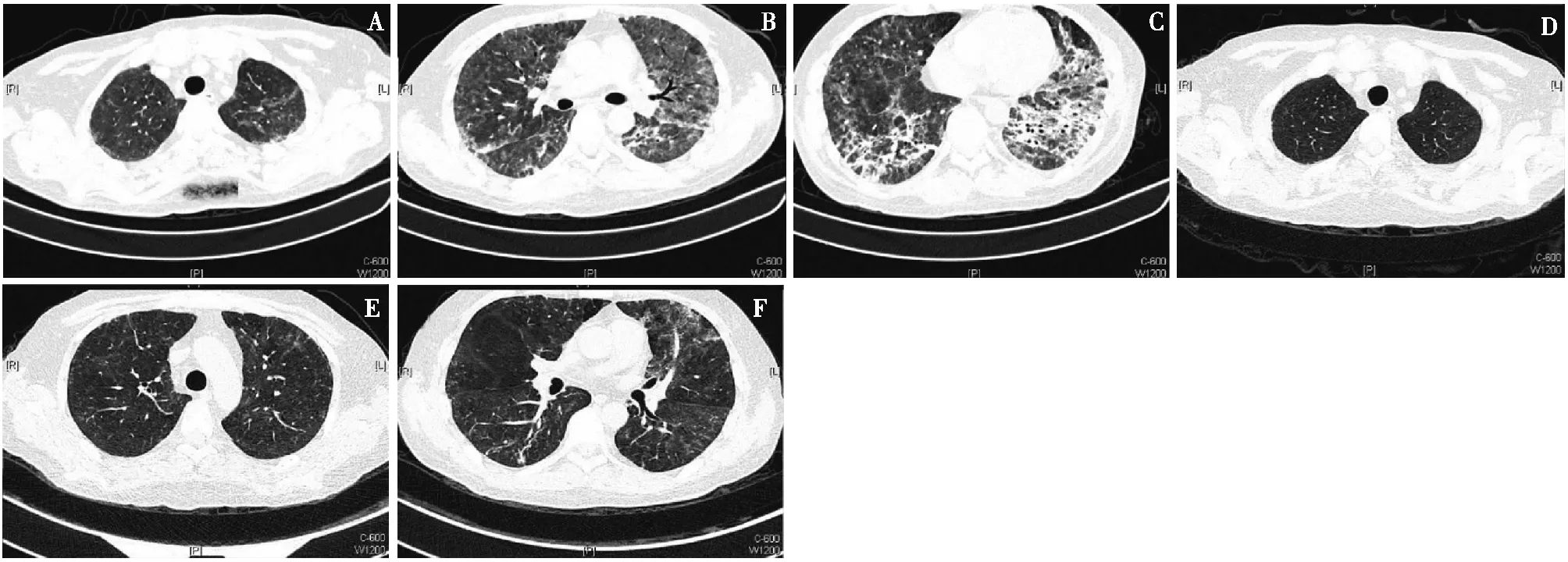
图1 PCP患者的高分辨率CT表现23岁男性患者,基础病为足细胞病;入院前氧合指数105 mmHg,降钙素原0.072 μg/L,G试验241.6 pg/ml,胸部CT(A、B、C)两肺呈磨玻璃样改变,伴弥漫性斑片状、条索状及网格状改变;治疗后两肺(D、E、F)病灶明显吸收
病原学有2例患者未动态监测真菌G试验,8例患者治疗后真菌G试验进一步升高,余真菌G试验下降。入院时20例患者降钙素原(PCT)在正常范围(<0.5 μg/L),21例轻度升高(0.5~2 μg/L),仅11例显著升高(>2 μg/L)。21例患者在治疗过程中合并混合型肺部感染,最常见为鲍曼复合不动杆菌(8例),其余依次为侵袭性曲霉(6例)、铜绿假单胞菌(4例)、金黄色葡萄球菌(2例)、大肠杆菌(1例)和肺炎克雷伯杆菌(1例)。另5例治疗过程中再次出现白细胞计数、PCT、体温升高和/或复查胸部CT肺实质出现渗出性病变等表现,临床考虑合并细菌感染,但病原学检测为阴性。
治疗与预后所有患者均予复方磺胺甲噁唑联合卡泊芬净,4例因治疗1周后无明显好转联合二线药物克林霉素治疗PCP。所有患者在使用抗生素的同时予甲泼尼龙80 mg/d抗炎。所有患者均需要氧疗,6例鼻导管给氧,20例面罩给氧,11例使用无创呼吸机,15例气管插管或切开。经上述治疗后39例(75%)病情好转,转普通病房;13例死亡(25%)。平均ICU住院时间15.4±6.9d。
危险因素分析根据预后分为死亡组与好转组,影响预后因素,特别是免疫功能状态与预后的关系进行分析。
单因素Logistic回归分析提示肾移植术后继发感染、CD4+细胞计数低、真菌G试验进行性升高、重度ARDS是PCP患者的预后不佳的危险因素。多因素Logistic回归分析,以原发肾脏病类型、入院SOFA评分、CD4+细胞计数、真菌G试验动态变化为自变量建立Logistic 回归模型,予共线性检测,条件指数为8.2。结果显示CD4+细胞计数低、真菌G试验进行性升高、重度ARDS是PCP死亡的独立危险因素(表2)。
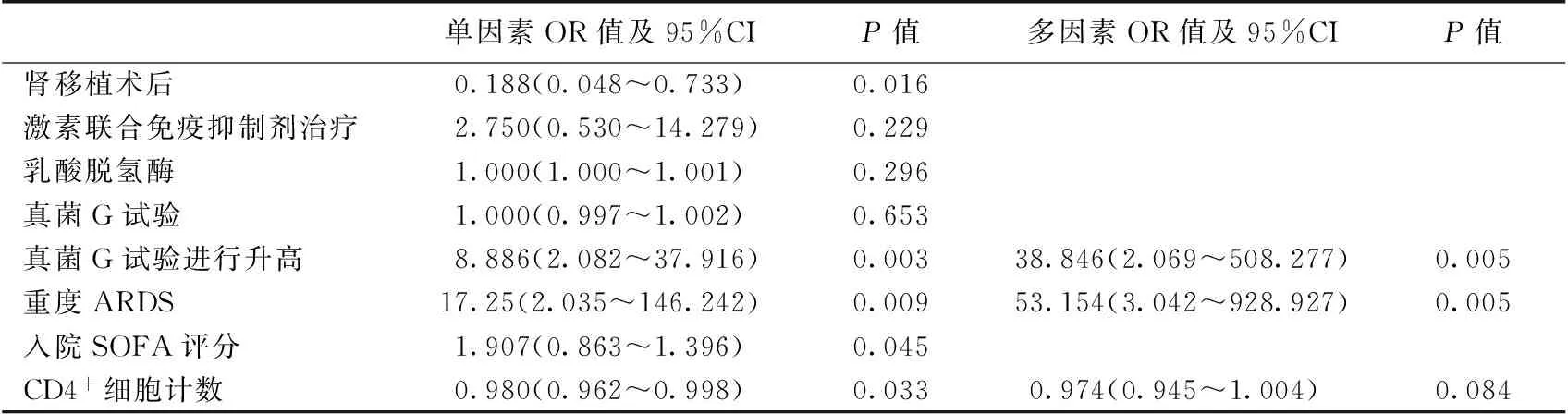
表2 肾脏疾病继发免疫缺陷及肺孢子菌肺炎危险因素的Logistic回归分析
ARDS:急性呼吸窘迫综合征;真菌G试验:血清1,3-β-D葡聚糖试验;SOFA评分:全身性感染相关性器官功能衰竭评分
重复测量资料的协方差分析(图2A)示入院前6天死亡组淋巴细胞计数持续低下,好转组则波浪式升高,提示淋巴细胞计数持续低下患者死亡风险升高。死亡组患者最低CD4+细胞显著低于好转组。ROC曲线则提示最低CD4+细胞计数预测好转曲线下面积为0.725(0.575~0.875),当CD4+细胞计数为64个/μl时为最佳临界点,此时敏感度为0.641,特异度为0.769(图2B)。

图2 淋巴细胞计数变化趋势及最低CD4+细胞ROC曲线A:入院后6天内淋巴细胞计数变化趋势图;B:外周血最低CD4+淋巴细胞预测好转ROC曲线
讨 论
目前显微镜下找到肺孢子菌或者定量多聚酶链式反应(qPCR)阳性是诊断PCP 的“金标准”。然而,在标本获取方面,PCP患者以干咳为主,痰标本不易获得且痰中含菌量低;深部标本,如肺泡灌洗液的获取属有创检查,并非所有患者都能耐受。在诊断技术方面,显微镜下找病原菌过分依赖检测人员的经验水平,极易造成漏诊;而qPCR技术在我国尚处于起步阶段,未广泛应用于临床。这些导致了PCP的病原学诊断十分困难。因此,确定PCP临床诊断标准有十分的必要性。
2014年澳大利亚皇家医师学院专家共识认为特殊的影像学改变对诊断PCP至关重要[4]。PCP肺部改变以两肺间质性和肺泡性病变为基础,依病情进展表现出磨砂玻璃型、斑片型、间质型、囊变型四种类型;临床上,不同类型的病变常同时存在[10]。2016年欧洲白血病专家会议推荐血清真菌G试验为诊断PCP关键的实验室指标(A-Ⅱ),真菌G试验阴性者可排除PCP(A-Ⅱ)[3]。最新的Meta分析显示乳酸脱氢酶联合真菌G试验阳性对PCP诊断的敏感度和特异度分别可达92.8%和83.9%[11]。因此,当免疫缺陷患者疑似PJP感染而缺乏病原学依据时,可将特征性影像学改变联合真菌G试验阳性及乳酸脱氢酶升高作为临床诊断PCP标准。值得注意的是,PCT作为细菌感染早期且敏感度较高的指标[12],在 PCP中正常或仅轻度升高[13]。本研究中,78.8%患者PCT正常范围或轻度升高。临床中,发现PCT明显升高时,需考虑合并细菌或其他病原菌感染。
文献报道非HIV患者从开始出现症状到需要住院治疗,通常为5~6d,有20%的患者甚至小于3d[14]。早期PCP以非特异性呼吸道症状为主,包括发热(54%~86%)、胸闷(24%~81%)、干咳(8%~76%)[1]。本研究中,患者从发病到入住ICU的平均时间为7.27±3.63d,胸闷、发热发生率分别为80.8%及86.5%, 55.0%的患者表现为咳嗽,仅30.8%患者有少量咳痰症状,与文献报道相符合。
非HIV的PCP患者死亡率高,可达17.2%~52.9%[15]。本研究发现重度ARDS、治疗后真菌G试验进行性升高是死亡高危因素,而真菌G试验及乳酸脱氢酶的水平与预后无明确相关,与Nakamura等研究相符[16]。另外,入ICU时SOFA评分并无统计学意义,提示疾病早期的器官损害与疾病危重度并不平行,临床医师需提高警惕。
PJP是人类呼吸道常见的定植微生物,PCP的发生与宿主免疫功能,特别是CD4+淋巴细胞免疫缺陷密切相关;外周血CD4+细胞计数<200个/μl时,PCP发生率升高[1,17]。Yang等[5]研究发现PCP多发生于接受免疫抑制治疗后2.4个月左右[5]。本研究中70%的患者PCP发生前3个月左右加用或者加强免疫抑制治疗。好转组的最低CD4+细胞计数明显高于死亡组;重复测序变量的协方差分析表明入院前6天死亡组患者淋巴细胞计数持续低下。上述结果提示,患者免疫功能抑制的程度及免疫功能重建能力是影响PCP患者预后的重要因素:免疫功能损伤重及免疫重建能力差,死亡风险高。
本研究是迄今为止,样本量最大的单中心有关免疫抑制CKD患者发生PCP的临床研究,首次提出患者的免疫状态和免疫功能重建能力是影响PCP患者预后的重要因素,为非HIV的PCP的诊断与治疗提供了依据。但本研究尚存在不足:首先本研究缺乏PCP病原学诊断依据,仅凭临床间接证据,可能出现判断失误,影响结果;其次本研究为回顾性研究,部分病历资料不完整,某些数据可能存在缺失及偏倚。
小结:PCP作为免疫缺陷患者致命性感染,早期表现常不典型,病原学诊断困难。特征性影像学改变、真菌G试验及乳酸脱氢酶阳性,有助于诊断PCP。CD4+细胞计数低、G试验进行性升高、重度ARDS提示预后差。对接受免疫抑制治疗的CKD患者,特别是加用或加强免疫抑制治疗3个月左右者合并肺部感染时,需考虑PCP可能,及时行相关检查,予针对性治疗。
1 Roux A,Gonzalez F,Roux M,et al.Update on pulmonary Pneumocystis jirovecii infection in non-HIV patients.Med Mal Infect,2014,44(5):185-198.
2 Bienvenu AL,Traore K,Plekhanova I,et al.Pneumocystis pneumonia suspected cases in 604 non-HIV and HIV patients.Int J Infect Dis,2016,46:11-17.
3 Alanio A,Hauser PM,Lagrou K,et al.ECIL guidelines for the diagnosis of Pneumocystis jirovecii pneumonia in patients with haematological malignancies and stem cell transplant recipients.J Antimicrob Chemother,2016,71(9):2386-2396.
4 Cooley L,Dendle C,Wolf J,et al.Consensus guidelines for diagnosis,prophylaxis and management of Pneumocystis jirovecii pneumonia in patients with haematological and solid malignancies,2014.Intern Med J,2014,44(12b):1350-1363.
5 Yang CY,Yang AH,Yang WC,et al.Risk factors for Pneumocystis jiroveci pneumonia in glomerulonephritis patients receiving immunosuppressants.Intern Med,2012,51(20):2869-2875.
6 Leth S,Jensen-Fangel S,Østergaard L,et al.Pneumocystis jirovecii pneumonia in patients with end-stage renal disease:a comparison with the general population.Scand J Infect Dis,2014,46(10):704-711.
7 Zandman-Goddard G,Shoenfeld Y.HIV and autoimmunity.Autoimmun Rev,2002,1(6):329-337.
8 Ferguson ND,Fan E,Camporota L,et al.The Berlin definition of ARDS:an expanded rationale,justification,and supplementary material.Intensive Care Med,2012,38(10):1573-1582.
9 Singer M,Deutschman CS,Seymour CW,et al.The Third International Consensus Definitions for Sepsis and Septic Shock(Sepsis-3).JAMA,2016.315(8):801-810.
10 吴迪,谢红浪.肺孢子虫肺炎与巨细胞病毒肺炎影像学特点.肾脏病与透析肾移植杂志,2010,19(1):66-70.
11 Esteves F,Calé SS,Badura R,et al.Diagnosis of Pneumocystis pneumonia:evaluation of four serologic biomarkers.Clin Microbiol Infect,2015,21(4):379.e1-10.
12 Müller F,Christ-Crain M,Bregenzer T,et al.Procalcitonin levels predict bacteremia in patients with community-acquired pneumonia:a prospective cohort trial.Chest,2010,138(1):121-129.
13 Nyamande K,Lalloo UG.Serum procalcitonin distinguishes CAP due to bacteria,Mycobacterium tuberculosis and PJP.Int J Tuberc Lung Dis,2006,10(5):510-515.
14 Bollée G,Sarfati C,Thiéry G,et al.Clinical picture of Pneumocystis jiroveci pneumonia in cancer patients.Chest,2007,132(4):1305-1310.
15 Kim SJ,Lee J,Cho YJ,et al.Prognostic factors of Pneumocystis jirovecii pneumonia in patients without HIV infection.J Infect,2014,69(1):88-95.
16 Nakamura H,Tateyama M,Tasato D,et al.Clinical utility of serum beta-D-glucan and KL-6 levels in Pneumocystis jirovecii pneumonia.Intern Med,2009,48(4):195-202.
17 de la Rua NM,Samuelson DR,Charles TP,et al.CD4(+)T-Cell-Independent Secondary Immune Responses to Pneumocystis Pneumonia.Front Immunol,2016,7:178.

