缺氧诱导因子与肾脏疾病
端爱萍 杨敬平 综述 刘志红 审校
Semenza等[1]首次在研究红细胞生成素(EPO)的调控过程中,发现并报道了缺氧诱导因子1(HIF-1),该研究指出在缺氧条件下HIF-1能结合缺氧反应元件,进而促进EPO的转录。后续的研究发现组织缺氧在急性和慢性肾脏病的发生和发展过程中具有很重要的作用,组织和细胞对于缺氧反应的主要蛋白是HIF-1。HIF-1不恰当的激活与肾脏多种疾病的发展息息相关。本文总结HIF-1与急性肾损伤(AKI)及慢性肾脏病(CKD)等疾病的最新研究成果,阐述HIF-1参与调控肾脏疾病的机制,为进一步研究提供理论依据。
HIF-1的结构与调节
HIF-1在缺氧条件下稳定表达。HIF-1是一种异源二聚体,主要由HIF-1α和HIF-1β两个亚单位组成。其中,HIF-1β主要起结构性作用,HIF-1α起功能性作用。正常氧情况下,HIF-1α翻译后即被降解,其降解途径是通过泛素-蛋白酶水解系统。HIF-1α氧依赖性降解结构域上的脯氨酸残基可被脯氨酰羟化酶(PHD)羟基化,使其能被E3泛素连接酶(VHL)识别并且泛素化,之后通过蛋白酶快速降解。缺氧条件下脯氨酰羟化酶会被抑制,阻断HIF-1α的降解,HIF-1α转移到细胞核内,与HIF-1β形成有活性的复合物,启动核内靶基因的转录[2](图1)。因此,转录后的降解决定HIF-1的蛋白水平,这种降解依赖的调节主要用于突发事件的适应(如缺氧)。
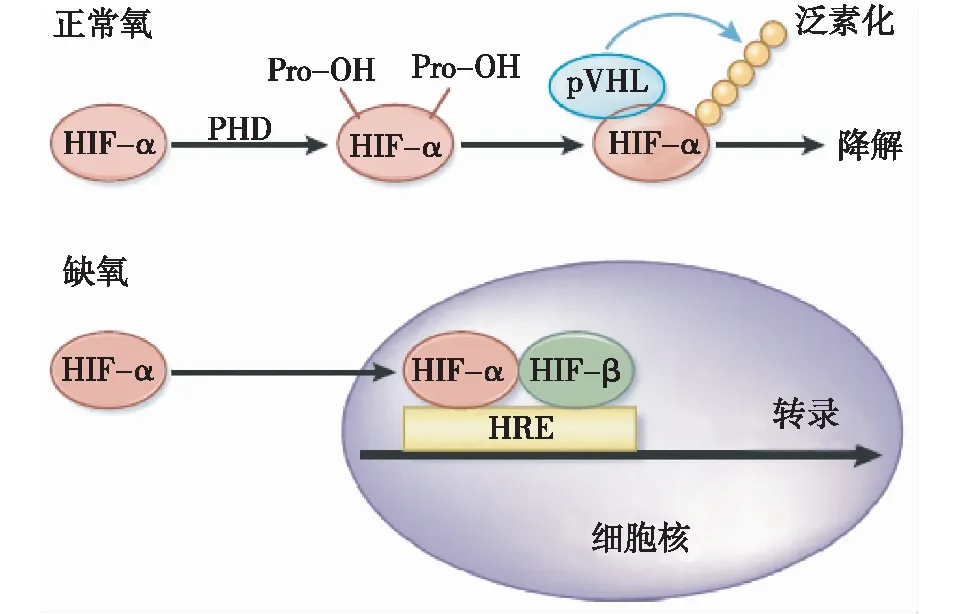
图1 HIF在缺氧和正常氧条件下的调节[3]HIF:缺氧诱导因子;PHD:脯氨酰羟化酶;pVHL:泛素连接酶;HRE:缺氧反应元件;Pro-DH:羟基化的脯氨酸残基
除了缺氧,HIF-1还受到其他因子的调控,包括线粒体复合物Ⅲ产生的活性氧(ROS)、一氧化氮、氯化钴、肿瘤坏死因子α、血管紧张素Ⅱ等[4]。此外,炎症反应也可以调节HIF-1信号通路。Yamaguchi等[5]研究发现CCAAT/增强子结合蛋白δ(CEBPD)是HIF-1调节因子。CEBPD是炎症反应的转录因子。在AKI和CKD的缺氧损伤中,CEBPD在近端小管细胞中高表达,进而提高HIF-1的水平。
HIF-1与肾脏疾病
肾脏疾病很多都会缺血缺氧。缺血缺氧能抑制HIF-1的降解,因此,HIF-1在多种肾脏疾病时激活。HIF-1在肾脏大部分类型的细胞中都有表达,如肾小管上皮细胞[6],系膜细胞[7],内皮细胞[8]等。HIF-1在肾脏的功能包括调节炎症、纤维化、凋亡等。在不同细胞和不同条件下,HIF-1的激活具有不同的作用。Higgins等[6]发现特异性敲除小鼠肾小管上皮细胞中的HIF-1,能有效缓解单侧输尿管结扎引起的肾脏纤维化进程。HIF-1能促进狼疮性肾炎肾小球系膜细胞的扩增,并且抑制其凋亡[9]。Kalucka等[10]研究发现,在体外培养的肾小球内皮细胞中特异性敲除HIF-1能增加因缺氧而引起的细胞死亡,并且减少巨噬细胞的黏附。但是在体内实验中特异性敲除内皮细胞中的HIF-1,并不能引起单侧输尿管结扎造成的纤维化模型中肾脏表型和肾脏功能的改变。HIF-1在不同肾脏疾病模型下具有不同的功能,目前的研究认为在肾脏疾病的早期阶段,HIF-1的激活可保护肾脏损伤,而在慢性肾脏病的阶段,HIF-1的作用是具有争议的[11]。
HIF-1与AKI 急性肾损伤是一种临床综合征,表现为肾小球滤过率(GFR)和尿量的急剧变化。目前临床上产生AKI的原因有很多,通常包括缺血,肾毒性物质和尿路梗阻等。在缺血性和非缺血性AKI时,往往会引起肾脏的缺氧进而激活HIF-1。缺氧除了发生在AKI进程中,还会出现在AKI的修复阶段,这可能与细胞在生长、增殖和修复过程中,氧气的大量消耗有关[12]。在多数情况下HIF-1的激活能够保护肾脏[13]。Kapitsinou等[12],Weidemann等[14],Wang等[15]分别在缺血再灌注和顺铂诱导的AKI模型中,对小鼠预处理稳定HIF-1,通过上调HIF-1下游的靶基因如血红素氧化酶1(HO-1)、多聚腺苷二磷酸核糖聚合酶1(PARP1)、血管内皮生长因子(VEGF)等,缓解AKI引起的肾脏损伤,包括炎症和贫血等。
此外,在AKI时微小RNA(miRNA)的表达水平也会受到HIF-1的影响而发生显著变化。 Wei等[16]通过基因芯片的方法发现在缺血再灌注的小鼠中有13种miRNA显著上调包括miR-21,miR-489,miR-210,miR-29等。进一步的实验发现HIF-1通过直接结合下游靶基因或者参与信号通路调节miRNA的表达,从而抑制炎症,减少肾组织的损伤[17]。
HIF-1与CKD 通常认为CKD是小管间质不可逆的病理学过程,最终可进展为终末期肾病(ESRD)。大量研究表明,肾小管间质的慢性缺氧是CKD向ESRD转变的共同途径[18]。研究表明慢性肾脏缺氧与毛细血管减少有关[19]。毛细血管减少是肾间质纤维化的重要特征之一,而且可能是肾脏纤维化与肾功能进行性减退的重要因素之一。大量的研究显示,在病理条件下HIF-1是肾脏纤维化的重要的调节因子[20]。但是,HIF-1在纤维化中的作用存在争议,具体机制尚不明确。
有文献报道HIF-1能促进肾脏纤维化的发展。Wang等[21]研究发现,在左肾动脉夹闭3周的大鼠模型,缺血缺氧能增加HIF-1的表达,同时伴随肾小球和小管间质的损伤。采用RNA干扰技术抑制HIF-1的表达,能减少Ⅰ型和Ⅲ型胶原的沉积以及α-平滑肌肌动蛋白的表达,从而缓解肾间质的损伤。此外,Kimura等[22]在小管上皮细胞VHL敲除的小鼠中也发现HIF-1对肾脏纤维化的发展具有促进作用。作者对正常小鼠和VHL敲除的小鼠进行5/6肾切除发现,VHL敲除的小鼠能够上调纤维化因子,促进肾脏的纤维化,同时蛋白尿/肌酐比也明显高于对照组小鼠。
然而,Fang等[23]发现激活HIF-1能缓解肾脏的纤维化。在大鼠2/3肾切除的CKD模型中,作者采用L含羞草碱激活HIF-1,活化的HIF-1能上调miR-29c,miR-29c能下调纤维化蛋白Ⅱ型胶原α1(COL2A1)和原肌球蛋白1(TPM1),从而缓解肾脏的纤维化。此外,在单侧输尿管梗阻(UUO)小鼠中也证实激活HIF-1能抑制炎症和减少胶原的沉积从而缓解肾脏的损伤。相反,特异性失活HIF-1能促进炎症的发展[24]。
HIF-1调控肾脏疾病的可能机制
转录调控下游靶基因HIF-1作为转录因子,能直接结合到靶基因启动子区的缺氧反应原元件(HRE),直接调节下游靶基因的转录。HIF-1调节的靶基因超过800个,包括VEGF、HO-1、组织生长因子、纤溶酶原激活物抑制剂1(PAI-1)、Wilms瘤基因1(WT-1)等,影响血糖和能量的代谢、血管再生、红细胞生成、铁的稳态、细胞的迁移、血管运动的调节,以及细胞与细胞、细胞与细胞基质的相互作用等,在病理和生理条件下,调节肾脏的功能[4]。研究发现在局灶节段肾小球硬化(FSGS)模型中,HIF-1能结合到I型胶原α2链的启动子区,与SMAD3形成转录复合物,启动I型胶原的合成[25]。Norman等[26]也发现,金属蛋白酶抑制剂-1(TIMP-1)的启动子区存在HRE,HIF-1能直接结合TIMP-1的启动子区,促进TIMP-1的表达,从而引起肾脏的纤维化,而且这种作用不能被TGF-β1的抗体所抑制。
与其信号通路相互作用HIF-1作为转录因子,除可以转录调控下游靶基因直接发挥作用,还可以与其他信号通路相互作用,如TGF-β,Notch,NF-κB和 PI3K/Akt等,进一步调节肾脏的功能。
有许多文献表明HIF-1与TGF-β信号通路在肾脏纤维化中有一定的联系[27]。HIF-1能直接激活结缔组织生长因子(CTGF)的转录,CTGF是TGF-β信号通路的一个中间体,二者协同影响肾脏的纤维化。在内皮特异性敲除PHD2的小鼠模型中,敲除PHD2能增加HIF-1的水平,HIF-1含量的增加能显著上调内皮细胞中TGF-β的水平[28]。相反,TGF-β也能在转录、翻译、降解方面调节HIF-1[27]。在转录水平,TGF-β处理的系膜细胞中,mTORC1和SMAD3能相互作用,增加HIF-1的表达。在翻译水平,肾小管上皮细胞中,即使在正常氧的情况下,TGF-β-SMAD3信号通路也能促进HIF-1的表达,可能的机制是TGF-β处理激活SMAD2/SMAD3,SMAD2/SMAD3的激活能抑制PHD2的表达,从而抑制HIF-1的降解,增加HIF-1蛋白的水平[29]。
在严重缺氧条件下,HIF-1能也与p53信号通路相互作用,促进细胞的凋亡[30]。在正常氧情况下,肿瘤抑制蛋白p53被泛素蛋白连接酶Mdm2泛素化降解,这种作用同HIF-1的降解。在缺氧条件下,Mdm2的活性受到抑制,p53大量积累并且转移到细胞核内,与HIF-1竞争结合转录共激活因子p300。在这种条件下,HIF-1和p53下游靶基因都上调。在严重缺氧的条件下,HIF-1的活性逐渐消失,p53的作用增强。这其中的机制是由于:(1)HIF-1α可以磷酸化和非磷酸化的状态存在,磷酸化的HIF-1α倾向于与HIF-1β相互作用,而非磷酸化的HIF-1α更多的结合p53[31]。(2)HIF-1β能够被含半胱氨酸的天冬氨酸蛋白水解酶3和9(caspases 3和caspases 9)切割。caspases 3和caspases 9在严重缺氧条件下表达增多。因此,HIF-1α就不能与HIF-1β形成二聚体,启动下游基因的转录。(3)泛素蛋白连接酶Mdm2也能泛素化HIF-1α,引起HIF-1α的泛素化降解。
表观遗传学修饰表观遗传学是通过对DNA和蛋白质的化学修饰来调节基因的转录。常见的表观遗传学修饰包括DNA甲基化、组蛋白的修饰、染色质重塑、miRNA等非编码RNA介导的调控。值得注意的是,一些组蛋白去甲基化的酶包含Jumonji结构域,属于铁-氧化戊二酸加双氧酶家族,而PHD也是属于相同的家族,并且都需要氧气才能发挥作用。在缺氧条件下,一些包含Jumonji结构域的家族成员以HIF-1依赖的方式增加,有研究认为这种增加是由于克服在缺氧条件下酶活性的丢失[32]。Zager等研究发现,缺血再灌注的损伤能上调内皮素1(ET-1),并且在ET-1的转录起始位点发现组蛋白修饰的增加(如 H3K4m3 和 H3K9/14ac),染色质重塑的酶(如染色质重构复合物核心催化亚基1)[33-34]。此外,miRNA和非编码RNA的改变也能影响肾脏功能。虽然HIF-1在肾脏疾病中也具有重要作用,且HIF-1也能调节miRNA,如HIF-1能调节miR-155和miR-29影响肾脏的功能。然而, HIF-1调节肾脏细胞表观改变的具体机制还不是很清楚。
小结:缺氧在肾脏疾病的发展中起很重要的作用。慢性缺氧是肾脏疾病转变为ESRD的共同途径。HIF-1作为缺氧反应的主要蛋白,在很多肾脏疾病中都上调,它能够通过直接调控下游靶基因、与其他信号通路相互作用、表观遗传学修饰参与肾脏疾病的发展,因此,HIF-1可作为肾脏缺氧反应治疗的靶点。目前,至少有6种小分子的PHD抑制剂用于临床,并且二期临床显示该抑制剂可以以剂量依赖的方式增加血红蛋白的水平。然而,对于PHD抑制剂长期使用的数据未见报道,因此对于PHD抑制剂的研究还需要长期和大规模的实验。
1 Semenza GL.Serendipity,Generosity,and Inspiration.Cell,2016,167(1):20-24.
2 Jain IH,Zazzeron L,Goli R,et al.Hypoxia as a therapy for mitochondrial disease.Science,2016,352(6281):54-61.
3 Sugahara M,Tanaka T,Nangaku M.Prolyl hydroxylase domain inhibitors as a novel therapeutic approach against anemia in chronic kidney disease.Kidney Int,2017,92(2):306-312.
4 Haase VH.Hypoxia-inducible factors in the kidney.Am J Physiol Renal Physiol,2006,291(2):F271-281.
5 Yamaguchi J,Tanaka T,Eto N,et al.Inflammation and hypoxia linked to renal injury by CCAAT/enhancer-binding protein δ.Kidney Int,2015,88(2):262-275.
6 Higgins DF,Kimura K,Bernhardt WM,et al.Hypoxia promotes fibrogenesis in vivo via HIF-1 stimulation of epithelial-to-mesenchymal transition.J Clin Invest,2007,117(12):3810-3820.
7 Isoe T,Makino Y,Mizumoto K,et al.High glucose activates HIF-1-mediated signal transduction in glomerular mesangial cells through a carbohydrate response element binding protein.Kidney Int,2010,78(1):48-59.
8 Kapitsinou PP,Sano H,Michael M,et al.Endothelial HIF-2 mediates protection and recovery from ischemic kidney injury.J Clin Invest,2014,124(6):2396-2409.
9 Deng W,Ren Y,Feng X,et al.Hypoxia inducible factor-1 alpha promotes mesangial cell proliferation in lupus nephritis.Am J Nephrol,2014,40(6):507-515.
10 Kalucka J,Schley G,Georgescu A,et al.Kidney injury is independent of endothelial HIF-1α.J Mol Med (Berl),2015,93(8):891-904.
11 Gunaratnam L,Bonventre JV.HIF in kidney disease and development.J Am Soc Nephrol,2009,20(9):1877-1887.
12 Kapitsinou PP,Jaffe J,Michael M,et al.Preischemic targeting of HIF prolyl hydroxylation inhibits fibrosis associated with acute kidney injury.Am J Physiol Renal Physiol,2012,302(9):F1172-1179.
13 Godwin JG,Ge X,Stephan K,et al.Identification of a microRNA signature of renal ischemia reperfusion injury.Proc Natl Acad Sci U S A,2010,107(32):14339-14344.
14 Weidemann A,Bernhardt WM,Klanke B,et al.HIF activation protects from acute kidney injury.J Am Soc Nephrol,2008,19(3):486-494.
15 Wang WW,Li ZZ,Wang W,et al.Enhanced renoprotective effect of HIF-1α modified human adipose-derived stem cells on cisplatin-induced acute kidney injury in vivo.Sci Rep,2015,5:10851.
16 Wei Q,Bhatt K,He HZ,et al.Targeted deletion of Dicer from proximal tubules protects against renal ischemia-reperfusion injury.J Am Soc Nephrol,2010,21(5):756-761.
17 Wei Q,Liu Y,Liu P,et al.MicroRNA-489 Induction by Hypoxia-Inducible Factor-1 Protects against Ischemic Kidney Injury.J Am Soc Nephrol,2016,27(9):2784-2796.
18 Nangaku M.Hypoxia and tubulointerstitial injury: a final common pathway to end-stage renal failure.Nephron Exp Nephrol,2004,98(1):e8-12.
19 Nangaku M.Chronic hypoxia and tubulointerstitial injury: a final common pathway to end-stage renal failure.J Am Soc Nephrol,2006,17(1):17-25.
20 Li H,Satriano J,Thomas JL,et al.Interactions between HIF-1α and AMPK in the regulation of cellular hypoxia adaptation in chronic kidney disease.Am J Physiol Renal Physiol,2015,309(5):F414-428.
21 Wang Z,Zhu Q,Li PL,et al.Silencing of hypoxia-inducible factor-1α gene attenuates chronic ischemic renal injury in two-kidney,one-clip rats.Am J Physiol Renal Physiol,2014,306(10):F1236-1242.
22 Kimura K,Iwano M,Higgins DF,et al.Stable expression of HIF-1alpha in tubular epithelial cells promotes interstitial fibrosis.Am J Physiol Renal Physiol,2008,295(4):F1023-1029.
23 Fang Y,Yu X,Liu Y,et al.miR-29c is downregulated in renal interstitial fibrosis in humans and rats and restored by HIF-α activation.Am J Physiol Renal Physiol,2013,304(10):F1274-1282.
24 Kobayashi H,Gilbert V,Liu Q,et al.Myeloid cell-derived hypoxia-inducible factor attenuates inflammation in unilateral ureteral obstruction-induced kidney injury.J Immunol,2012,188(10):5106-5115.
25 Tanaka T.Expanding roles of the hypoxia-response network in chronic kidney disease.Clin Exp Nephrol,2016,20(6):835-844.
26 Norman JT,Clark IM,Garcia PL.Hypoxia promotes fibrogenesis in human renal fibroblasts.Kidney Int,2000,58(6):2351-2366.
27 Kalluri R,Neilson EG.Epithelial-mesenchymal transition and its implications for fibrosis.J Clin Invest,2003,112(12):1776-1784.
28 Kojima H,Gu H,Nomura S,et al.Abnormal B lymphocyte development and autoimmunity in hypoxia-inducible factor 1alpha -deficient chimeric mice.Proc Natl Acad Sci U S A,2002,99(4):2170-2174.
29 Kietzmann T,Roth U,Jungermann K.Induction of the plasminogen activator inhibitor-1 gene expression by mild hypoxia via a hypoxia response element binding the hypoxia-inducible factor-1 in rat hepatocytes.Blood,1999,94(12):4177-4185.
30 Greijer AE,van der Wall E.The role of hypoxia inducible factor 1 (HIF-1) in hypoxia induced apoptosis.J Clin Pathol,2004,57(10):1009-1014.
31 Suzuki H,Tomida A,Tsuruo T.Dephosphorylated hypoxia-inducible factor 1alpha as a mediator of p53-dependent apoptosis during hypoxia.Oncogene,2001,20(41):5779-5788.
32 Mimura I,Tanaka T,Wada Y,et al.Pathophysiological response to hypoxia-from the molecular mechanisms of malady to drug discovery: epigenetic regulation of the hypoxic response via hypoxia-inducible factor and histone modifying enzymes.J Pharmacol Sci,2011,115(4):453-458.
33 Naito M,Zager RA,Bomsztyk K.BRG1 increases transcription of proinflammatory genes in renal ischemia.J Am Soc Nephrol,2009,20(8):1787-1796.
34 Zager RA.′Biologic memory′ in response to acute kidney injury: cytoresistance,toll-like receptor hyper-responsiveness and the onset of progressive renal disease.Nephrol Dial Transplant,2013,28(8):1985-1993.

