hsp90α基因四环素诱导调控表达质粒的构建及功能验证
尚冰清,周 丹,朱 宏,刘 昱,郭丽丽,汤仁仙,寇艳波
(徐州医科大学,1.免疫与代谢重点实验室;2.临床医学系院,江苏 徐州 221006)
基因的过表达和沉默是研究基因功能的重要手段。但是由于某些基因的编码产物在特定的细胞时期对细胞具有毒性或其减少严重影响细胞正常生长甚至导致细胞死亡,给这些基因生物学功能的阐明带来的极大地困难。此外,随着研究的深入,有报道表明某些基因表达水平的不同所引起的生物学表型也截然不同[1-2]。因此,可人工调控表达系统的建立对基因功能的研究将具有非常重要的意义。
近些年研究者们开发出了许多种类的可诱导表达系统,1995年由Gossen等[3]发现并改造的Tet-on系统尤为受关注。环境中没有四环素(tetracycline,Tc)或其衍生物如强力霉素(doxycycline,DOX) 存在时下游基因处于表达抑制状态,当Tc或DOX存在时下游基因启动表达[4]。传统的Tet-on系统具有可控性好、本底表达水平低、细胞毒性小等特点,但是它也存在一定的不足,如传统的Tet-on系统为双载体系统需要同时对TetR表达载体和目的基因表达载体同时进行遗传操作,并且目的基因过表达无法统一检测或实时监测。
热休克蛋白90(heat shock proteins 90,HSP 90)在细胞中含量丰富,约占细胞蛋白总量的1%-2%,其靶蛋白多在细胞生长调控及存活方面发挥着重要作用。研究发现HSP90α在肿瘤细胞中的表达量为正常细胞的2-10倍,例如:HBV相关性肝细胞癌,其含量的表达与肿瘤分级分期相联系[5-6],提示其与细胞的恶性转化密切相关,并且HSP90α已作为肿瘤标记物应用于癌症的早期筛查。不同表达水平的HSP90α对肝癌发生发展的作用研究将一定程度上加深人们对肝癌发生机制的认识。
该研究通过对传统双载体逆转录病毒Tet-on系统的改造建立了单载体Tet-on系统,并在启动子下游引入增强绿色荧光蛋白(Enhancegreen Fluorescent Protein,EGFP)编码基因使过表达的目的蛋白标记EGFP标签,便于后续检测和实时观察。新的Tet-on-EGFP系统应用于肝癌细胞HepG2中HSP90α的过表达,通过使用不同浓度DOX的诱导不同水平Hsp90α过表达,为进一步机制研究提供了有力的遗传操作工具。
1 材料与方法
1.1 试剂与仪器
肝癌细胞HepG2(徐州医科大学免疫与代谢重点实验室);pRetroX-Tet-on双载体系统 (中国医学科学院医药生物技术研究所);限制性内切酶及连接酶(Thermo Fisher Scientific);质粒提取试剂盒,PCR产物纯化试剂盒,凝胶回收试剂盒 (Omega);PCR试剂盒 (Takara); DMEM培养基(Hyclone);胎牛血清 (Serana);Lipofectamine 2000 (Invitrogen);嘌呤霉素 (Sigma);强力霉素 (生工生物);逆转录试剂盒(Takara);荧光定量PCR试剂盒(Takara);EGFP、GAPDH蛋白抗体 (Abcam);ECL发光剂(Bio-Rad);CCK-8试剂盒(日本同仁);恒温CO2培养箱(Thermo Fisher Scientific);荧光显微镜(Olympus)。
1.2 HepG2细胞培养
HepG2细胞于含有10% 胎牛血清的DMEM高糖培养基中,37℃,5% CO2,一般2-3天传代一次。
1.3 单载体Tet-On-EGFP系统载体构建
1.3.1 目的基因hsp90αORF的扩增与纯化 由NCBI基因库中获取hsp90α基因编码序列。利用软件Primer 5.0设计引物并分别在上游和下游引物5'端引入限制性内切酶NotI和MluI识别位点及对应的保护碱基,上游引物序列:5'AAGG AAAAAAGCGGCCGCATGCCCCCGTGTTCGGGCG 3',下游引物序列:5' CGACGCGTTTAGACTACTTCTTCCATGC GTGATGTGTCG 3'。以肝癌细胞HepG2 cDNA为模板经PCR扩增获得hsp90α全长基因片段(产物大小2579 bp)。利用纯化试剂盒纯化PCR产物,纯化产物进行电泳分析。
1.3.2 表达质粒
pRetroX-Hsp90a-EGFP-Pur的构建 以质粒pcDNA3.1-EGFP为模板PCR扩增EGFP编码基因,通过MluI和EcoRI双酶切连接连入pRetroX-Tight-Pur,获得质粒pRetroX-EGFPPur。将1.3.1中纯化的PCR产物和pRetroX-EGFP-Pur用NotI和MluI双酶切,连接获得质粒pRetroX-Hsp90a-EGFP-Pur,测序无误后用于后续实验。
1.3.3 rtTA表达盒的扩增和单质粒Tet-on系统的构建
以pRetroX-Tet-On Advanced为模板PCR 扩增rtTA表达盒,并在其两端引入限制性内切酶BglII识别位点。将rtTA表达盒和pRetroX-Hsp90a-EGFP-Pur经BglII酶切及去磷后连接获得最终质粒pRetroX-Hsp90a-EGFP-Tet-On。
1.4 细胞转染及筛选
HepG2生长至80%时利用Lipfectamine 2000进行转染,转染后5 h更换含有10% 胎牛血清的培养基,并于48 h后胰酶消化重新接种于含有1 mg/ml 嘌呤霉素的新鲜培养基中进行筛选,能够正常生长的细胞即含有pRetroX-Hsp90a-EGFPTet-On质粒。
1.5 RT-PCR
收集不同浓度DOX诱导后的HepG2细胞,提取RNA,取总RNA 1 μg进行逆转录获得总cDNA,以不同组的cDNA为模板利用Roche Light Cycler 480荧光定量PCR仪检测hsp90α转录情况,内参为β-actin,引物序列如下:5'GGCATCGTGATGGACTCCG 3',5'GCTGGAAGGTGGACAGCGA 3' (β-actin);5'T G C C T C T G G T G AT G A G AT G G T T 3' ,5'GGTGACTGACACTAAAGTCTTCCCC 3' (hsp90α)。
1.6 Western Blot
收集不同浓度DOX诱导后的HepG2细胞,RIPA裂解液裂解,BCA法测定蛋白浓度。每孔上样总蛋白15 mg进行SDS-PAGE,转印至PVDF膜后用5%脱脂奶粉室温封闭2 h,一抗室温孵育2 h洗涤后二抗孵育1 h再次洗涤后检测EGFP和内参GAPDH强度。
1.7 细胞增殖实验
HepG2细胞消化后血球板计数,调整细胞浓度至4×104个/ml,分为四组(分别加入DOX使终浓度为0,100,250,500 ng/mL)接种于96孔板中每孔100 μl,每组15孔(3个时间点,每个时间点5个平行),于0 h,24 h和48 h通过CCK-8试剂盒检测细胞增殖情况。
1.8 统计学方法
采用SPSS 16.0统计软件进行统计分析,实验数据采用“±s”表示,多个样本均数的比较用方差分析,P<0.05为差异有显著性意义。
2 结 果
2.1 单载体Tet-On-EGFP系统载体构建
分别通过PCR扩增EGFP编码基因、HSP90α编码基因、rtTA-Advanced表达盒,目的产物经凝胶回收后依次进行酶切、纯化、连接得到目的基因表达载体pRetroX-Tet-On-Hsp90α-EGFP,如图1所示,1、2、3泳道为PCR扩增结果,Hsp90α编码基因2565 bp,EGFP编码基因1607 bp,rtTAAdvanced表达盒长1525 bp。pRetroX-Tet-On-Hsp90α-EGFP通过ApaI限制性内切酶消化验证,产生条带分别为8247 bp和2666 bp和998 bp,载体测序无误后用于后续实验。
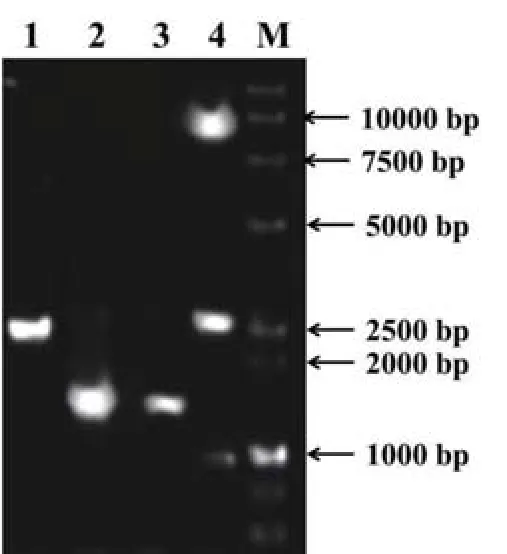
图1 目的片段PCR产物及限制性内切酶酶切验证琼脂糖凝胶电泳1、2、3泳道分别为Hsp90α编码基因、EGFP编码基因、rtTAAdvanced表达盒,4泳道为pRetroX-Tet-On-Hsp90α-EGFP经ApaI酶切结果,M泳道为Marker。
2.2 DOX诱导目的蛋白的表达
通过脂质体法将目的基因表达载体pRetroX-Tet-On-Hsp90α-EGFP转染至HepG2细胞中,经G418(500 μg/ml)筛选后得到稳定转染细胞株,分别添加终浓度为0,100,500,2500 ng/ml的DOX诱导基因表达,24 h后通过荧光显微镜、荧光定量PCR以及Western blot检测EGFP和目的蛋白的表达,并比较不同浓度DOX诱导能力的差异。如图2A所示,转染基因表达载体pRetroX-Tet-On-Hsp90α-EGFP的HepG2细胞添加DOX诱导24 h后能够观察到明显的绿色荧光,而未添加DOX基本无荧光,同样Western blot结果表明EGFP随DOX浓度不同出现表达量的差异,DOX为500 ng/ml时EGFP表达量最高(图2B)。与之相一致的是,荧光定量PCR结果表明随着DOX存在时hsp90α存在明显的诱导表达现象,且500 ng/mL诱导作用最强(图2C)。
2.3 hsp90α表达水平影响HepG2增殖
为进一步检测,不同浓度DOX诱导Hsp90α表达对HepG2增殖的影响,进行了CCK-8实验。稳定转染pRetroXTet-On-Hsp90α-EGFP的HepG2细胞消化后调整细胞浓度,分为四组,接种于96孔板中分别用不同浓度DOX诱导,每隔24 h利用CCK-8试剂盒检测细胞增殖情况。由图3可知,未经DOX诱导前,四组细胞数目基本一致,诱导48 h后添加500 ng/ml或2500 ng/ml DOX组增殖明显高于对照,而100 ng/ml DOX组与对照组没有统计学差异,说明Hsp90α促进HepG2增殖具有一定的剂量依赖性。

图2 DOX诱导后目的蛋白表达检测。

图3 CCK-8检测细胞增殖情况。
3 讨 论
大量研究已证实:四环素调控系统能够有效降低基因泄露[7-8]、时间空间特异性调控基因表达[9],且相对于其他系统的诱导因子如热休克、激素,Tc作为抗生素对细胞毒性小,诱导所需的剂量低,可应用于长期调控表达的细胞、动物模型。
四环素调控系统包括Tet-on与Tet-off系统。该实验选择Tet-on系统,在有DOX时,tetR可与tetO结合目的基因得到表达,撤去dox 转录即被抑制[10]。由于活体摄取要比清楚快得多,因此其在基因转录方面要快于Tet-off系统。
相比较于传统的Tet-on系统,需要两次筛选转染,操作繁琐,该实验设计的Tet-on单质粒载体系统,经一次转染即可用于实验,操作相对简单。在启动子下游引入EGFP编码序列使过表达的目的蛋白C端标记EGFP标签,便于后续检测和实时观察。不同浓度DOX展现出不同水平的诱导能力,一定程度上可用于某些蛋白的定量表达,为这些蛋白生物学功能的揭示提供了更有力的工具。
临床统计数据表明HSP90α与肝癌的发生具有明显的相关性,其在肿瘤细胞的增殖和分化、生存和移动及血管形成中发挥重要作用[11]。有研究表明,肿瘤细胞内过表达的HSP90α通过外泌体分泌于细胞外,与底物蛋白结合,促进肿瘤细胞的侵袭迁移,在肿瘤转移过程中发挥作用。其中,基质金属蛋白酶2(MMP-2)是肿瘤细胞外HSP90α的底物之一,分泌于细胞外的 HSP90α可能通过激活其底物蛋白MMP-2增强肝癌细胞侵袭迁移能力。同时,HSP90α也可以与其他伴侣分子联合作用,实验结果显示,HSP90α和HSP70可能通过结合形成复合体调控MMP-2的成熟和活化,参与肝癌转移潜能的形成[12]。HSP90α也可以通过调节细胞周期促进细胞增殖。肿瘤细胞在低氧、营养缺乏微环境中生存尤其依赖HSP90α。Hsp90α参与低氧诱导因子的信号传导通路。HSP90α可作为一种正向调节因子参与血管再生[13]。
继2013年在世界上首次证明HSP90α是一个全新肿瘤标志物并可用作肺癌检测后,清华大学生命科学学院罗永章团队在世界上首次证明,HSP90α可用于肝癌患者的检测,灵敏度比现行检测方法甲胎蛋白(AFP)大幅提高。目前,这一发现已被国家食品药品监督管理总局批准临床使用[14]。除此之外,亦有实验证实,HSP90α高表达与肝癌分化程度相关,而与患者性别、病理类型、病理分期无关。杨婧[15]等证明HSP90α单克隆抗体不仅能明显抑制肝癌移植瘤生长,而且具有抑制肝癌干细胞侵袭、成球和耐药的能力。说明HSP90α在肿瘤干细胞侵袭和存活过程中起重要作用,具有作为肝癌干细胞治疗靶点的潜力。
临床统计数据表明Hsp90α与肝癌的发生具有明显的相关性,且Hsp90α已作为肿瘤标记物用于肝癌早期的筛查。虽然已有研究提示Hsp90α高表达能够促进肝癌细胞侵袭和增殖[16],但是并没有进一步研究揭示Hsp90α表达量与肝癌细胞侵袭和增殖的具体关系。该研究结果显示hsp90α转录上调可以促进肝癌细胞HepG2的增殖,且增殖能力与hsp90α表达量存在一定的正相关关系,具体的分子机制还有待于深入探讨。
[1] Tang R,Kong F,Fan B,et al.HBx activates FasL and mediates HepG2 cell apoptosis throughMLK3-MKK7-JNKs signal module[J].World J Gastroenterol,2012,18(13):1485-1495.
[2] 汤仁仙,石红丽,范宝峰,等.乙肝病毒X基因对人肝癌细胞株HepG2凋亡的影响[J].四川大学学报(医学版),2010,41(1):95-100.
[3] Gossen M,Freundlieb S,Bender G,et al.Transcriptional activation by tetracyclines in mammalian cells[J].Science,1995 Jun 23;268(5218):1766-1769.
[4] 宫秀群,马敏敏,徐格林.四环素基因调控系统的研究进展[J].基础医学与临床,2012,32(2):233-236.
[5] Beasley RP.Hepatitis B virus,the major etiology of hepatocellular carcinoma[J].Cancer ,1988;61:1942-1956.
[6] 李 慧.热休克蛋白90α在HBV相关性肝细胞癌中的表达及临床意义[D].广州:广州医科大学,2014.
[7] Urlinger S,Baron U,Thellmann M,et al. Exploring the sequence space for tetracycline dependent transcriptional activators: Novel mutations yield expanded range and sensitivity[J].Proc Natl Acad Sci USA,2000,97(14): 7963-7968.
[8] Deuschle U,Meyer WK,Thiesen HJ.Tetracyclinereversiblesilencing of eukaryoticpromoters[J].Mol Cellul Biol,1995,15(4):1907-1914.
[9] Gallagher AR,Schonig K,BroWn N,et al.Use of the tetracycline system for inducible protein synthesis in the kidney[J].JAm Soc Nephrol,2003,14(8):2042-2051.
[10] Gossen M,Freundlieb S,Bender G,et al.Transcriptional activation by tetracyclines in mammalian cells[J].Science,1995,268(5218):1766-1769.
[11] Li W,Miao X,Qi Z,et al.Hepatitis B virus X protein upregulates HSP90α expression via activation of c-Myc in human hepatocarcinoma cell line,HepG2[J].Virology Journal,2010,7.45-57.
[12] 杨 婧,曹凯悦,孙立新,等.HSP90α和HSP90β在肝癌中共同上调表达[J].中国肿瘤,2016,5:391-394.
[13] 孔巧巧,邹志强.热休克蛋白90α与原发性肝癌关系的研究进展[J].滨州医学院学报,2016,39(4):289-290.
[14] 罗永章.全新广谱肿瘤标志物可大幅提高肝癌检测灵敏度[J].医药前沿,2017,3:3-4.
[15] 杨 婧.肝癌干细胞靶向治疗的研究[D].北京:北京协和医学院,2016.
[16] Li W,Miao X,Qi Z, Zeng W,et al.Hepatitis B virus X protein upregulates HSP90alpha expression via activation of c-Myc in human hepatocarcinoma cell line,HepG2[J].Virology Journal,2010,7: 45-57.
——一道江苏高考题的奥秘解读和拓展

