HBsAg/HBsAb双阳性慢性乙型肝炎患者HBV S基因免疫逃逸相关变异分析
唐子淋,刘 妍,刘佳梁,思兰兰,李 乐,廖 昊,邵金曼,徐东平,李 进
HBV感染是一种全球传染性疾病,WHO 2017年最新发布的数据显示在全球范围内约2.57亿人有慢性HBV感染[1]。HBsAg是用于诊断HBV感染的重要标志,而HBsAb是由HBsAg暴露的抗原决定簇刺激机体产生的特异性保护抗体,可以中和血清中的HBsAg。通常情况下HBsAb出现在HBsAg消失后或注射乙型肝炎(乙肝)疫苗后,是HBV感染终止和机体对HBV产生免疫力的标志,但在临床实际检测中,也可见血清HBsAg和HBsAb同时阳性的现象[2]。目前这种双阳性现象的临床意义和发生机制尚未完全明确,可能与多种因素有关,其中HBV S基因变异引起的抗原性改变,可能与HBV感染慢性乙肝患者血清中HBsAg/HBsAb双阳性现象相关[3-4]。
HBV包膜蛋白由preS/S基因编码,其中S基因主要亲水区(major hydrophilic region,MHR)(aa 99~169)编码暴露在病毒颗粒表面上的主要构象表位,该区段发生的变异,包括替换、插入、缺失和提前终止都能影响 HBsAg 的表达、分泌和识别[5-6]。有研究表明如若变异使病毒基因在原有的s146-148NCT N-糖基化位点基础上额外增加NXT/S(X不为P)位点,则会引入新增N-糖基化变异,可降低HBsAb与HBsAg的亲和力,增加病毒分泌,从而引起免疫逃逸,可造成HBsAg/HBsAb双阳性[7]。本研究旨在明确HBsAg/HBsAb双阳性慢性乙肝患者HBV S基因MHR免疫逃逸相关变异特点,分析变异与双阳性的相关性。
1 对象与方法
1.1 对象 2007—2013年于解放军第三〇二医院就诊且HBsAg与HBsAb同时呈阳性的慢性乙肝患者。HBsAg/HBsAb双阳性组(双阳性组)纳入标准:①间隔至少半年,连续2次以上检测确认HBsAg与HBsAb同时呈阳性;②无HCV、HDV、HIV重叠感染;③腹部超声、CT、MRI等影像学检查或肝组织病理学检查未提示肝硬化及原发性肝癌。最终共89例患者被纳入双阳性组。同时根据以上第②及第③条标准随机匹配纳入148例HBsAg阳性且HBsAb阴性的慢性乙肝患者作为HBsAg单阳性组(单阳性组)。慢性乙肝诊断均依据我国《慢性乙型肝炎防治指南(2010年)》[8]确立。本研究纳入的237例患者均签署相关知情同意书,并经解放军第三〇二医院伦理委员会审查批准。
1.2 试剂 病毒DNA提取试剂盒购自于北京天恩泽生物技术有限公司;电泳marker(2000 bp)购自于 TaKaRa大连宝生物工程有限公司;琼脂糖以及2×EasyTaq PCR SuperMix均购自于北京全式金生物技术有限公司;PCR产物回收纯化试剂盒购自于美国Qiagen公司;引物合成和基因测序工作由北京天一辉远生物技术有限公司完成。
1.3 方法
1.3.1 乙肝血清学标志物及血清HBV DNA定量 乙肝血清学标志物(HBsAg、HBsAb、HBeAg、HBeAb、HBcAb)及血清HBV DNA定量由解放军第三〇二医院临床检验中心检测。乙肝血清学标志物采用化学发光法定性检测,HBV DNA定量采用罗氏公司商品试剂盒进行检测,其检测下限为100 IU/ml。
1.3.2 巢式PCR扩增HBV S基因并测序 从解放军第三〇二医院血清样本库中提取2组患者血清样本。采用病毒提取试剂盒提取2组患者血清HBV DNA,使用本课题组自主研发的一管式巢式PCR法扩增HBV S基因技术(国家发明专利ZL 200910092331.1,病毒载量的扩增下限为20 IU/ml),PCR产物行琼脂糖凝胶电泳鉴定并行基因测序。
1.3.3 HBV基因型与HBV S基因免疫逃逸相关变异与新增N-糖基化变异分析 使用DNASTAR软件中的SeqMan 7.1.0模块进行序列拼接。使用MEGA 4软件对测序所得HBV DNA序列进行基因型分型,使用DNASTAR Lasergene MegAlign软件进行变异比对分析。应用GenBank中标准参考序列进行比较,标准参考序列从在线肝炎病毒数据库(http://www.ncbi.nlm.nih.gov/projects/genotyping/formpage.cgi)获得。本研究重点分析既往研究中报道过的HBV S基因MHR免疫逃逸相关变异(表1)[9-13]。

表1 既往研究报道的HBV S基因MHR免疫逃逸相关变异Table 1 Immune escape related mutations within MHR of HBV S gene in previous reports
1.4 统计学处理 使用Excel 2007软件进行数据整理,使用IBM SPSS 21.0软件对数据进行统计学分析。本研究采用的巢式PCR方法扩增HBV S基因的专利技术检测下限约为20 IU/ml,而HBV DNA临床检验科检测下限为100 IU/ml,故低于临床检测下限的样本HBV DNA按照中间值60 IU/ml计算,即1.78 log10IU/ml。变异率比较采用四格表χ2检验,2组间非正态分布的连续性数据比较采用非参数检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 2组慢性乙肝患者基本临床资料 本研究最终纳入的患者均为C基因型HBV感染。2组患者一般临床情况如下:双阳性组患者年龄最小为1岁,最大为61岁,中位数为39.0岁,其中男性65例(73.03%),女性24例(26.97%)。单阳性组患者年龄最小为2岁,最大为89岁,中位数为40.5岁,其中男性128例(86.49%),女性20例(13.51%)。2组患者在ALT、TBIL、HBV DNA载量、HBeAg阳性率方面差异均无统计学意义(表2)。

表2 2组患者一般临床资料Table 2 General clinical data of patients in 2 groups
2.2 2组患者HBV S基因MHR免疫逃逸相关位点变异分析 双阳性组HBV S基因MHR免疫逃逸相关变异检出率(31.46%,28/89)显著高于单阳性组(18.92%,28/148)(χ2=4.845,P=0.028)。单阳性组在46个免疫逃逸相关位点中有15个位点发生了变异;而双阳性组中46个免疫逃逸相关位点有18个位点发生了变异,其中sL110I/S(12.36%,11/89)、sT113N/S(12.36%,11/89)、sT131I/N/P(8.99%,8/89)和sS143L/M/T(10.11%,9/89)4个单位点变异检出率明显高于单阳性组(图1)。
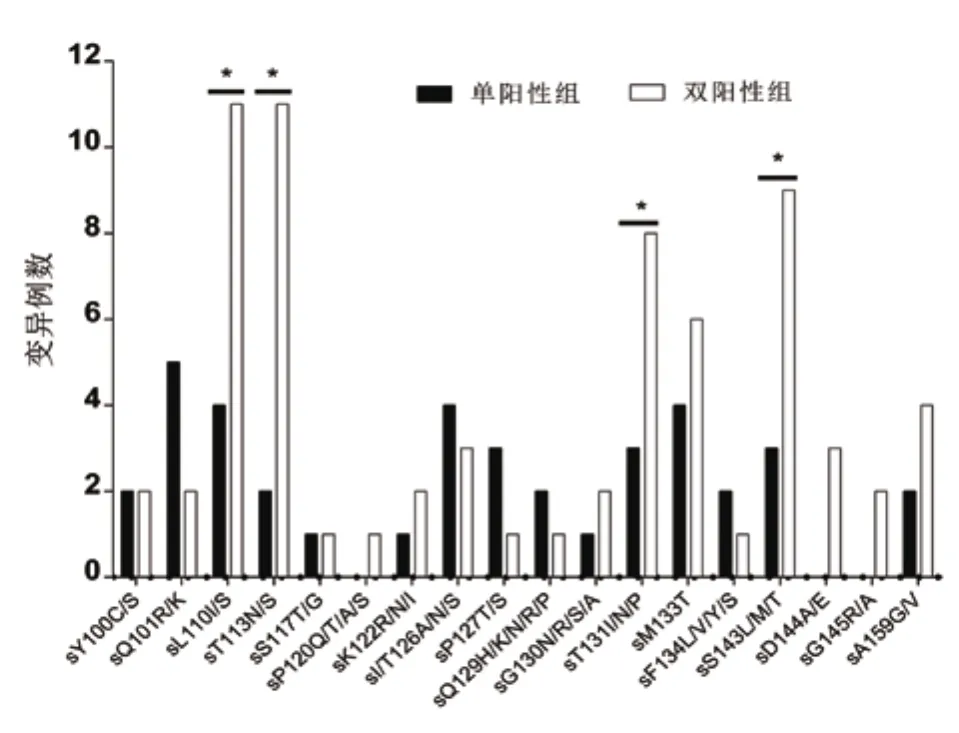
图1 2组患者HBV S基因MHR免疫逃逸突变情况注:两组比较,sL110I/S变异χ2=8.742,P=0.003; sT113N/S变异 χ2=10.954,P=0.001;sT131I/N/P变 异 χ2=4.615,P=0.032;sS143L/M/T变异χ2=5.970,P=0.015;*.P<0.05Figure 1 Mutation of immune escape at HBV S gene MHR of patients in 2 groups
多位点联合变异检出率在双阳性组(20.22%,18/89)显著高于单阳性组(6.08%,9/148)(χ2=11.014,P=0.001),多位点联合变异形式见表3。双阳性组以3联变异形式为主,且存在3例4联多位点联合变异,2例6联多位点联合变异,其中sL110I+sT113S+sS143T变异形式最多,共7例(38.89%,7/18),而在单阳性组中未发现这种多位点变异形式。单阳性组则以2联为主,仅有2例出现3联多位点联合变异。
2.3 2组患者新增N-糖基化变异分析 双阳性组患者中有7例在HBV S基因的MHR内检出新增N-糖基化变异(7.87%,7/89),其中5例患 者 检 出 sT131N+M133T→s131-133NST,1例患者检出sT116N→s116-118NST,1例患者检出sT131N+M133T→s131-133NST合并sT116N→s116-118NST,其中sT131N+M133T→s131-133NST检出率最高(71.43%,5/7)。而单阳性患者仅3例检出HBV S基因MHR新增N-糖基化变异(2.03%,3/148),2例 sT131N+M133T→s131-133NST,1例sQ129N→s129-131NGT。2组患者新增N-糖基化变异检出率差异具有统计学意义(χ2=4.687,P=0.030)(表 4)。
3 讨 论
HBV感染可以引起急、慢性病毒性肝炎,肝纤维化,更与肝细胞癌的发生和发展密切相关。乙肝血清五项是临床中常用的诊断HBV感染的指标。其中HBsAg与HBsAb的血清学转换更是判断患者病毒是否完全清除,是否能够停止服用抗HBV药物的重要参考依据。通常HBsAg与HBsAb不会同时处于阳性状态,但自1976年以来,血清HBsAg和HBsAb同时阳性的现象屡有报道[5,14]。目前认为关于HBsAg与HBsAb共存机制主要与HBV S基因免疫逃逸变异相关。HBV S基因编码HBsAg,其MHR内(尤其是α决定簇)的氨基酸变异可使HBsAg的抗原性发生改变,使HBsAg无法与HBsAb中和,可造成HBsAg/HBsAb双阳性[5,14-15],此外HBV S基因MHR新增N-糖基化位点变异亦可降低HBsAg对HBsAb的亲和力,从而造成HBsAg/HBsAb双阳性现象[7]。

表3 2组患者多位点联合变异分析Table 3 Analysis of multiple mutation of immune escape at MHR of patients in 2 groups

表4 2组患者MHR新增N-糖基化位点变异分析Table 4 Analysis of additional N-glycosylation mutations at MHR of patients in 2 groups
本研究共纳入89例双阳性与148例单阳性慢性乙肝患者。为了消除HBV基因型不同而对实验结果产生的影响,本研究将实验对象限定为HBV C基因型感染。2组患者的年龄、ALT、TBIL、HBV DNA载量、HBeAg阳性率临床指标均未见显著差异。在经过对2组患者HBV S基因测序结果分析发现双阳性组患者免疫逃逸相关位点累计变异率明显高于单阳性组,其中sL110I/S、sT113N/S、sT131I/N/P和sS143L/M/T的变异检出率均显著高于单阳性组。双阳性组患者多位点联合变异率亦显著高于单阳性组,且变异形式更复杂,以3联多位点变异形式sL110I+sT113S+sS143T为主(38.89%,7/18),而这种多位点变异形式未发生在单阳性组中。单阳性组以2联多位点变异形式为主。
此外,HBV S基因的MHR(aa 99~169)发生替换、插入、缺失等变异可能会引入新增N-糖基化变异,引起抗原性改变。在本研究中,双阳性组新增N-糖基化变异率亦显著高于单阳性组,双阳性组sT131N+M133T→s131-133NST检出率最高,为71.43%。此外,有研究表明与野生型 HBsAg 相比,新增 N-糖基化变异的HBsAg/HBsAb 结合力减弱,在表型分析中发现比野生型HBsAg具有更好的病毒包膜形成和分泌能力,因此推测HBV S 基因新增 N-糖基化变异可能在HBsAg/HBsAb 双阳性共存状态中发挥重要作用[16]。
本研究发现2组患者男女比例有差异(P=0.010),因此进一步分析了2组发生变异男女患者比例,双阳性组28例发生变异的患者中有20例男性(71.43%);单阳性组28例发生变异的患者中有24例男性(85.71%);2组发生变异的患者男女比例差异无统计学意义(P=0.193)。推测2组总体样本的性别差异可能与患者的选择和抽样误差有关。本研究为临床真实世界的横断面研究,缺乏动态的样本信息,但样本量较为充足,有一定的临床意义。
总之,与HBsAg单阳性患者相比,HBsAg/HBsAb双阳性患者中HBV S基因可检出更多变异种类、更高变异检出率、更多联合变异复杂形式的MHR免疫逃逸相关变异,并且新增N-糖基化变异检出率也更高,这些变异可能是引起HBsAg/HBsAb双阳性共存的驱动因素之一。本课题组之前的研究发现HBV S基因MHR区新增N-糖基化变异是HBsAg/HBsAb双阳性患者进展为肝癌的主要风险因素[17],因此应关注并定期监测双阳性慢性乙肝患者的HBV S基因变异与病情进展。
【参考文献】
[1]World Health Organization.Global hepatitis report,2017[R].Geneva: World Health Organization,2017.
[2]Xu Y.Coexistence of hepatitis B surface antigen (HBsAg) and heterologous subtype-specific antibodies to hbsag among patients with chronic hepatitis B virus infection[J].Clin Infect Dis,2007,44(9):1161-1169.
[3]卢姗姗,李晓东,罗声栋,等.HBsAg和抗HBs双阳性患者S基因新增N-糖基化突变的意义[J].解放军医学杂志,2016,41(5):351-357.
[4]Yukimasa N,Ohkushi H,Fukasawa K,et al.Hepatitis B virus gene mutations in the sera of three patients with coexisting hepatitis B surface antigen and anti-surface antibody[J].Rinsho Byori,2000,48(2):184-188.
[5]Colson P,Borentain P,Motte A,et al.Clinical and virological significance of the co-existence of HBsAg and anti-HBs antibodies in hepatitis B chronic carrier[J].Virology,2007,367(1):30-40.
[6]Pondé RA.The underlying mechanisms for the “simultaneous HBsAg and anti-HBs serological profile”[J].Eur J Clin Microbiol Infect Dis,2011,30(11):1325-1340.
[7]Yu DM,Li XH,Mom V,et al.N-glycosylation mutations within hepatitis B virus surface major hydrophilic region contribute mostly to immune escape[J].J Hepatol,2014,60(3):515-522.
[8]中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南(2010)年版[J].传染病信息,2011,24(1):7-9.
[9]Chen J,Liu Y,Zhao J,et al.Characterization of novel hepatitis B virus PreS/S-gene mutations in a patient with occult hepatitis B virus infection[J].PLoS One,2016,11(5):e0155654.
[10]Svicher V,Cento V,Bernassola M,et al.Novel HBsAg markers tightly correlate with occult HBV infection and strongly affect HBsAg detection[J].Antiviral Res,2012,93(1):86-93.
[11]Liu Y,Zhang L,Zhou J,et al.Clinical and virological characteristics of chronic hepatitis B patients with coexistence of HBsAg and Anti-HBs[J].PLoS One,2016,11(1):e0146980.
[12]Salpini R,Colagrossi L,Bellocchi M,et al.Hepatitis B surface antigen genetic elements critical for immune escape correlate with hepatitis B virus reactivation upon immunosuppression[J].Hepatology,2015,61(3):823-833.
[13]Wu C,Zhang X,Tian Y,et al.Biological significance of amino acid substitutions in hepatitis B surface antigen (HBsAg) for glycosylation,secretion,antigenicity and immunogenicity of HBsAg and hepatitis B virus replication[J].J Gen Virol,2010,91(Pt 2):483-492.
[14]Lada O,Benhamou Y,Poynard T,et al.Coexistence of hepatitis b surface antigen (HBsAg) and Anti-HBs antibodies in chronic hepatitis B virus carriers: influence of “a” determinant variants[J].J Virol,2006,80(6):2968-2975.
[15]Wang L,Liu H ,Ning XX,et al.Sequence analysis of the S gene region in HBV DNA from patients positive for both HBsAg and HBsAb tests[J].Hepato Res,2010,40:1212-1218.
[16]Salpini R,Colagrossi L,Bellocchi MC,et al.Hepatitis B surface antigen genetic elements critical for immune escape correlate with hepatitis B virus reactivation upon immunosuppression[J].Hepatology,2015,61:823-833.
[17]Qiao Y,Lu S,Xu Z,et al.Additional N-glycosylation mutation in the major hydrophilic region of hepatitis B virus S gene is a risk indicator for hepatocellular carcinoma occurrence in patients with coexistence of HBsAg/anti-HBs[J].Oncotarget,2017,8(37):61719-61730.

