有机物分子式的确定
白素芳 穆玉鹏
(山东省博兴县第一中学 256500)
有机物分子式的确定,即确定有机物分子里所含元素的种类及各原子的数目.是有机物学习中最为重要的知识点之一.现通过实例把确定有机物分子式的十种思维方法列举如下,供大家参考.
一、商余法
根据烃类的通式可以看出它们的分子中都有一个共同的部分为CnH2n,这部分的式量为14n,因此用烃的相对分子质量除以14就可以得到分子所含碳原子数即n值,再根据余数就可以求得烃的分子式.
其规律为:
Mr/14能除尽,可推知为烯烃或环烷烃
Mr/14余数为2,可推知为烷烃
Mr/14差2可推知二烯烃或炔烃
Mr/14差6可推知为苯或苯的同系物
例1 某有机物A的相对分子质量为128,
若A是烃,则它的分子式可能是____或____.
若A为烃的含氧衍生物(分子中含2个氧原子),分子式可为____.
解析128/14等于9,余数为2.若为烃类,分子式可能为烷烃C9H20或C10H8;若为烃的含氧衍生物且分子中含2个氧原子,相对分子质量在烃的基础上减去32即在C9H20的基础上减去2个CH4,即得C7H12O2.
二、单位物质的量法
根据题目中的已知条件,确定有机物的元素组成后,直接求出1mol该有机物中各元素原子的物质的量,即可推算出分子式.若给出一定条件下该有机物气体的密度(或相对密度)及各元素的质量分数,则求解分子式的基本途径为:密度(或相对密度)→M→1mol有机物气体中各元素原子的物质的量→分子式.
例2 某化合物由碳、氢两种元素组成,其中含碳的质量分数为85.7%,在标准状况下体积为11.2L,此化合物的质量为14g,求此化合物的分子式.
解析此烃的摩尔质量为
1 mol 此烃中碳原子和氢原子的物质的量分别为:
n(C)=28g×85.7%÷12g/mol=2mol
n(H)=28g×14.3%÷1g/mol=4mol
所以1mol此烃中含2 mol C和4molH
即此烃的分子式为C2H4
三、最简式法
根据有机物的分子式为最简式的整数倍,利用其相对分子质量及求得的最简式便可确定其分子式.求解分子式的基本途径为:由元素的种类和含量求出分子组成中各元素的原子个数之比(最简式),然后结合该有机物的摩尔质量(或相对分子质量)求有机物的分子式.
例3 某有机物组成中含碳54.5%, 含氢9.1%,其余为氧.又知其蒸气在标况下的密度为3.94g/L,试求其分子式.
解析有机物分子中C、H、O原子个数比:C∶H∶O=54.5%/12∶9.1%/1∶36.4%/16=2∶4∶1,即最简式为C2H4O,设分子式为:(C2H4O)n.
又因为其摩尔质量为:
22.4L/mol×3.94g/L=88g/mol
故其分子式为:C4H8O2
四、燃烧通式法
根据有机物完全燃烧反应的通式及反应物和生成物的质量或物质的量或体积关系利用原子个数守恒来求出1 mol有机物所含C、H、O原子的物质的量从而求出分子式.如烃和烃的含氧衍生物的通式可设为CxHyOz(Z=0为烃),燃烧通式为
例4 某有机物0.6g完全燃烧后生成448mL(标准状况)CO2和0.36g水.已知该物质的蒸气对氢气的相对密度为30,求有机物的分子式.
解析该有机物的分子量为
30×2=60
0.6g该有机物的物质的量为
由原子个数守恒可知n(C)=n(CO2)=0.02mol,n(H)=2n(H2O)=0.04mol
0.6g该有机物中m(c)=M(C)×n(C) =12 g/mol×0.02mol =0.24g
m(H)=M(H)×n(H)=1 g/mol×0.04mol=0.04g
m(O)=0.6g-0.24g-0.04g=0.32g
0.01 mol 0.02 mol 0.02 mol
x=0.02 mol×1/0.01 mol=2
y=0.02 mol×4/0.01 mol=4
z=0.32g÷16g/mol÷0.01 mol =2
所以该有机物的分子式为C2H4O2
五、差量法
列举差量,将“差量”看作化学方程式右端的一项,将已知差量与化学方程式中的对应差量列成比例,其他解题步骤与按化学方程式列比例解题完全一样.
例5 标准状况下10毫升某气态烷烃跟80毫升过量的氧气混合, 通入一个容积为90毫升的密闭容器中点火爆炸后, 恢复到原状态, 测得的压强为原来的55.56%.求烷烃的分子式?
解析根据反应前后压强变化, 通过差量法解题求有机物分子式

1mol
10mol
(10 + 80)·(1-55.56%)(mol)

六、列方程组法
若已知有机物的元素组成,则可直接设1个分子中所含各元素原子的个数分别为x、y、z,即设出有机物的分子式.如有机物中含有C、H或C、H、O元素的时候可以假设该有机物的分子式为CxHyOz,根据题设条件列方程组解得x、y、z,即可求出该有机物的分子式(当z=0的时候该有机物不含氧,否则含有氧元素).
例6 0.2 mol某有机物和0.4 mol O2在密闭容器中燃烧后的产物为CO、CO2和H2O(g),产物通过浓硫酸后,浓硫酸增重10.8 g,再通过灼热的CuO,充分反应后,CuO的质量减轻3.2 g,最后剩余气体通过碱石灰被完全吸收,碱石灰的质量增加17.6 g.试求该有机物的分子式.

于是设该有机物的分子式为CxHyOz,根据C、H、O原子守恒,可以列出以下方程组:
0.2zmol+0.4 mol×2
所以x=2,y=6,z=2.
即该有机物的分子式为CxHyOz.
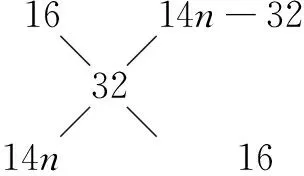
七、十字交叉法
十字交叉法是进行二组分混和物平均量与组分量计算的一种简便方法.凡可按M1n1+M2n2=(n1+n2)计算的问题,均可用十字交叉法进行计算,式中,表示混和物的某平均量,M1、M2则表示两组分对应的量.如表示平均分子量,M1、M2则表示两组分各自的分子量,n1、n2表示两组分在混和物中所占的份额,n1∶n2表示两组分物质的量之比.
例7 相同状况下9升甲烷与6升某烯烃混合, 所得混合气体的密度等于相同条件下氧气的密度, 计算该烯烃的分子式.
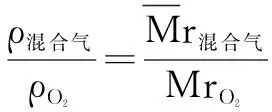

Mr(CH4)=16 烯烃Mr =14n
(CnH2n)
八、平均值法
当烃为混合物时,一般是设平均分子式,结合反应方程式及其他条件求出平均组成,利用平均值的含义确定混合烃可能的分子式.
例8 20mL两气态烃组成的混合物,跟足量O2混合后完全燃烧,当产物通过浓H2SO4体积减少30mL,然后通过碱石灰体积减少40mL(气体体积均在同温同压下测得),问:这种混合物的组成可能有几种?
解析n(C)=0.04 L/0.02 L=2,n(H)=0.03 L×2/0.02 L=3,即该烃分子式为C2H3.此烃中必含C2H2,其组成可能为C2H2和C2H4或C2H2和C2H6.
另外,有时也利用平均相对分子质量来确定其可能的组成,若两混合气态烃,平均相对分子质量小于或等于26,则该烃中必含有甲烷.
九、区间法
根据有机物燃烧耗O2量的上下限值及有机物通式列出不等式进行求解确定其分子式.
例9 常温下,在密闭容器中混有2mL气态烷烃和13mL O2,点燃爆炸,生成的只是气态产物,除去CO2和H2O后,又在剩余物中加入6mL O2,再进行爆炸重新得到的也只是气态产物,除得到CO2外,还剩余O2,试确定该烃的分子式.
解析设烷烃的分子式为CnH2n+2,1mL完全燃烧时耗O2为(3n+1)/2mL,2mL完全燃烧时耗O2为(3n+1)mL.由题意可知13<3n+1<13+6,即4 当反应物的相对用量不确定或条件不足时应根据有机物的状态或分子式中碳原子或氢原子数为正整数等这些条件来讨论有机物的分子式. 例10 吗啡是严格查禁的毒品,吗啡分子中含碳71.58%,氢6.67%,氮4.91%,其余为氧元素.已知吗啡相对分子质量不超过300,试求吗啡的分子式 解析该题初看起来条件不足无从下手,但仔细分析题意就会发现吗啡的分子量不超过300,氮原子的百分含量最小,原子个数最少.根据有机物中原子个数为正整数的特点,不妨先设吗啡分子中氮原子数为1,由题意可知吗啡的分子量为:14/4.91%=285<300,如果氮原子数大于1,很显然吗啡的分子量会超过300不符合题意.因此可以确定吗啡的分子量为285,该分子中所含N、C、H、O个数分别为:N(N)=1,N(C)=285×71.58%÷12=17,N(H)=285×6.67%÷1=19,N(O)=285×16.84%÷16=3.故吗啡的分子式为C17H19NO3. 参考文献: [1]魏华平.有机物分子式的确定方法[J].数理化学习(高中版), 2013(3).十、讨论法

