黄芩素通过线粒体凋亡途径诱导体外培养喉癌细胞凋亡的机制
孙吉凤 何海涛
(长春医学高等专科学校,吉林 长春 130031)
黄芩素(BAI)是一种从传统中药黄芩的根中提取出的黄酮类化合物〔1,2〕,具有多种药理作用,在临床上应用广泛。BAI具有抗乳腺癌、食管癌、胃癌等作用〔3,4〕。喉癌是一种耳鼻咽喉头颈部最常见的恶性肿瘤,绝大部分为鳞状细胞癌。近年来,其发病率正在稳步上升〔5,6〕。喉癌的临床治疗手段不断被改进,但其化疗效果仍不理想。近年来从天然中药资源中发掘有效抗癌药物成为肿瘤药物研发的热点。本实验旨在研究不同浓度BAI通过线粒体凋亡途径诱导体外培养的人喉鳞状细胞癌Hep-2细胞凋亡的分子机制。
1 材料及方法
1.1细胞与试剂 人喉癌Hep-2 细胞购于ATCC公司。RPMI1640培养基为Gibco/BRL公司产品。BAI、碘化丙啶(PI)购于Sigma公司,BAI用二甲基亚砜(DMSO)溶解后置于-20℃冰箱保存。半胱天冬酶(caspase)-3、caspase-9活性检测试剂盒购于Chemicon公司。Bradford法蛋白含量检测试剂盒购于凯基生物技术公司。Trizol 试剂购于美国Invitrogen 公司,逆转录聚合酶链反应(RT-PCR)试剂盒购自Takara公司,Bcl-2、Bax、GAPDH 基因引物由IDT公司合成。兔抗人caspase-3、caspase-9、Bcl-2、Bax和GAPDH 单克隆抗体及辣根过氧化物酶(HRP)标记的鼠抗兔免疫球蛋白(Ig)G购自美国Cell Signaling公司,电化学发光(ECL)检测试剂盒购自Millipore公司。
1.2细胞培养 喉癌细胞株Hep-2于含5%胎牛血清(FBS)的RPMI1640培养液中,37℃,全湿度,5%CO2孵箱中传代培养。
1.3检测细胞凋亡情况 采用流式细胞术(FCM),取对数期生长的Hep-2细胞以1×106细胞数接种于培养瓶中,常规培养和同步化培养各24 h后,分别加入BAI(终浓度分别为20、40、80 μmol/L),设5个平行样,同时设阴性对照组。分别培养24、48 h后,经4℃、1 000 r/min离心,制成单层细胞悬液,取1 ml浓度为5×105个/ml细胞,4℃的70%乙醇固定24 h,加入含RNaseA的PI染液,37℃避光染色30 min,300目细胞筛过滤,混匀,待测。
1.4检测对caspase-3、9激活作用 按上述方法进行培养,并加入BAI(终浓度为20、40、80、120 μmol/L),同时设阴性对照组,设5个平行样。分别培养24、48 h后,按照说明书(Chemicon公司)操作,消化收集细胞,裂解细胞,提取蛋白并Bradford法定量后,用分光光度法分别检测各组OD405 nm(发色基团在此波长处存在最大吸收峰),由于不同活性的caspase-3及caspase-9对试剂盒提供的底物(序列特异性的多肽与发色基团耦联的复合物)的剪切能力与剪切下来的发色基团量呈正比,最后计算 OD给药组/OD阴性对照的倍数来表示 caspase-3、caspase-9活化程度。
1.5检测Bcl-2和Bax mRNA表达 按上述方法进行细胞培养,并分别加入BAI(终浓度为20、40、80 μmol/L),设阴性对照,继续培养至24 h或48 h,分别用Trizol法提取细胞总RNA,鉴定及定量后,用RT-PCR试剂盒将mRNA逆转录为cDNA,进行PCR反应。合成引物终浓度为2 μmol/L,引物序列,Bcl-2上游:5′-GTGGAGGAGCTCTTCAGGGA-3′,下游:5′-AGGCACCCAGGGTGATGCA-A-3′,扩增片段长度304 bp;Bax上游:5′-TCCACCAAGAAGCTGAGCGAG-3′,下游:5′-GTCCAGCCCATGATGGTTCT-3′,扩增片段长度257 bp;以GAPDH为内参,扩增片段长度为260 bp。PCR反应参数,Bcl-2为95℃ 5 min预变性,然后进入94℃ 1 min、63℃ 30 s、72℃ 30 s的循环,之后延伸72℃ 10 min,共28个循环;Bax 利用梯度(TD)-PCR,先94℃,5 min预变性,然后进入94℃ 30 s、62℃ 30 s、72℃ 2 min的循环,循环40次;最后以上个循环均进入延伸72℃,10 min。内参GAPDH用上述两个条件均可。PCR产物电泳后用凝胶电泳呈像分析系统进行拍照并分析。
1.6检测多种凋亡相关基因、蛋白酶及其酶原的蛋白表达 采用Western印迹法,按上述方法进行细胞培养,加入终浓度为40 μmol/L的BAI,设阴性对照,继续培养至24、48 h,按试剂说明书操作,收集细胞,磷酸盐缓冲液(PBS)洗涤2次后,裂解细胞提取蛋白,测定蛋白浓度。取含50 μg总蛋白样本进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),分离胶浓度为12%,浓缩胶浓度为5%,分段电压分别为80、120 V。电泳后,进行蛋白转聚偏氟乙烯(PVDF)膜,4℃100V,转膜1 h;然后室温摇床封闭1.5 h;充分洗膜后,加稀释的一抗(Bcl-2、Bax及GAPDH单克隆抗体按1∶200稀释;caspase-3、caspase-9单克隆抗体按1∶1 000稀释)4℃孵育过夜;充分洗膜后,加稀释的二抗(HRP-鼠抗兔IgG按1∶4 000)37℃孵育2 h,充分洗膜;按照ECL检测试剂盒操作;利用BIO-RAD凝胶成像及分析系统对各蛋白条带进行分析。
1.7统计学方法 采用SPSS18.0 统计软件进行单因素方差分析及t检验。
2 结 果
2.1BAI诱导细胞凋亡 随药物浓度增加,24 h BAI组细胞凋亡率逐渐增加,48 h BAI组细胞凋亡率逐渐增加,同时相同浓度组间,48 h凋亡率显著高于24 h,见表1;凋亡峰明显,见图1;各BAI组与阴性对照组差异有统计学意义(P<0.05);可诱导细胞凋亡,凋亡率增加具有时间和浓度依赖性。


图1 BAI组诱导Hep-2细胞凋亡

组别24h凋亡率48h凋亡率阴性对照组346±007360±037BAI组 20μmol/L1406±0161)1589±0221)2) 40μmol/L4169±0041)4434±0041)2) 80μmol/L6505±0041)7229±0041)2)
与阴性对照组比较:1)P<0.05;与24 h比较:2)P<0.05;下表同
2.2BAI激活caspase-3、9活性 随药物浓度增加,24 h BAI组caspase-3活性从阴性对照组的1.84倍增加到5.20倍;caspase-9活性从阴性对照组的1.53倍增加到3.74倍。48 h BAI组随药物浓度增加,caspase-3活性从阴性对照组的1.78倍增加到5.26倍;caspase-9活性从阴性对照组的1.83倍增加到4.75倍;各BAI组与阴性对照组差异有统计学意义(P<0.05)。同时相同浓度组间,48 h caspase活性显著高于24 h(P<0.05),见表2。提示BAI可以激活caspase-3、caspase-9活性,并具有时间和浓度依赖性。

表2 BAI对Hep-2细胞caspase-3及caspase-9活性的影响
2.3BAI影响Bcl-2及Bax基因mRNA表达 随BAI浓度增加,Bcl-2 mRNA表达逐渐减少,明显低于阴性对照组,48 h明显低于24 h;Bax mRNA表达随BAI浓度增加而增加,明显高于阴性对照组,48 h明显高于24 h;Bcl-2/Bax比随BAI浓度增加而降低,见图2、表3,各BAI组与阴性对照组差异有统计学意义(P<0.05)。表明BAI抑制癌基因Bcl-2 mRNA表达,促进抑癌基因Bax mRNA表达,具有时间和浓度依赖性。
2.4BAI影响多种凋亡相关基因、蛋白酶及其酶原的表达 40 μmol/L BAI作用后,与阴性对照组相比,随作用时间增加,BAI组抑癌基因Bax蛋白表达量增加,癌基因Bcl-2蛋白表达量减少;酶原蛋白(procaspase)-9蛋白表达量减少,与之相反,caspase-9蛋白表达量增加;procaspase-3蛋白表达量减少,caspase-3蛋白表达量增加,各BAI组与阴性对照组差异具有统计学意义(P<0.05),见图3和表4。BAI可以上调Bax、caspase-9、caspase-3蛋白表达水平,下调Bcl-2、procaspase-9、procaspase-3蛋白表达水平,具有时间依赖性。
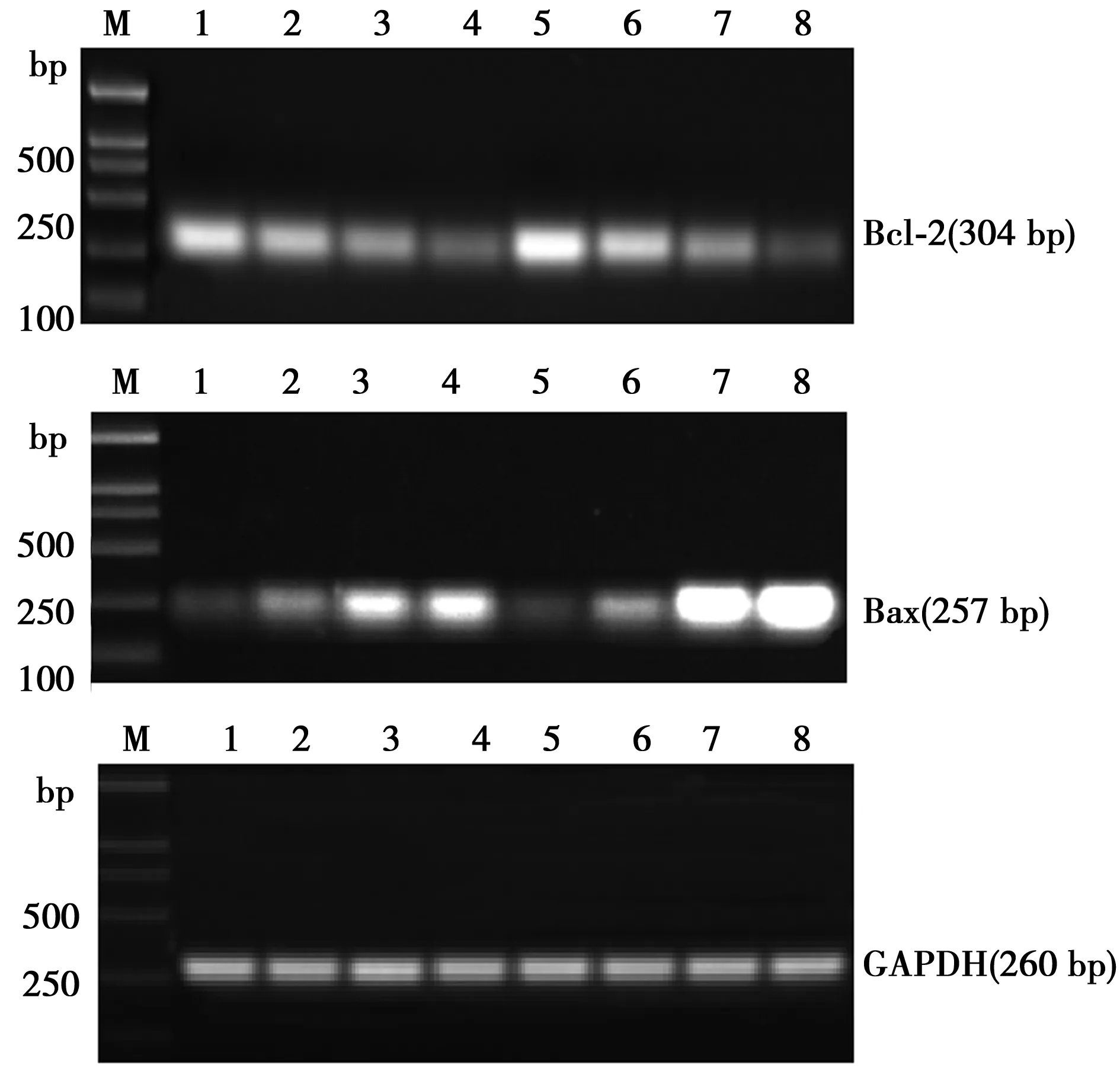
M:DL-2000Marker;1~4为24 h,分别为阴性对照组,BAI组20、40、80 μmol/L;5~8为48 h,分别为阴性对照组,BAI组20、40、80 μmol/L图2 BAI对Bcl-2、Bax mRNA表达的影响
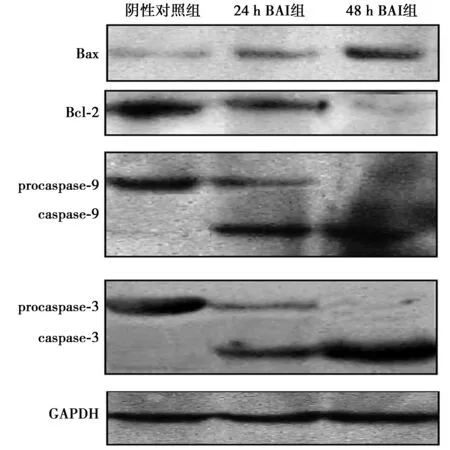
图3 Hep-2 细胞内Bax、Bcl-2、procaspase-9、caspase-9、procaspase-3、caspase-3蛋白表达
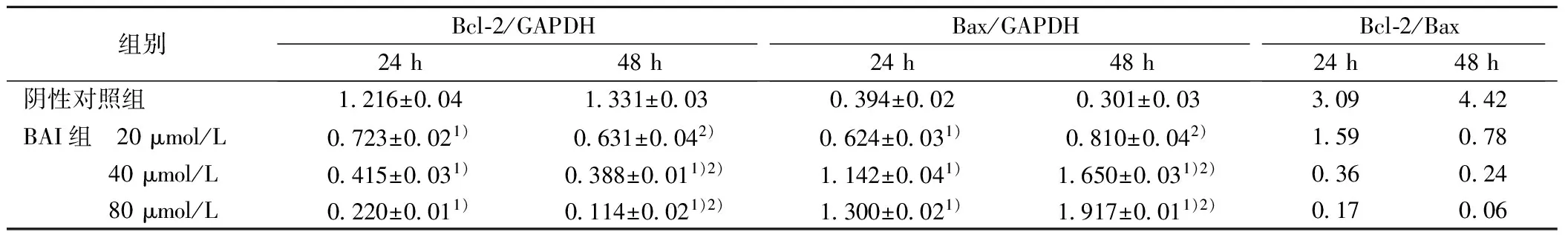
组别Bcl⁃2/GAPDH24h48hBax/GAPDH24h48hBcl⁃2/Bax24h48h阴性对照组1216±0041331±0030394±0020301±003309442BAI组 20μmol/L0723±0021)0631±0042)0624±0031)0810±0042)159078 40μmol/L0415±0031)0388±0011)2)1142±0041)1650±0031)2)036024 80μmol/L0220±0011)0114±0021)2)1300±0021)1917±0011)2)017006

表4 BAI对Bcl-2、Bax、procaspase-9、caspase-9、procaspase-3、caspase-3、蛋白相对表达的影响
3 讨 论
黄芩是一味历史悠久的中药材,医书对黄芩的记载始于《神农本草经》,BAI制剂在临床中应用于传染性肝炎、咽炎、急慢性胃肠炎、上呼吸道感染等多种疾病的治疗。BAI具有抗乳腺癌、食管癌、胃癌〔3,4〕等作用。本研究团队进行了一系列有关BAI对人喉癌hep-2细胞作用的研究〔7,8〕。细胞增殖和细胞凋亡都是生命的基本现象,保证机体的正常发育和健康。已有大量研究表明,肿瘤的发生是细胞增殖与细胞凋亡失衡所致,近年来通过诱导肿瘤细胞凋亡成为抗肿瘤的一个重要研究方向〔9,10〕。本文结果与前期研究〔7〕吖啶橙染色(AO)法检测到细胞在BAI(40、80 μmol/L)作用24 h后呈现典型的凋亡形态结果一致。
促凋亡基因活性受抑制和抗凋亡基因被激活是诱发肿瘤细胞凋亡而长期存活的主要原因,细胞凋亡是受基因调控的精确过程〔9〕。真核细胞凋亡途径主要包括死亡受体(外源性)途径、线粒体(内源性)途径、B粒酶途径及内质网途。细胞凋亡主要包括凋亡诱导、调控执行和效应3个阶段〔11〕。其中线粒体途径是介导细胞凋亡的主要途径〔12〕,Bcl-2、Bax家族和caspase在线粒体途径中发挥极为重要的作用〔13〕。Bcl-2家族分为Bcl-2亚家族(抗凋亡)、Bax亚家族(促凋亡)及BH3亚家族(促凋亡)三类20余种,其中Bcl-2和Bax是其中最重要的抗凋亡基因(癌基因)和促凋亡基因(抑癌基因)〔14〕。Bax存在于胞质中,在凋亡信号的诱导下,Bax转移到线粒体外膜处,先形成Bax/Bax二聚体,然后结合成簇〔15〕;与线粒体相互作用,降低线粒体跨膜电位,在Ca2+浓度升高的情况,改变线粒体通透性〔16,17〕。本实验结果提示BAI可以通过诱导Hep-2细胞Bax mRNA表达上调,进而上调Bax蛋白表达,线粒体外膜处聚集成簇,降低线粒体跨膜电位;BAI具有调控胞质Ca2+浓度升高的能力〔18〕,所以BAI接下来可以改变线粒体通透性。在线粒体凋亡途径中,线粒体通透性改变后,细胞色素(Cyt)C将从线粒体释放到胞质。而Bcl-2作为线粒体上的一种跨膜因子,将阻止Bax的这个过程,阻止CytC释放到胞质。本实验结果说明BAI可以通过下调Bcl-2表达和上调Bax,促进线粒体凋亡途径中CytC释放到胞质。在线粒体凋亡途径中,从线粒体释放到胞质的CytC进而与Apaf-1形成多聚体,并进一步与在胞质中以酶原形式存在的caspase-9前体形成凋亡小体,进而激活caspase-9。caspase是一类可引起细胞凋亡的关键蛋白酶,其中caspase-9是启动酶中最重要的一种,caspase-3是效应酶中最重要的一种〔19〕。本实验结果提示,BAI可以通过线粒体凋亡途径,进一步激活喉癌细胞的caspase-9。在线粒体凋亡途径中,激活的caspase-9作为启动酶,将进一步诱使procaspase-3激活为caspase-3;caspase-3作为最重要的效应酶,将进一步激活激活级联反应,将切断肽键、直接破坏细胞结构、降解细胞质、细胞核、细胞骨架、使染色质凝聚、DNA断裂为DNA梯度等,最终使得细胞凋亡〔17〕。BAI可以诱导Hep-2细胞出现DNA梯度〔8〕。说明BAI可以通过线粒体凋亡途径进一步激活caspase-3,并发挥其效应酶作用和后续级联反应,最终诱导细胞凋亡。此外,Bcl-2还有另一方面的作用,可以作为caspase-3的直接底物,抑制caspase-3的合成,抑制凋亡〔19〕。本实验结果表明,BAI促进caspase-3的合成,促进细胞凋亡。
综上,BAI通过上调Bax在mRNA和蛋白水平的表达,下调Bcl-2在mRNA和蛋白水平的表达及Bcl-2/Bax,促进Bax在线粒体外膜处聚集成簇,降低线粒体跨膜电位,进而降低线粒体跨膜电位,促进CytC释放到胞质,进而与激活的caspase-9及Apaf-1形成凋亡小体,进而激活caspase-3及后续线粒体凋亡途径,诱导喉癌Hep-2细胞凋亡。
1Li-Weber M.New therapeutic aspects of flavones:the anticancer properties of scutellaria and its main active constituents wogonin,baicalein and baicalin〔J〕.Cancer Treatment Rev,2009;35(1):57-68.
2辛文妤,宋俊科,何国荣,等.黄芩素和黄芩苷的药理作用及机制研究进展〔J〕.中国新药杂志,2013;22(6):647-53.
3张淑群,高晓燕,薛兴欢,等.黄芩素对人乳腺癌MDA-MB-231细胞株SATB1表达的影响〔J〕.中国肿瘤临床,2014;41(6):355-8.
4张 伟,刘宽浩.黄芩素对胃癌细胞VEGF和HGF表达的影响〔J〕.现代预防医学,2011;38(11):2135-7.
5陶振峰,申宇鹏.早期喉癌微创治疗研究进展〔J〕.解放军医药杂志,2017;29(11):114-6.
6中华耳鼻咽喉头颈外科杂志编辑委员会头颈外科组.喉癌外科手术及综合治疗专家共识〔J〕.中华耳鼻喉头颈外科杂志,2014;49(8):620-6.
7孙吉凤,刘剑凯,张淑芳.黄芩素对喉癌Hep-2细胞增殖的抑制作用〔J〕.中国医学创新,2015;12(21):4-6.
8孙吉凤,刘剑凯.黄芩素对喉癌细胞周期、凋亡率及凋亡细胞DNA的影响〔J〕.中国医学创新,2018;37(6):14-6.
9李 娜,高俊岩,刘 敏.细胞凋亡和肿瘤的关系研究进展〔J〕.当代医学,2009;15(16):13-4.
10欧阳高亮,李祺福,洪水根.细胞凋亡与肿瘤的发生发展和治疗〔J〕.国外医学·肿瘤学分册,2000;27(5):266-8.
11李 敏,林 俊.细胞凋亡途径及其机制〔J〕.国际妇产科学杂志,2014;41(2):103-7.
12阎 海.细胞凋亡研究进展〔J〕.中山大学研究生学刊(自然科学、医学版),2012;33(3):8-13.
13岳原亦,张 扬,张一奇.Caspase家族与细胞凋亡〔J〕.中国医疗前沿,2011;6(6):25-6.
14董雅洁,高维娟.Bcl-2、bax、caspase-3在细胞凋亡中的作用及其关系〔J〕.中国老年学杂志,2012;32(21):4828-30.
15刘 志,郑 军.Bcl-2家族蛋白及其在细胞凋亡中的作用〔J〕.生命的化学,2007;27(1):22-5.
16王 彤,刘存志,刘玉珍,等.bcl-2 /bax 基因调控机体细胞凋亡的机制研究进展〔J〕.中国老年学杂志,2008;28(16):1658-60.
17Odonkor CA,Achilefu S.Modulation of effector caspase cleavage determines response of breast and lung tumor cell lines to chemotherapy〔J〕.Cancer Invest,2009;27(4):417-29.
18Kim SJ,Kim HJ,Kim HR,etal.Antitumor actions of baicalein and wogonin in HT-29 human colorectal cancer cells〔J〕.Mol Med Rep,2012;6(6):1443-9.
19Ricci JE,Munoz-Pinedo C,Fitzgerald P,etal.Disruption of mitochondrial function during apoptosis is mediated by caspase cleavage of the p75 subunit of complex I of the electron transport chain〔J〕.Cell,2004;117(6):773-86.

