乙醛脱氢酶的克隆表达及其酶学性质
豆欣喜,张明,林材,吴殿辉,李晓敏,孙军勇,蔡国林,陆健*
1(江南大学,工业生物技术教育部重点实验室,江苏 无锡,214122) 2 (江南大学,粮食发酵工艺与技术国家工程实验室,江苏 无锡,214122) 3 (江南大学 生物工程学院,江苏 无锡,214122) 4(江苏省农垦麦芽有限公司,江苏 射阳,224300) 5(华润雪花啤酒有限公司,河北 秦皇岛,066001)
乙醇在人体内的代谢主要靠体内的2种酶[1],一种是乙醇脱氢酶(alcohol dehydrogenases, ADH, EC1.1.1.1),将乙醇氧化成乙醛;另一种是乙醛脱氢酶(Acetaldehyde dehydrogenase,ALDH,EC 1.2.1.10),将乙醛氧化成乙酸。一般情况下,ADH可充分表达,缺乏ALDH的个体比较多,导致乙醛在体内大量积累,产生醉酒症状[2],同时会损伤肌体细胞,容易诱发肝癌[3]。目前,在人体中已发现19种ALDH,主要分布在肝、胃、心脏等器官中,最常见的有ALDH1、ALDH2、ALDH3、ALDH4四种[4]。其中,参与乙醛氧化的主要是ALDH1和ALDH2,ALDH2 的催化活性是ALDH1的10倍[5]。所以ALDH2是人体酒精代谢的关键酶,近年来,随着人们对获得全新的、更有效的解酒保肝药物的需求日益迫切,关于高效表达乙醛脱氢酶2编码基因ALDH2的研究工作更显出其深远意义。
很多科研工作者将ALDH2基因导入大肠杆菌或毕赤酵母的表达体系中,以构建高产ALDH2的工程菌[6-7]。但是大肠杆菌是一种致病菌,毕赤酵母表达ALDH2时需要用甲醇诱导,这对产物的安全性具有一定的影响,解酒药物的研究也受到了限制。酿酒酵母Saccharomycescerevisiae作为第一个完成全基因组测序的真核生物[8],很早就被应用于食品和饮料工业,已被成功地表达了大量的真核外源蛋白,酿酒酵母能对外源蛋白质进行一定程度上的折叠加工和糖基化修饰,这有利于保持生物产品的活性和稳定性[9-11]。
但是酿酒酵母表达系统仍有缺点:与大肠杆菌表达系统和经甲醇诱导的毕赤酵母表达相比,游离的质粒在酿酒酵母中表达,由于没有选择条件的压力,在发酵过程中会出现质粒丢失的问题;整合到酵母基因组上的质粒虽然稳定性好,但质粒不能独立于酵母染色体外进行自主复制,这就会出现拷贝数低,目的产物表达量不高的问题。综合上述各种表达系统的优缺点,本研究将人源ALDH2基因针对酿酒酵母进行了密码子偏好性优化后,与组成型强启动子TPIp一同整合到酵母的基因组上来表达人源ALDH2基因;在工程菌发酵过程中不需要添加诱导剂,产物相对比较安全,并对该重组酶的最适作用温度、最适pH、温度稳定性、pH稳定性、金属离子对比酶活的影响以及动力学进行了研究,以期为解酒酶制剂的研究提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌种和质粒
酿酒酵母SaccharomycescerevisiaeW303-1A(MATaΔura3 Δtrp1 Δleu2 Δhis3)和N85(MATa/MATα),大肠杆菌EscherichiacoliJM109以及表达质粒pYX212均由本实验室保存,克隆载体pMD18-T simple vector购自宝生物工程(大连)有限公司。其中:质粒pYX212携带有Ampr抗性基因和磷酸丙糖异构酶的组成型强启动子TPIp及其终止子TPIt。
1.1.2 主要酶和试剂
Prime STAR DNA Polymerase,ExTaqDNA Polymerase,rTaqDNA Polymerase,T4DNA Ligase,BamH I,EcoR I,Mini BEST Universal Genomic DNA Extraction Kit试剂盒,DNA Marker、标准蛋白Marker均购自宝生物工程(大连)有限公司;SanPrep柱式质粒DNA小量抽提试剂盒、胶回收试剂盒、氨苄青霉素(Amp)、YNB(Yeast Nitrogen Base)、L-亮氨酸、L-色氨酸、L-组氨酸、腺嘌呤、蜗牛酶和辅酶NAD+购自生工生物工程(上海)股份有限公司,其他试剂均为市售国产或进口分析纯产品。目的基因ALDH2及引物均由生工生物工程(上海)股份有限公司合成,DNA片段测序均由上海睿迪生物技术有限公司完成。
1.1.3 主要仪器
琼脂糖凝胶电泳仪,美国Bio-Rad公司;JD-801凝胶成像仪,江苏省捷达科技发展有限公司;Spectra Max Plus 384酶标仪,美国MDC公司;His TrapTMexcel(1 mL)色谱柱,GE Healthcare公司;Mastercycler pro PCR仪,德国Eppendorf公司。
1.1.4 目的基因和引物的合成
将GeneBank中人源乙醛脱氢酶2的基因序列根据酿酒酵母(S.cerevisiae)的密码子偏好性进行密码子优化后合成目的基因ALDH2,连接克隆载体pUC57后,得到重组质粒pUC57-ALDH2。其中,ALDH2基因的两端分别具有BamHI和EcoRI的酶切位点。

表1 本实验中所使用的引物Table 1 Primers used in the study
注:下划线为用于融合PCR的重叠序列。
1.2 实验方法
1.2.1 重组质粒pYX212-ALDH2的构建
重组质粒pYX212-ALDH2的构建过程如图1所示。首先,使用SanPrep柱式质粒DNA小量抽提试剂盒提取质粒pUC57-ALDH2和pYX212,分别经EcoR I和BamH I双酶切,用胶回收试剂盒回收目的基因ALDH2(1 542 bp)和线性化载体pYX212(8 346 bp),然后在T4连接酶的作用下,16 ℃保温过夜,将目的基因与载体连接,并转化至大肠杆菌JM109的感受态细胞[12],涂布含有Amp的LB筛选培养基平板,37 ℃培养12 h左右,挑取平板上长出的菌落使用引物F5/R5进行菌落PCR,并且提取阳性克隆子的质粒分别进行双酶切和测序验证。

图1 重组质粒pYX212-ALDH2的构建
Fig.1 Construction of recombinant plasmid pYX212-ALDH2
1.2.2 人源ALDH2基因表达组件TRP1L-URA3-TPIp-ALDH2-TPIt-TRP1R的构建
以酿酒酵母W303-1A的基因组为模板,以F1/R1和F4/R4为引物,利用Prime STAR DNA Polymerase分别扩增TRP1基因的上游同源臂TRP1L和下游同源臂TRP1R;以酿酒酵母N85的基因组为模板,以F2/R2为引物扩增完整的筛选标记基因URA3;以重组质粒pYX212-ALDH2为模板,以F3/R3为引物扩增含有TPI的启动子和终止子以及目的基因ALDH2的片段TPIp-ALDH2-TPIt。PCR产物经过琼脂糖凝胶电泳分离后,分别回收上述TRP1L、TRP1R、URA3以及TPIp-ALDH2-TPIt四个片段。
表达组建的构建过程如图2所示。基于融合PCR的原理,采用一种高效构建基因表达组件的方法,以等摩尔的TRP1L、URA3、TPIp-ALDH2-TPIt和TRP1R为模板,不加引物,在Prime STAR DNA Polymerase的作用下,进行touchdown PCR(15个循环)将上述4个片段进行融合;再以融合的产物为模板,以P1/P4为引物,在ExTaqDNA Polymerase的作用下进行常规PCR(15个循环)扩增表达组件[13]。

图2 工程菌酵母构建示意图
Fig. 2 Construction of the engineering yeast strain
1.2.3 基因工程菌的构建
基因工程菌的构建过程如图2所示。利用电转化的方法将上述获得的表达组件(TRP1L-URA3-TPIp-ALDH2-TPIt-TRP1R)转入到尿嘧啶营养缺陷型的酿酒酵母W303-1A中,通过同源重组的方式将表达组件整合到酵母的基因组上,整合位点是trp1基因,电转参数为1 800 V,4~5 ms。
1.2.4 基因工程菌的鉴定
酿酒酵母W303-1A为尿嘧啶缺陷型菌株,在不含尿嘧啶的培养基上无法生长,当ALDH2基因表达组件整合到基因组上时,由于组件上含有完整的URA3基因,阳性转化子就可以在不含尿嘧啶的培养基上生长。因此,可以利用酵母菌的这个特性,使用SC-URA3培养基筛选整合成功的酿酒酵母。
提取平板上转化子的基因组,以F1/R4为引物进行PCR验证。为了进一步鉴定整合位点是否正确,再以整合位点向外分别在500 bp的位置重新设计引物F6/R6,以转化子的基因组为模板,进行PCR扩增,回收正确的PCR扩增条带进行测序验证。
1.2.5 发酵产酶实验
对原始菌和工程菌分别进行培养和产酶实验,具体方法如下:将斜面培养基保存的菌株在新鲜的YPD平板培养基上划线,于30 ℃活化培养至菌落长出(约36~48 h)。挑取单菌落接种至含3 mL的YPD培养基的小试管中,30 ℃,200 r/min培养24 h。取2 mL培养液(1%接种量)于200 mL的YPD液体培养基中,30 ℃,200 r/min振荡培养,在培养48、72、96、120 h时,分别取5 mL的发酵液用于酶活测定。
发酵液的处理:5 mL的发酵液在8 000 r/min条件下离心5min,用无菌水洗涤菌体1次,再用液氮冷冻菌体10 min,最后加入和菌体等体积的酸洗玻璃珠和600 μL的PBS缓冲液(20 mmol/L PBS, 0.15 mol/L NaCl),在涡旋振荡器上振动30 s,之后在冰上放置1 min,重复15个循环,10 000 r/min离心5 min,上清液即是粗酶提取液,用于酶活和蛋白含量的测定。
1.2.6 蛋白质含量和酶活的测定
采用考马斯亮蓝法(CBB)[14]测定蛋白质含量。
乙醛脱氢酶酶活检测方法:酶、辅酶NAD+和底物在一定条件下反应,通过测定一定时间的340 nm处吸光度的变化值,可计算出NAD+转化为 NADH 的量,从而得到该酶的酶活[15]。酶活定义:35 ℃下,每分钟内OD340值发生0.001的数量变化定义为1个活力单位。反应体系里 ALDH 的酶活计算公式[16]为:

(1)

(2)
本实验的测定体系参考 Okibe 的反应体系[17]并进行了一定的改进。

表2 ALDH酶活测定反应体系Table 2 The enzyme activity assay of ALDH
加入酶液之前先将反应体系在35 ℃温浴10 min,然后加入酶液10 μL,迅速用酶标仪测340 nm下吸光度值的变化,在连续5 min内,每隔1 min读取1次吸光度值,根据公式(1)、(2)计算酶活。
1.2.7 重组ALDH2的分离纯化
由于酵母自身的乙醛脱氢酶的酶活很高,为了尽量去除干扰,必须先分离纯化后才能进行人源ALDH2的酶学性质研究[18]。用YPD培养基对工程菌进行发酵培养,取发酵96 h的发酵液收集菌体,用蒸馏水洗涤菌体,加入10倍菌体的PBS缓冲液重悬菌体,由于发酵液处理量比较大,改用蜗牛酶进行破碎酵母细胞壁,提取胞内蛋白,按30 mg/g菌体的比例加入蜗牛酶,37 ℃水浴1 h破碎酵母细胞壁,离心,上清即为粗酶提取液。
利用镍柱亲和层析的方法对粗酶液进行纯化并对纯化后的人源ALDH2进行SDS-PAGE检测,分析蛋白纯化的效果和人源ALDH2的分子量大小。
1.2.8 重组ALDH2的酶学性质研究
重组ALDH2的最适pH及其pH稳定性:为探究最适pH,将酶活测定体系的Tris-HCl(pH 9.2)和水换成不同pH梯度(pH 3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0)的广泛缓冲液,其余条件不变,测定人源ALDH2的酶活,最高酶活计为100%,计算不同pH缓冲液中ALDH2的相对酶活。把酶液在上述不同pH条件下处理2 h后,测定其残余酶活,以未经处理的酶活力为100%。
重组ALDH2的最适温度及其温度稳定性:为探究人源ALDH2最适温度,将反应体系分别在不同温度(25、30、35、40、45、50、55、60 ℃)下测其酶活,以测得的的最高酶活为100%,计算其它温度下的相对酶活;将酶在上述不同温度下保温2 h后,测定残余酶活,以未经处理的酶活力为100%。
金属离子对重组ALDH2活性的影响:在酶的反应体系中加入终浓度为0.1 mol/L的金属离子(K+、Mg2+、Mn2+、Ca2+、Na+),对重组ALDH2进行酶活测定,以未加任何金属离子为对照。
重组ALDH2的动力学研究:将纯化的酶加入到含有不同底物浓度乙醛(0.208~3.33 mmol/L)和不同浓度辅酶NAD+(0.083~1.33 mmol/L)中,利用Lineweavere-Burk plot法计算获得ALDH2对乙醛的Km值、Vmax值和ALDH2对辅酶NAD+的Km值、Vmax值。
2 结果与分析
2.1 工程菌的构建与鉴定
2.1.1 重组质粒pYX212-ALDH2的构建与鉴定
按照上述1.2.1的方法构建重组质粒pYX212-ALDH2,挑取平板上长出的菌落,37 ℃,180 r/min床菌过夜培养后提取其质粒,经BamHI和EcoRI双酶切鉴定,如图3所示,经过双酶切后,得到1条1 500 bp左右的条带,与预期片段1 542 bp大小相符,并通过测序验证,表明重组质粒pYX212-ALDH2构建成功。
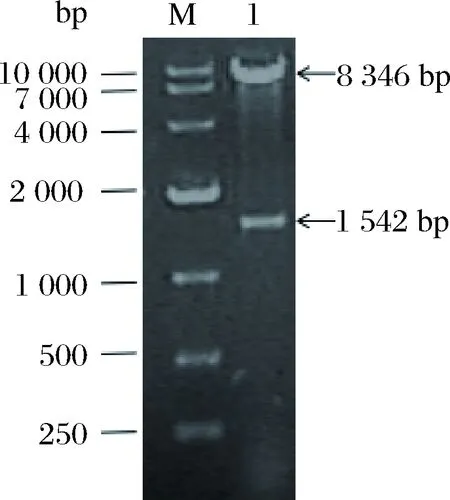
M-10000 Marker;1-重组质粒双酶切的鉴定结果
图3 重组质粒的双酶切鉴定
Fig.3 Identification of recombinant plasmid by double digestion
2.1.2 表达组件TRP1L-URA3-TPIp-ALDH-TPIt-TRP1R的构建与鉴定
按照1.2.2所述的融合PCR的原理和方法,构建ALDH2的基因表达组件TRP1L-URA3-TPIp-ALDH-TPIt-TRP1R。首先通过PCR获得4个融合片段TRP1L(269 bp)、TRP1R(255 bp)、URA3(1235 bp)和TPIp-ALDH2-TPIt(2 614 bp),利用融合PCR将4个片段进行融合,如图4所示,获得的融合片段大小为4 400 bp左右,与预期的片段大小(4 373 bp)相符,证明已融合成功,并将融合成功的片段与T载体连接,通过测序验证了其序列的正确性。

M-5 000 Marker;1~3-表达组件的PCR结果(4 400 bp)
图4 表达组件的融合与鉴定
Fig.4 The fusion and verification of expression cassette
2.1.3 基因工程菌的构建及鉴定
在trp1基因的整合位点处向两端550 bp左右的位置设计引物F6/R6,挑取SC-URA3平板上的转化子,经过YPD培养基活化后提取基因组作为模板,以引物F6/R6进行PCR验证,如图5所示,空白对照无任何条带,阴性对照只能扩增出1 100 bp左右的片段,转化子能扩增出5 500 bp左右的片段,与预期的片段大小相符,将图5的片段胶回收,通过测序验证了其序列和整合位点的正确性,将工程菌命名为W303-ALDH2。
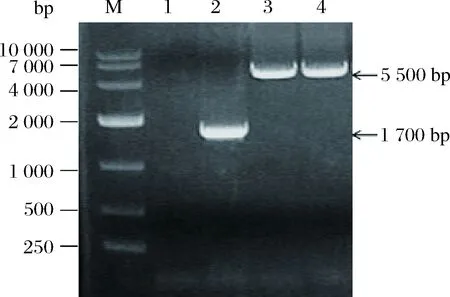
M-10 000 Marker;1-空白对照;2-阴性对照;3~4-转化子的PCR结果
图5 表达组件整合位点的鉴定
Fig.5 Identification of component integration sites
2.2 发酵时间对产酶的影响
按照1.2.5的方法对发酵液进行处理并测粗酶液中乙醛脱氢酶的酶活,如图6所示,可知工程菌W303-ALDH2的粗酶提取液中乙醛脱氢酶的酶活略高于原始菌的酶活且最佳的发酵时间是96 h,酶活达到4 790 U/L。

图6 不同菌株的产酶曲线
Fig.6 The production curve of ALDH2 by different strains
2.3 重组ALDH2的分离纯化
用1 mL His TrapTMexcel亲和色谱柱对重组ALDH2进行分离纯化,将纯化后的酶液进行SDS-PAGE鉴定,结果如图7所示,泳道4有1条56 kDa左右的蛋白质条带,符合理论值的大小,大部分的杂蛋白从穿透峰中流出。收集洗脱峰对重组ALDH2进行酶学性质研究。

M-蛋白Marker;1-原始菌的穿透峰;2-原始菌的洗脱峰;3-工程菌的穿透峰;4-工程菌的洗脱峰
图7 重组ALDH2纯化后SDS-PAGE分析
Fig.7 SDS-PAGE analysis of purified recombinant ALDH2
2.4 重组ALDH2的活性检测与酶学性质研究
收集洗脱峰对其活性进行检测,纯化后酶的活力为20.70 U/mg。重组ALDH2最适作用pH及pH稳定性的研究如图8所示,重组ALDH2的最适反应pH为5.0,在pH 3.0和pH 4.0的酸性条件下,仍能保持高于80%的比酶活力,但是重组ALDH2在酸性条件下不稳定,在不同酸性条件下处理2 h后,在pH 5.0时,仅保留20%的比酶活力,在碱性条件下处理2 h,保留高于60%的比酶活力。
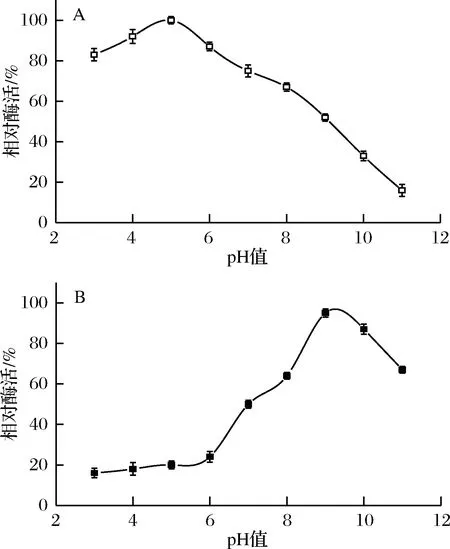
图8 pH对重组ALDH2酶活(A)及其稳定性(B)的影响
Fig.8 Effect of pH value on the activity (A) and stability (B) of recombinant ALDH2
重组ALDH2最适作用温度及温度稳定性的研究如图9所示,重组ALDH2的最适作用温度为35 ℃,高于45 ℃时,酶活迅速下降;在低于40 ℃时有较好的热稳定性,当在温度高于55 ℃保温2 h后,酶活完全丧失。

图9 温度对重组ALDH2酶活(A)及其稳定性(B)的影响
Fig.9 Effect of temperature on the activity (A) and stability (B) of recombinant ALDH2
金属离子对重组ALDH2活性的影响如图10所示,Na+对ALDH2有轻微的抑制作用,比酶活是对照组的80%,K+、Ca2+、Mg2+、Mn2+均能提高ALDH2的酶活,但是从提高酶活的稳定性考虑,K+是最佳的ALDH2酶活促进剂。

图10 金属离子对重组ALDH2酶活的影响
Fig.10 Effect of metal ions on the activity of recombinant ALDH2
2.5 重组ALDH2的动力学常数
利用Lineweavere-Burk双倒数作图分别求取人源ALDH2对底物乙醛和辅酶NAD+的Km值和Vmax值,人源ALDH2作用底物乙醛的米氏方程为y=0.007 9x+0.008 7(R2=0.998 9),求得米氏常数Km为0.908 mmol/L,最大反应速度Vmax为114.94 U/mg;人源ALDH2作用辅酶NAD+的米氏方程为y=0.004 8x+0.017(R2=0.993 6),求得米氏常数Km为0.282 mmol/L,最大反应速度Vmax为58.82 U/mg。
3 讨论
本研究从酿酒酵母W303-1A单倍体出发,基于融合PCR技术,将人源的ALDH2基因的表达组件TRP1L-URA3-TPIp-ALDH2-TPIt-TRP1R整合到酵母的基因组上,整合位点是trp1基因,整合成功的基因工程菌命名为W303-ALDH2,整合到宿主菌的基因组上实现了ALDH2基因的稳定表达,与游离质粒表达相比,不会出现目的基因随着传代的次数增多而丢失的现象。
发酵实验结果表明,工程菌和原始菌的最佳产酶的发酵时间是96 h,工程菌的粗酶提取液的酶活达到了4 790 U/L,其乙醛脱氢酶表达水平仍不太理想,可能是因为外源基因拷贝数较低或者是酵母本身的乙醛脱氢酶基因的表达抑制了外源基因的表达等其它原因,后期将通过工程菌本身携带的主要的乙醛脱氢酶基因进行敲除来提高人源ALDH2基因的表达。
重组ALDH2用镍柱进行分离纯化,纯化后的比酶活力是20.70 U/mg,对人源ALDH2的基本酶学性质进行研究,结果表明该酶的最适温度是35℃,最适pH是5.0,在pH 3.0的酸性条件下仍能保持80%左右的比酶活力,这为解酒酶制剂的生产提供了现实可能性,但是该酶在酸性条件下不稳定,在酸性条件下处理2 h后,酶活大大降低,仅保留20%左右的比酶活力,后期仍需在提高酶的酸性稳定性方面做研究。
除Na+外,K+、Ca2+、Mg2+、Mn2+均能不同程度地提高ALDH2的酶活;以乙醛为底物测得酶的Km值为0.908 mmol/L,最大反应速度Vmax为114.94 U/mg;以辅酶NAD+为底物测得酶的Km值为0.282 mmol/L,最大反应速度Vmax为58.82 U/mg。
与用大肠杆菌表达的乙醛脱氢酶和毕赤酵母经过甲醇诱导发酵的乙醛脱氢酶相比,本实验的人源ALDH2基因与酵母强组成型启动子磷酸丙糖异构酶(TPI)启动子融合,在发酵过程没有诱导剂的加入,产物的安全性大大的提高,并且该酶的最适温度和最适pH都较接近于人体环境,这为解酒酶制剂的开发提供了理论可能性。

