不同浓度环孢菌素A处理对牛肉宰后成熟过程中品质及细胞凋亡因子的影响
马秀利,王琳琳,韩玲*,余群力,殷元虎,韩广星,朱跃明
1(甘肃农业大学 食品科学与工程学院,甘肃 兰州,730070) 2(黑龙江省畜牧研究所,黑龙江 齐齐哈尔,161005) 3(山东绿润食品有限公司,山东 临沂,276600) 4(张掖市万禾草畜产业科技开发有限责任公司,甘肃 张掖,734000)
宰后成熟是肌肉在内环境改变条件下发生的复杂的生理生化反应过程,可提高肌肉品质,尤其能有效改善肌肉的嫩度及风味。目前关于宰后肌肉成熟嫩化的主要理论是肌肉结构变化及肌原纤维骨架蛋白的有限降解而使肌肉嫩化[1]。随着肉品理论的不断发展与完善,继组织蛋白酶和钙激活酶之后,细胞凋亡酶(Caspases)降解肌原纤维蛋白理论逐渐被认为是改善宰后肌肉嫩度的重要因素。CsA是一种从真菌中提取的含有11个氨基酸的环多肽,具有强烈的特异性作用[2]。大量研究表明CsA对细胞凋亡(apoptosis)的发生具有一定的调节作用,它能够与线粒体通透性转运孔(mitochondrial permeability transport pore,MPTP)的结构蛋白亲环素D相互作用,通过调节MPTP的开放,间接调节Cyt-c从线粒体释放到胞浆中,进一步调节apoptosis级联反应的发生[3-4]。
Apoptosis又称细胞程序性死亡,其在生物体的进化、内环境稳定以及多个系统的发育中起重要作用[5]。Apoptosis对肌肉的嫩化作用是近年来肉品科学研究的热点,尤其在apoptosis对肌原纤维蛋白降解方面国内外学者做了大量研究。陈琳[6]研究指出凋亡诱导剂喜树碱、依托泊苷及Ca2+均能提高肌原纤维的水解;HUANG等[7]利用Caspase-3的选择性抑制剂DEVE-CHO处理宰后肌肉时发现,DEVE-CHO可以抑制肌肉骨架蛋白的降解,以上研究说明Caspases能够降解肌细胞骨架蛋白进而改善肌肉嫩度。此外,贾青[8]、孙志昶等[9]、ZHANG等[10]研究发现apoptosis与其他肉品质特征如保水性、色泽显著相关。有关Caspases对宰后肌肉嫩度改善的相关研究报道较多,但有关MPTP抑制剂CsA对宰后肌肉apoptosis的发生及其对肌肉品质影响机制的相关研究,国内外鲜有报道。
本研究以不同浓度CsA溶液处理的牛背最长肌肉样为研究对象,通过测定肌肉宰后成熟过程中品质指标(pH值、色泽、保水性及嫩度)和apoptosis因子(胞浆Cyt-c含量、Caspase-9、Caspase-3活性)等指标的变化,研究CsA处理对apoptosis的影响作用,并探究apoptosis的发生对宰后肌肉品质的影响,以期为apoptosis改善肌肉品质提供理论依据。
1 材料与方法
1.1 试验材料与试剂
试验材料:肉牛由张掖博峰肥牛开发有限公司提供,选择在同一牧场,生长发育正常,健康无病,体重均匀,平均年龄2~4 岁的肉牛8头,公母各半,宰前禁食16~18 h,禁水2 h,屠宰后立即取牛胴体中部背最长肌肉样,置于0~4 ℃环境下成熟。
试验试剂:Caspase-9、3活性测定试剂盒,北京普利莱基因技术有限公司;环孢菌素A、细胞色素C、二甲基亚砜、连二亚硫酸钠、蔗糖、乙基苯基聚乙二醇、2-氨基-2(羟甲基)-l,3-丙二醇(Tris)、酒石酸钾钠、KCl、MgCl2、EDTA、K3PO4、NaN3、CuSO4、HCl、NaCl等,以上试剂均为分析纯。
1.2 仪器与设备
TGL-16M型离心机,长沙湘仪离心机仪器有限公司;XHF-D-型高速分散器(内切式匀浆机),宁波新芝生物科技股份有限公司;FA2004B型电子天平,上海佑科仪器有限公司;C-LM4 型数显式肌肉嫩度仪,上海精密科学仪器有限公司;SPectramax M2型酶标仪,美国美谷分子仪器有限公司;DNP-9162型水浴锅,上海精宏实验设备有限公司;CR-10型色差计,柯尼美能达有限公司;HI99163型便携式pH计,意大利哈纳HANNA仪器公司。
1.3 试验方法
1.3.1 样品采集与处理
宰后立即取牛胴体中部背最长肌肉样,去除表面脂肪、筋腱及结缔组织后,分割为每块100 g左右的肉样,按照肉液比10∶1的比例,将4种浓度0.10、0.20、0.25、0.30 mol/L 的CsA溶液均匀注射进肉块中,不作任何处理的肉样为对照组;采用托盘包装,在0~4 ℃环境下成熟。在成熟时间点12、24、48、96及144 h分别测定pH值、肉色、蒸煮损失及剪切力等指标,测定之前用滤纸吸去肉样渗出的汁液,对于肌原纤维小片化指数(MFI)、胞浆Cyt-c含量及Caspase-9、3活力等不便立即测定的指标,将肉样在设计时间点采集并用液氮迅速冷却后置于-80 ℃冻藏待测。
1.3.2 pH值测定
将便携式pH计的探针插入肉样中,使pH计的电极与肌肉组织充分接触,读数稳定后记录数据,每个肉样重复测定3次,取平均值。
1.3.3 肉色测定
测定肉样表面的L*值、a*值和b*值,将肉样切开形成新的横断面并在室温下氧合40 min,色差计进行白板校正后,将色差仪探头垂直放在样品横断面上进行测量,每个肉样重复测定3次,取平均值作为该肉样的色差值。
1.3.4 蒸煮损失
将长×宽×高不少于6 cm×3 cm×3 cm的肉样,修整去除肉块表面的脂肪和结缔组织,称重记为Ma,80 ℃恒温水浴加热,用数显温度计记录加热过程中肉块的中心温度。当中心温度达到75 ℃时,恒温保持5 min后取出冷却至室温,再次称重记为Mb,蒸煮损失计算公式为:
蒸煮损失/%=(Ma-Mb)/Mb×100
(1)
式中:Ma为蒸煮前肉样质量;Mb为蒸煮后肉样质量。
1.3.5 嫩度
1.3.5.1 剪切力
剪切力肉样处理方法同蒸煮损失测定方法,用剪切力仪测定剪切力,每组重复3次,取平均值。
1.3.5.2 MFI
参考DELGADO等[11]的方法并稍作修改。测定取2 g肉样,加20 mL的MFI缓冲液(100 mmol/L KCl、20 mmol/L K3PO4、1 mmol/L EDTA、1 mmol/L MgCl2、1 mmol/L NaN3,pH 7.1),然后匀浆(10 000 r/min,匀浆时间12 s/次,间隙30 s,连续5次,在冰水浴下进行)。匀浆液在4 ℃条件下1 000×g离心15 min,弃去上清液。沉淀用8 mL的MFI缓冲液悬浊、再离心,弃去上清液。沉淀用5 mL的MFI缓冲液,用200目尼龙筛网过滤该悬浊液,另用5 mL MFI缓冲液帮助肌原纤维蛋白通过滤网。过滤所得的肌原纤维蛋白悬浊液用双缩脲法测定其蛋白含量,然后用MFI缓冲液将其质量浓度稀释至0.5 mg/mL,然后在540 nm下测定其吸光度,将结果乘以200,即为MFI。
1.3.6 胞浆Cyt-c含量
参考辛国荣等[12](2007)方法并稍作修改。取组织块在冷水的生理盐水中漂洗除去血液,滤纸拭干,称重。加预冷匀浆介质(pH 7.4,0.1 mol/L Tris-HCl,1 mmol/L KCl,1 mmol/L EDTA-2Na,0.25 mol/L蔗糖(均用去离子水配制)的体积总量是组织块重量的9倍,进行组织匀浆(10 000 r/min,匀浆时间12 s/次,间隙30 s,连续5次,在冰水浴下进行)。匀浆液经离心(2 000 r/min,10 min),弃沉淀。取上清液以18 000 r/min(低温高速离心机)离心15 min,上清液即为胞浆。取4 mL待测胞浆样品,加少许连二亚硫酸钠(0.025 g),振摇后,在520 nm处测定吸光度,由标准曲线计算其浓度。
1.3.7 Caspase活力
1.3.7.1 Caspase-9活力
按照Caspase-9活性检测试剂盒说明书对Caspase-9的活性进行测定,并稍作修改。取90 mg组织肉样,剪碎后加入150 μL Caspase-9裂解液,用玻璃匀浆机于4 °C匀浆30次。匀浆液于4 ℃,10 000g离心10 min,离心完毕后取上清液待测。取85 μL Caspase-3反应缓冲液,10 μL待测上清液,5 μL 2 mm Caspase-9反应底物Ac-LEHD-AMC,依次加入96孔酶标板中,对照孔加入95 μL反应缓冲液,5 μL Caspase-9反应底物DEVD-pNA,用封口膜封住,置于37 ℃恒温箱中反应1~2 h,取下封口膜,用酶标仪在405 nm处测定吸光度值。
1.3.7.2 Caspase-3活力
按照Caspase-3活性检测试剂盒说明书对Caspase-3的活性进行测定,并稍作修改。样品处理及操作同Caspase-9活性检测方法,用酶标仪在405 nm处测定吸光度值。
1.4 统计分析
试验结果均采用平均值 ± 标准差表示,用SPSS 19.0统计分析软件进行数据处理,多重比较分析采用Duncan法(p<0.05),用Origin 8.5作图软件进行图形制作。
2 结果与分析
2.1 不同浓度CsA处理对肌肉pH值的影响
由图1可知,随着成熟时间的延长,对照组及处理组pH值均呈先下降后上升的变化趋势。对照组pH值在宰后96 h下降到最小值为5.56,随后缓慢上升(p<0.05);处理组pH值在96 h下降到最小值,随后缓慢上升(p<0.05)。12~48 h,处理组pH值均高于对照组,且pH值随CsA浓度的增加而升高,但0.25 mol/L处理组pH值均高于其他处理组,且0.10和0.20 mol/L处理组、0.25和0.30 mol/L处理组的pH值无显著差异(p>0.05)。
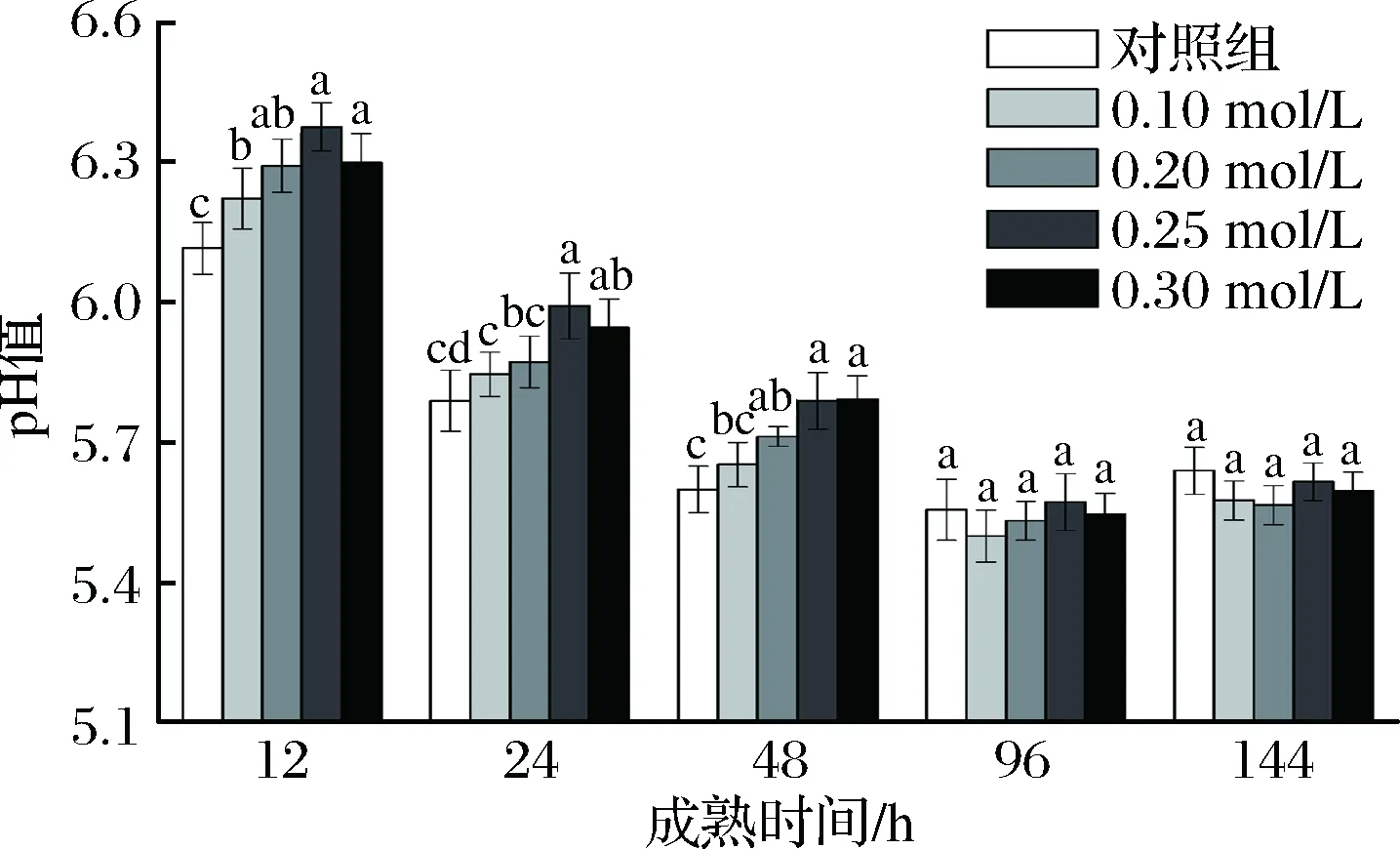
图1 不同浓度CsA处理对肌肉pH值的影响
Fig.1 Effect of different concentrations of CsA treatment on pH value of muscle
注:图中不同字母表示同一时间点不同处理浓度的差异显著(p<0.05),下同。
2.2 不同浓度CsA处理对肌肉色度的影响
肉色是消费者评定肌肉外观的重要指标,其与肌红蛋白含量、肌纤维类型和状态及水分分布有很大关系[13]。由图2可知,随着宰后成熟时间的延长,对照组及处理组L*值、a*值、b*值均呈先上升后下降的变化趋势。对照组L*值、b*值均在96 h达到最大值,随后L*值显著下降(p<0.05);对照组a*值在宰后24 h达到最大值19.77,随后呈下降趋势,但差异不显著(p>0.05)。处理组L*值均在宰后48 h达到最大值,按浓度递增顺序L*值峰值分别为37.01、38.87、39.80、39.37,随后显著下降(p<0.05);12~48 h,处理组的L*值均高于对照组,且0.25 mol/L处理组L*值均高于其他处理组,但各处理组L*值差异不显著(p>0.05)。处理组b*值变化情况与L*值变化情况类似,在宰后48 h达到最大值,随后显著下降(p<0.05);12~48 h内,处理组b*值均高于对照组,且b*值的上升呈溶液浓度依赖变化,但0.25 mol/L处理组b*值均高于其他处理组。处理组a*值在宰后24 h达到最大值,随后显著下降(p<0.05)。12~96 h,对照组a*值均高于各处理组,且随处理浓度的增加a*值呈下降趋势,0.10 mol/L处理组a*值在12~96 h内均高于其他处理组,0.30 mol/L处理组a*值在12~48 h均低于其他处理组a*值,但差异不显著。

图2 不同浓度CsA处理对肌肉L*(A)、a*(B)、b*(C)值的影响
Fig.2 Effects of different concentrations of CsA treatment on L*(A), a*(B), b*(C) value of muscle
2.3 不同浓度CsA处理对肌肉蒸煮损失的影响
由图3可以看出,对照组及处理组蒸煮损失呈先上升后下降的变化趋势。12~96 h内,对照组蒸煮损失显著上升,并达到最大值为34.21%,随后显著下降(p<0.05);0.10和0.30 mol/L 处理组蒸煮损失在96 h显著上升并达到最大值分别为35.65%、38.31%,随后显著下降(p<0.05),0.25 mol/L和0.25 mol/L处理组蒸煮损失在48 h达到最大值分别为36.34%、38.87%,随后显著下降(p<0.05)。在12~144 h,处理组蒸煮损失均显著高于对照组,除0.30 mol/L处理组外,12~48 h,0.25 mol/L处理组蒸煮损失均高于其他处理组,且各处理组之间蒸煮损失无显著差异(p>0.05)。

图3 不同浓度CsA处理对肌肉蒸煮损失的影响
Fig.3 Effects of different concentrations of CsA treatment on the cooking loss of muscle
2.4 不同浓度CsA处理对肌肉嫩度的影响
剪切力是肉嫩度最直接的反映,肌肉越嫩其剪切力越低。MFI代表肌原纤维蛋白被降解及肌原纤维结构破坏的程度,能够反映出肌肉成熟进行的程度[14]。由表1可以看出,随着宰后成熟时间的延长,对照组及处理组剪切力均呈先上升后下降的变化。对照组剪切力在96 h达到最大值8.39 kgf,随后显著下降(p<0.05);各处理组剪切力在宰后96 h也均达到最大值,按浓度递增顺序,依次为8.66、9.19、9.90和10.00 kgf,随后显著下降(p<0.05)。12~144 h,0.3 mol/L处理组剪切力均高于其他处理组,0.10 mol/L处理组剪切力在各时间点均显著低于其他处理组(p<0.05),且随CsA处理浓度增加剪切力增大。

表1 不同浓度CsA处理对肌肉剪切力和MFI的影响Table 1 Effects of different concentrations of CsA treatment on the shear force and MFI of muscle
注:同列不同字母表示差异显著(p<0.05),下同。
说明剪切力的变化呈CsA处理浓度依赖变化。由表1可知,在整个成熟过程中,对照组及处理组MFI均呈显著上升趋势(p<0.05)。宰后144 h,对照组MFI显著上升到最大值72.30(p<0.05);处理组MFI均达到最大值,按浓度递增的顺序分别为65.07、63.00、62.13、60.32(p<0.05),说明MFI的变化呈浓度依赖变化。12~144 h,处理组MFI均低于对照组MFI,且随CsA处理浓度增加MFI呈下降趋势,12~96 h,0.30 mol/L处理组MFI均低于其他处理组,0.10 mol/L处理组MFI均高于其他处理组。
2.5 不同浓度CsA处理对肌肉胞浆Cyt-c含量的影响
Cyt-c是细胞凋亡途径中的凋亡诱导因子,在细胞发生凋亡过程中起重要作用[15]。由表2可以看出,随着成熟时间的延长,对照组胞浆Cyt-c含量呈先显著下降后显著上升的趋势(p<0.05),CsA处理组胞浆Cyt-c含量呈逐渐增加的趋势(p<0.05)。宰后12~24 h,对照组胞浆Cyt-c含量显著下降并达到最小值0.48 mmol/L,随后显著上升(p<0.05);宰后12~144 h,处理组胞浆Cyt-c含量均达到最大值,按浓度递增的顺序胞浆Cyt-c含量分别为0.58、0.56、0.55、0.51 mmol/L。宰后12~144 h,除24 h外,处理组胞浆Cyt-c含量均低于对照组,且随CsA处理浓度增加而降低;48~144 h,0.30 mol/L处理组胞浆Cyt-c含量均低于其他处理组,且0.10 mol/L处理组Cyt-c含量变化与之相反;除0.10 mol/L处理组外,各处理组胞浆Cyt-c含量在成熟期间无显著差异(p>0.05)。

表2 不同浓度CsA处理对肌肉胞浆Cyt-c含量的影响Table 2 Effects of different concentrations of CsA treatment on cytoplasm Cyt-c content in muscle
2.6 不同浓度CsA处理对肌肉Caspase活力的影响
在细胞凋亡的线粒体途径中,Caspase-9作为凋亡的启动因子,它可召集并激活凋亡效应酶Caspase-3[5]。由图4-A可以看出,随着成熟时间的延长,对照组Caspase-9活性呈显著下降的趋势,CsA处理组Caspase-9活性均呈先显著上升后显著下降的趋势(p<0.05)。0.10和0.20 mol/L处理组Caspase-9活性在24 h显著上升并达到最大值分别为1.414、1.302,0.25和0.30 mol/L处理组Caspase-9活性在48 h达到最大值分别为1.239、1.220,随后显著下降(p<0.05)。12~24 h,处理组Caspase-9活性均低于对照组,且随CsA处理浓度增加而降低,在48 h,处理组Caspase-9活性显著高于对照组(p<0.05);48~144 h,0.20 mol/L处理组Caspase-9活性降低速率均高于其他处理组,处理组Caspase-9活性降低速率随CsA处理浓度增加而降低。在整个成熟过程中,对照组及处理组Caspase-3活性均呈先显著上升后显著下降的趋势(p<0.05)(图4-B)。宰后12~24 h,对照组Caspase-3活性显著上升并达到最大值3.051,随后显著下降(p<0.05);宰后12~48 h,处理组Caspase-3活性均达到最大值,按浓度递增的顺序Caspase-3活性分别为2.815、2.637、2.530、2.628,随后显著下降(p<0.05)。12~24 h,处理组Caspase-3活性均低于对照组,且随CsA处理浓度增加而降低,在48 h,处理组Caspase-3活性显著高于对照组;48~96 h,0.10 mol/L处理组Caspase-3活性降低速率均高于其他处理组,处理组Caspase-3活性降低速率随CsA处理浓度增加而降低,12~48 h,0.30 mol/L处理组Caspase-3活性均低于其他处理组,且0.10 mol/L处理组Caspase-3活性变化与之相反;12~144 h,0.25及0.30 mol/L处理组Caspase-3活性无显著差异。

图4 不同浓度CsA处理对肌肉Caspase-9(A)和 Caspase-3(B)活力的影响
Fig.4 Effects of different concentrations of CsA treatment on Caspase-9 (A) and Caspase-3 (B) activity in muscle
3 讨论
在成熟过程中,肌肉pH值呈先下降后缓慢上升的变化,原因可能是宰后缺血、缺氧环境,导致肌糖原无氧酵解产生乳酸及ATP分解产生磷酸根离子而使肌肉内酸性环境变化[16]。肌肉成熟过程中,因pH值、活性氧等变化导致线粒体Ca2+超载等的作用可引起线粒体外膜通透性增大,进一步使线粒体Cyt-c释放至胞浆[17-18];注射不同浓度的CsA溶液使宰后肌肉MPTP关闭,维持了渗透压及H+浓度的变化,限制了Cyt-c的释放,并在一定程度上维持了有氧呼吸链完整,使得pH值下降缓慢,且浓度越高pH值下降越缓慢,但是当处理浓度达到0.30 mol/L时,pH值下降加快,这可能与CsA浓度增高促进非依赖性apoptosis途径有关。
在宰后成熟过程中,对照组L*值、a*值和b*值均呈先上升后下降的变化趋势。L*值增大可能是由于肌肉内部水分渗出,堆积于肌肉的表面,增加了肌肉对光的反射能力[19];脱氧肌红蛋白暴露在空气中迅速氧合,进而氧合肌红蛋白的比例逐渐升高,肉色变得亮红而导致a*值、b*值上升[20];随着贮藏时间延长,氧合肌红蛋白自动氧化,产生灰褐色的高铁肌红蛋白使肉色变暗导致L*值、a*值及b*值均呈下降趋势,这与田甲春等[21]研究的宰后牛肉成熟过程中色泽变化情况类似。注射不同浓度的CsA溶液使宰后牛肉表面水分渗出严重、色素流失增加,导致牛肉变暗变黄,且浓度越高此现象越明显。注射CsA溶液使肌肉的L*值高于对照组,a*值较对照组低、b*值较对照组高,这是注射CsA溶液后,肉样中氧气含量变化以及蛋白变性使得a*值降低、b*值增加。这与贾青[8]研究的向宰后牦牛肉中注射Caspase-3专一抑制剂DEVE后L*值和b*值升高、a*值降低结果一致。
宰后牛肉的蒸煮损失呈先上升后下降的趋势。注射不同浓度CsA溶液使pH值下降减缓,极限值升高,同时部分蛋白质变性,外源溶液注入而使蒸煮损失增加,且浓度越高蒸煮损失越严重。OFFER等[22]研究发现在宰后成熟过程中,乳酸积累导致肉中的pH值下降并达到等电点时,能被蛋白质吸附和保持的水分减少,肌原纤维内部结构的排斥力减少,肌原纤维内部空间减小,导致水分流失严重,这与本研究对照组的研究结果相一致。
宰后牛肉成熟过程中剪切力呈先上升后下降的趋势,这是宰后成熟过程中会发生尸僵导致肌肉收缩和内源酶作用解僵共同作用的结果[23]。MFI是肌原纤维降解情况的直接反映,随着成熟时间的延长,蛋白质不断降解产生小片段使得MFI不断增加[24]。本研究中对照组剪切力和MFI变化情况与王莉[25]、TAN等[14]研究结果相类似。注射不同浓度CsA溶液后,剪切力高于对照组,MFI低于对照组,可能是由于CsA使蛋白降解速度变慢、解僵时间增加以及部分蛋白发生变性,故剪切力较高、MFI较低;随着成熟时间增加,在内源酶的作用下,使成熟后期剪切力下降、MFI继续上升。
宰后牛肉成熟过程中,胞浆中Cyt-c含量呈先下降后上升变化趋势、Caspase-9活性呈逐渐下降的趋势、Caspase-3活性呈先上升后下降变化趋势。这是由于宰后早期肌肉缺氧使得线粒体通透性增加,Cyt-c释放到胞浆使得胞浆Cyt-c含量增加,然后胞浆中Cyt-c与Apaf-1、Caspase-9前体、ATP/dATP结合成凋亡小体复合物,活化Caspase-9,进而活化Caspase-3[26-28];由于本实验测定时间起始点是牛肉宰后12 h,肌纤维缺氧,胞浆Cyt-c含量较高,Caspase-9被活化而活性较高,而Caspase-3被Caspase-9激活时间短活性较低,随着成熟时间延长,线粒体结构遭到破坏、膜通透性进一步增加,CsA抑制作用也减弱,ATP大量消耗,胞浆中Cyt-c含量大量增加,Caspase-9,Caspase-3活性均降低[29];对照组与曹锦轩[30]、王琳琳等[31]研究结果类似,同时也能反映出Caspase-9,Caspase-3被激活的先后顺序。本研究中注射不同浓度CsA溶液后,胞浆中Cyt-c含量逐渐增加,但含量低于对照组,Caspase-9、Caspase-3活性先上升后下降,这是由于CsA致使肌肉线粒体MPTP开放程度不同,限制了Cyt-c释放入胞浆,同时胞浆中Cyt-c与Apaf-1结合成复合物的时间和数量不同,Caspase-9、3活化程度不同,使得Caspase-9、3活性升高缓慢并低于对照组,apoptosis发生进程不同,进而对肌肉品质的影响存在一定差异。
4 结论
宰后成熟过程中,肌肉pH值随CsA溶液浓度增加而升高;随CsA溶液处理浓度增加,L*值、a*值及b*值均呈先升高后降低的趋势,L*值和b*值的升高及a*值的降低均呈浓度依赖变化;处理组蒸煮损失均高于对照组,各组肉样蒸煮损失均在96 h达到最大值。
宰后成熟过程中,处理组剪切力高于对照组,MFI及低于对照组,且上述指标的变化均随CsA处理浓度的增加呈递增或递减的趋势变化。
在成熟初期,处理组在12~48 h胞浆Cyt-c含量均低于对照组,且随CsA处理浓度增加胞浆Cyt-c含量下降,处理组在12~24 h Caspase-9、3活性均低于对照组,且随CsA处理浓度增加Caspase-9、3活性呈下降趋势;CsA处理能够影响宰后肌肉的品质变化,且各品质指标的变化均呈浓度依赖趋势变化,同时CsA能够抑制宰后肌肉apoptosis的发生进程。

