血清瘦素与妊娠期糖尿病的相关性研究
林 戎,沈 忱,兰天舒,黄昭穗
0 引 言
妊娠期糖尿病(gestational diabetes mellitus,GDM)是指妊娠期间发生或首次发现的不同严重程度的糖耐量改变,不包括妊娠前已存在的糖尿病。近年来GDM发病率有逐年上升的趋势,其病因和发病机制目前尚不完全明确[1]。目前多考虑与糖代谢紊乱及胰岛素抵抗相关。瘦素、脂联素和抵抗素是具有多种生物活性的脂肪细胞因子,参与机体的物质代谢和能量消耗调节。作为瘦素结合蛋白的可溶性瘦素受体(soluble leptin receptor,sLR)能够延长瘦素循环半衰期[2],减低其清除率[3],同时还可调节瘦素生物活性[4],且进一步调节瘦素的敏感性[5],进而发挥其影响瘦素调节糖脂代谢和维持能量消耗的生物功能[6]。研究显示瘦素及sLR可防止高胰岛素血症和脂肪细胞过度增生[7],目前已成为肥胖、糖尿病、心血管疾病等多种与能量代谢紊乱相关性疾病中的研究热点。目前关于GDM患者体内瘦素及sLR的表达水平及与GDM之间相关性的研究较少。本研究旨在了解妊娠期糖尿病患者孕期血多种脂肪细胞因子表达的变化,研究其与GDM发病的关系,并初步探讨了瘦素与糖尿病胎儿宫内生长发育的关系。
1 资料与方法
1.1研究对象纳入2014年1-12月在厦门大学附属成功医院产科门诊确定早孕、常规产检并分娩的初产妇共673例,年龄(28.0±7.2)岁。纳入标准:单胎;一级亲属无糖尿病病史;无多囊卵巢综合征、糖尿病、慢性高血压等慢性疾病史;无异常妊娠史;无其他妊娠并发症及妊娠合并症。排除标准:妊娠过程中发展成GDM以外的妊娠并发症;转院或流产。
1.2方法
1.2.1分组根据口服葡萄糖耐量试验标准,参照国内普遍采用的孕24~28周行75 g葡萄糖筛查试验,测定空腹、1 h、2 h静脉血糖值。诊断临界值:空腹、1 h、2 h静脉血糖值分别为5.1、10、8.5 mmol/L,其中1项大于或等于临界值诊断为GDM。根据试验结果,采用随机抽样的方法随机选取50例血糖控制良好的GDM患者纳入妊娠糖尿病组,根据一般资料(年龄、妊娠天数、孕前体重指数等)进行匹配选取50例糖耐量试验结果阴性者纳入正常妊娠组。另根据一般资料进行匹配选取50例同期门诊未孕女性糖尿病患者为未孕糖尿病组。本研究经医院伦理委员会批准(批准号:20131101),所有患者均知情并签署知情同意书。
1.2.2样本采集所有研究对象均在孕期(24~28周)进行相关项目检测。所有检查均过夜禁食8~10 h,次日晨采集肘前静脉血3 mL,立即注入洁净试管,待自然凝固后,常温离心10 min,转速3 000 r/min,置-80 ℃冰箱保存待测。采用酶联免疫吸附测定法测定瘦素、sLR、脂联素、抵抗素水平,按说明书操作。用全自动生化分析仪测定空腹血糖(FPG)、空腹胰岛素(Fins)、糖化血红蛋白(HbA1c)。计算稳态模型评估-胰岛素抵抗指数(HOMA-IR),公式如下:
HOMA-IR=空腹血糖×Fins /22.5
1.2.3新生儿临床资料测量所有新生儿出生后擦干胎脂、羊水,剪断脐带擦净血渍后用电子称测量体重(精确到0.1 kg),然后用皮尺测身长、头围(精确到0.1 cm),判断新生儿的营养状况。
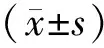
2 结 果
2.1妊娠糖尿病组与正常妊娠组新生儿临床资料比较妊娠糖尿病组新生儿出生体重明显高于正常妊娠组(P<0.05),其余各项2组比较差异无统计学意义(P>0.05)。见表1。
表1妊娠糖尿病组与正常妊娠组新生儿临床资料比较

组别n性别(男/女)胎龄(周)头围(cm)体重(kg)身长(cm)妊娠糖尿病组5026/2438.86±1.3734.65±1.043.89±0 39∗51.03±0 96正常妊娠组5027/2339.12±0 7534.23±1.133.39±0 4250 70±1.24与正常妊娠组相比,∗P<0 05
2.2血清瘦素、sLR、脂联素、抵抗素含量及生化指标比较与正常妊娠组比较,妊娠糖尿病组及未孕糖尿病组患者血瘦素及抵抗素水平、FPG、Fins、HOMA-IR明显升高(P<0.01),sLR、脂联素水平明显降低(P<0.01)。与未孕糖尿病组比较,妊娠糖尿病组患者血清瘦素及抵抗素水平、FPG、HbA1c明显升高(P<0.05),sLR及脂联素水平明显降低(P<0.05)。见表2。


指标妊娠糖尿病组(n=50)未孕糖尿病组(n=50)正常妊娠组(n=50)瘦素(ng/mL)23.58±2.20∗#18.42±1.87∗14.80±2.00sLR(ng/mL)4.64±2.00∗#6.13±3.41∗8.67±14.00脂联素(mg/L)6.53±1.38∗#10 21±2.33∗12.89±1.80抵抗素(ng/mL)14.42±2.00∗#11.37±1.69∗10 25±1.53FPG(mmol/L)6.15±0 63∗#7.42±1.87∗4.22±1.34Fins(mIU/L)10 32±5.71∗12.13±3.41∗7.51±4.85HOMA⁃IR2.47±1.35∗3.27±2.56∗1.65±1.42HbA1C5.84±1.58#6.36±2.41∗5.17±1.73与正常妊娠组相比,∗P<0 01;与未孕糖尿病组相比,#P<0 05
2.3妊娠期糖尿病患者血清瘦素与sLR、脂联素、抵抗素及新生儿体重的相关性分析妊娠糖尿病组血瘦素含量与sLR、脂联素均呈负相关(r=-0.160,-1.130,均P=0.000),与抵抗素呈正相关(r=0.269,P=0.019),与新生儿出生体重无显著相关性(r=-0.485,P=0.216)。
3 讨 论
正常生理状态下,胰岛素与瘦素间存在双向调节作用,即胰岛素可通过促进脂肪积累,刺激其产生瘦素,而瘦素又通过激活胰岛β细胞上ATP依赖性钾离子通道(K-Atp)使胰岛β细胞超级化,抑制胰岛素分泌,即“脂肪-胰岛素内分泌轴”概念[8-9]。正常妊娠女性存在生理性的胰岛素抵抗,随着孕周的增加,胰岛素抵抗加重。本研究结果表明,妊娠糖尿病组患者的FPG、Fins及HOMA-IR显著高于正常妊娠组妇女(P<0.01),存在明显的糖代谢紊乱,胰岛β细胞功能受损,从而导致了更为严重胰岛素抵抗。另外,除胰岛素抵抗外,体外研究还发现,瘦素通过堆积活性氧促进氧化应激反应,诱导胰岛β细胞损伤,与GDM发病相关[10-12]。另外,妊娠糖尿病组患者血清瘦素水平显著高于正常孕妇,sLR水平显著低于正常孕妇,差异有统计学意义,且两者存在负相关(P<0.01)。同时,与单纯未孕糖尿病组相比,妊娠期糖尿病患者的上述因子异常更明显,可见妊娠期糖尿病患者体内存在明显的瘦素系统异常。考虑在妊娠期糖尿病的病理状态下,“脂肪-胰岛素内分泌轴”失调,高胰岛素血症进一步刺激瘦素分泌增加,导致高瘦素血症。而高瘦素血症由于到达下丘脑中枢与外周组织的瘦素无法最大限度地发挥生物学活性, 呈现出这种内源性瘦素抵抗倾向,可能是诱发胰岛素抵抗的重要因素, 并与胰岛素抵抗共同成为许多代谢性疾病的发病基础[13]。而sLR缺乏,瘦素结合率减低,运输、转运至靶器官的瘦素减少,导致病理水平瘦素并未发挥其增加能量消耗和控制体质量的作用[14],形成相对性瘦素抵抗;同时,sLR与瘦素间存在反馈调节机制,血清sLR减少可反馈性地使瘦素合成增加,进一步加重GDM患者的高瘦素血症[15],胰岛素与瘦素、瘦素受体间调节失衡,共同参与GDM的进程。
目前,母体血清瘦素水平与胎儿生长发育关系尚不完全明确。本研究结果显示妊娠糖尿病组患者血清瘦素水平与新生儿体重无明显相关性,考虑其可能由于胎盘的屏障作用,胎盘-胎儿是独立于母体的能量代谢单位,胎儿的生长发育不受母体瘦素的直接调控,故母体血清瘦素水平不能反映胎儿生长发育状况[16]。
本研究中GDM患者的脂肪细胞因子水平与正常妊娠组有显著差异,提示GDM 患者存在脂肪因子分泌失衡,即瘦素及抵抗素等损伤性因子分泌增加,而脂联素等保护性因子分泌减少。脂联素是脂肪特异性分泌的一种蛋白质,刺激脂肪酸氧化,能通过增加胰岛素敏感性来加速糖代谢,是调节胰岛素和糖代谢的关键因子[17]。最新研究证实,孕期低水平的脂联素是胰岛素敏感性降低的标志[18]。本研究结果表明,GDM孕妇的血清脂联素浓度明显低于正常孕妇,推测脂联素可能是妊娠期糖尿病糖尿病母儿生长发育过程中的一个保护因子。抵抗素可作用于脂肪、肝、骨骼肌等胰岛素靶器官,通过影响胰岛素信号转导途径及代谢相关酶的转录,进而影响糖、脂代谢,参与调节能量消耗及脂肪分布[19]。在妊娠期,抵抗素主要是由胎盘组织分泌并表达,参与胰岛素抵抗的发生,是导致GDM 发生重要的细胞因子[20]。本研究发现,妊娠糖尿病组抵抗素明显高于正常妊娠组,支持了抵抗素是胰岛素抵抗的因素的观点[21]。目前考虑这些脂源性细胞因子主要是通过削弱胰岛素及其受体作用或上调胰岛素敏感性的负调节因子如肿瘤坏死因子、游离脂肪酸等引起胰岛素抵抗。
另外,影响因素相关分析的结果还提示血清脂联素水平与瘦素负相关、抵抗素瘦素水平与瘦素正相关, 提示GDM患者脂肪细胞因子之间通过糖脂代谢互相制约互相作用,共同推进GDM的发生和发展。但脂肪细胞因子之间是直接还是间接关系及其具体机制目前尚未明确,有待今后进一步研究。
综上所述,研究发现妊娠期糖尿病患者血清脂肪细胞因子及受体表达发现改变,且之间可能存在一定关联,共同参与GDM的进程。sLR调节瘦素生物活性,低浓度的sLR则可能导致GDM的发生。目前,本研究结果提示妊娠期糖尿病患者瘦素水平与胎儿体重无明显相关性,而胎儿体重是否与胎盘及脐血瘦素水平相关,将在下一步研究中涉及。且因受到样本对象来源与数量的限制,缺乏对干预过程中脂肪细胞因子、血糖代谢指标的动态观察,有待于今后扩大样本及指标展开研究。
[参考文献]
[1] Galtier F. Definition,epidemiology,risk factors[J]. Diabetes Metab,2010,36(6 Pt 2): 628-651.
[2] 甘 蕾,李 真,吴晓华,等. 孕激素对人绒毛滋养层细胞表达ADAM10、Ob-R及分泌sLR、LEP的影响[J]. 局解手术学杂志,2015,24(3):249-252.
[3] 李 真,辛 静,吴晓华,等. C57BL/Ksj db/+小鼠作为妊娠期糖尿病模型的可行性[J]. 中华围产医学杂志,2014,17(4): 267-271.
[4] 王亚男,李 真,吴晓华,等. 血清可溶性瘦素受体与妊娠期糖尿病相关性研究[J]. 解放军医学杂志,2014,39(2):125-128.
[5] López-Tinoco C,Roca M,García-Valero A,etal. Oxidative stress and antioxidant status in patients with late-onset gestational diabetes mellitus[J]. Acta Diabetol,2013,50(2): 201-208.
[6] 匡德凤,华绍芳,韩玉环. 妊娠期糖尿病患者内脏脂肪素表达的变化及其意义[J]. 实用妇产科杂志,2013,29(5):362-365.
[7] Zuo H,Shi Z,Yuan B,etal. Association between serum leptin concentrations and insulin resistance; a population-based study from China[J]. PLoS One,2013,8(1):e54615. doi: 10.1371/journal.pone.0054615.
[8] Ategbo JM,Grissa O,Yessoufou A,etal. Modulation of adipokines and cytokines in gestational diabetes and macrosomia[J]. J Clin Endocrinol Metab,2006,91(10):4137-4143.
[9] 李素芬,孙 蓉,杨 鹰. 瘦素与妊娠期糖尿病[J]. 西部医学,2012,24(10):2028-2029.
[10] Teppa RJ, Ness RB, Crombleholme WR,etal.Free leptin is increased in normal pregnancy and further increased in preeclampsia[J].Metabolism,2000,49(8):1043-1048.
[11] 李静芳,付艳芹,张苏河. 瘦素、脂代谢紊乱与妊娠期糖尿病的关系[J]. 实用医学杂志,2016,32(19):3130-3132.
[12] 商 敏. 妊娠期糖尿病患者脂肪细胞因子和氧化应激的相互作用[J]. 临床和实验医学杂志,2017,16(10):981-983.
[13] 黄 艳,赵亚萍,王加林. 肥胖相关胰岛素抵抗分子机制的研究进展[J]. 东南国防医药,2010,12(6):526-529.
[14] 陆水英, 陈 衡. 瘦素和网膜素在妇产科领域研究进展[J]. 中华实用诊断与治疗杂志,2014,28(3): 215-217.
[15] 张 美,加秋萍. 妊娠糖尿病患者血清细胞因子水平与胰岛素抵抗的关系[J]. 检验医学与临床,2015,12(19):2847-2849.
[16] Lappas M,Yee K,Permezel M,etal. Release and regulation of leptin,resistin and adiponectin from human placenta,fetal membranes,and maternal adipose tissue and skeletal muscle from normal and gestational diabetes mellitus-complicated pregnancies.[J]. J Endocrinol,2005,186(3):457-465.
[17] 管 群. 妊娠期糖尿病早期预测因子的研究进展[J].医学研究生学报,2008,21(7):766-770.
[18] Hedderson MM, Darbinian J, Havel PJ,etal. Low pre-pregnancy adiponectin concentrations are associated with a marked increase in risk for development of gestational diabetes mellitus[J]. Diabetes Care,2013,36(12):3930-3937.
[19] Hanley A,Williams K,Stern MP,etal. Homeostasis model assessment of insulin resistance in relation to the incidence of cardiovascular disease[J]. Diabetes Carre,2002,25(7):1177-1184.
[20] Vrachnis N, Belitsos P, Sifakis S,etal. Role of adipokines and other inflammatory mediators in gestational diabetes mellitus and previous gestational diabetes mellitus[J]. Int J Endocrinol,2012. doi: 10.1155/2012/549748.
[21] 吴 英,沈 琼,蒋 联,等. 妊娠糖尿病患者胰岛素抵抗及胰岛β细胞功能的初步研究[J]. 中华内分泌代谢杂志,2013,29(11): 945-948.

