富血小板纤维蛋白结合引导骨组织再生在拔牙位点保存术中的应用
李 凯,马 锴,王金龄
0 引 言
种植牙可改善患者牙齿美观度和咀嚼功能,已被广泛应用于拔牙后口腔修复,但许多患者在拔牙后往往存在骨吸收现象,可能会加大种植手术难度并增加手术失败风险[1-3]。引导骨组织再生(guided bone regeneration,GBR)位点保存术通过屏障膜给骨组织愈合提供相对封闭空间,防止上皮细胞以及结缔组织进入骨缺损区,促进骨量增加[4]。海奥胶原膜是来源于哺乳动物经脱细胞处理后得到的真皮基质,具有引导上皮增殖分化,修复口腔粘膜作用,但存在创面易肿胀裂开,降解速度难以控制等问题。富血小板纤维蛋白(platelet-rich fibrin,PRF)是第2代血小板浓缩制品,材料来自于自身组织,无任何人工制剂添加,可避免疫反应发生,安全性高[5]。本研究以海奥胶原膜为对照组,探讨PRF应用于GBR位点保存术后,对牙龈组织愈合、骨量保存以及新生骨的影响,现报道如下。
1 资料与方法
1.1一般资料选取本院2015年1月至2017年1月期间收治的拔牙后行GBR位点保存术患者60例为研究对象,根据就诊顺序依次编号,采用随机数字表法将患者分为观察组(n=30)和对照组(n=30)。观察组中,男16例,女14例,年龄22~59岁,平均(46.28±4.76)岁,需拔除患牙:前磨牙3例,磨牙27例,吸烟者10例。对照组中,男17例,女13例,年龄24~58岁,平均(45.03±4.95)岁,需拔除患牙:前磨牙4例,磨牙26例,吸烟者9例。2组一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准(批准号:2014第13号001),患者和家属自愿签订知情同意书。纳入标准:①上颚前牙或前磨牙被诊断患有牙周病、牙髓病或牙折,无法保留患牙;②经术前影像学检查,存在牙槽窝侧壁;③邻牙松动度在I度以下,且无炎症;④无严重全身系统疾病,吸烟者能在术后3个月坚持禁烟。排除标准:①使用对软硬组织愈合造成影响的药物;②伴有血小板减少症、自身免疫疾病或再生障碍性贫血者;③术前3个月有抗凝药物使用史;④每天吸烟量超过10支者。
1.2方法拔牙术前1周进行洁治,术前2组均进行口腔及周围皮肤常规消毒、铺巾,术区采用2%盐酸利多卡因注射液(中国大冢制药有限公司,国药准字H20065387;批号:20141120)局部麻醉,使用牙周韧带刀将牙周膜离断,挤压牙槽骨,然后将压根轻柔拔除,注意避免牙槽窝扩大,尽量使颊侧牙槽骨保持完整。多根牙则先采用反角机头分根,然后依次拔除。分别采用高频电刀和超声骨刀将牙槽窝内肉芽组织和牙槽窝骨面玷污层去除,然后使用甲硝唑液冲洗将拔牙窝冲洗干净,并植入Bio-Oss骨替代材料,使其充满拔牙窝,与牙槽嵴边缘平齐。观察组以PRF膜覆盖在其表面,对照组以海奥胶原膜覆盖在其表面,最后将创口缝合并固定。术后24 h内间断冰敷,连续3 d口服抗生素,连续1周含漱氯己定含漱液(吉林省力胜制药有限公司,国药准字H20003445,批号:20140826),1周后拆线。于位点保存术后6个月,行种植体植入术时,采用牙龈环形刀将预期种植体置入处的牙龈切下,然后再采用环形取骨钻通过提拉方式取出长度5 cm、直径3 cm的圆柱形骨组织标本。将牙龈组织和骨组织迅速放入10%福尔马林液体中固定,石蜡包埋并切片。然后常规脱蜡,苏木精染色15 min,漂洗后采用1%盐酸处理30 s,再次漂洗,伊红染色60 s后漂洗,采用不同梯度乙醇脱水,吹干后采用二甲苯浸泡3~5 min,最后采用中性树胶封固显微镜下观察结果。
1.3观察指标愈合时间:患者术后每日复诊,记录创面愈合所需时间。软组织愈合标准为伤口无红肿、渗出,创面被生长的肉芽组织所覆盖。愈合率:采用3shape TRIOS扫描仪于位点保存术缝合前、术后1周和2周记录术区牙龈软组织缺损情况,并通过透明胶片制作出软组织缺损形状,软组织缺损面积大小以透明胶片质量反应,愈合率=(缝合前创面面积-复查时创面面积)/缝合前创面面积。骨量保存效果:于拔牙前及术后3个月,取患者口腔石膏模型,采用CT和X线检查,记录2组患者牙槽骨高度和宽度。对2组病例标本进行观察,分析并比较2组牙龈组织及骨新生情况。
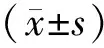
2 结 果
2.1创面愈合时间及愈合率比较观察组创面愈合时间显著短于对照组(P<0.05),术后1周、2周创面愈合率显著高于对照组(P<0.05),见表1。

组别n愈合时间(d)愈合率(%)1周2周对照组3017.41±4.3644.52±7.1378.35±3.04观察组3011.87±3.85∗68.21±7.57∗96.17±3.38∗与对照组比较,∗P<0.05
2.2骨量保存效果比较拔牙前,2组患者牙槽骨宽度、高度比较,差异无统计学意义(P>0.05),术后3个月,观察组牙槽骨宽度显著宽于对照组,牙槽骨高度显著高于对照组(P<0.05),见表2。


组别n牙槽骨宽度牙槽骨高度对照组30 拔牙前7.24±0.6815.27±2.11 术后3个月6.32±0.49∗14.12±0.37∗ 变化值0.92±0.221.15±0.26观察组30 拔牙前7.21±0.6315.28±2.14 术后3个月6.63±0.55∗#14.47±0.52∗# 变化值0.58±0.12∗0.81±0.17∗与同组拔牙前比较,∗P<0.05;与对照组比较,#P<0.05
2.3新生牙龈及骨组织学分析位点保留术后6个月,2组牙龈完整粘膜上皮结构均已形成。观察组牙龈HE染色可见上皮乳头细长,真皮结缔组织中血管群和成纤维细胞较多,纤维结缔组织紧密排列。对照组牙龈HE染色可见上皮乳头短粗,纤维结缔组织排列较为疏松,且在纤维结缔组织间和基底膜下存在大量炎性细胞。观察组骨组织HE染色可见纤维结缔组织将骨替代材料包绕,骨替代材料被吸收,结缔组织内含有较丰富的成纤维细胞和毛细血管,较多的成骨细胞生长排列在骨小梁表面,且其表面具有破骨细胞,骨小梁间隙均可见纤维结缔组织和骨替代材料。对照组骨组织HE染色可见纤维结缔组织将骨替代材料包绕,结缔组织内含有较丰富的成纤维细胞和毛细血管,成骨细胞在骨小梁表面排列紊乱,且数量较少,骨小梁空骨陷窝率增加,破骨细胞较多,骨材料吸收较慢。见图1。观察组新生骨占(37.32±11.87)%,对照组占(28.48±8.59)%,差异有统计学意义(P<0.05)。
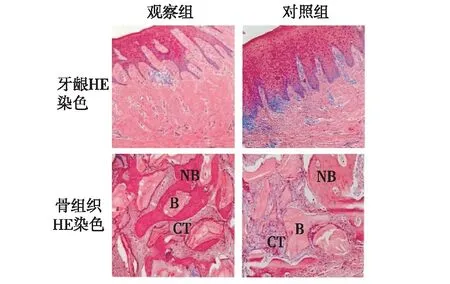
NB:新生骨;B:骨替代材料;CT:纤维结缔组织图1 拔牙位点保存术患者牙龈及骨组织HE染色比较(×100)
3 讨 论
牙槽骨在拔牙后存在一个不可逆的生理性吸收过程,表现为牙槽骨宽度和高度丢失。在临床工作中,许多患者因牙槽骨的吸收导致骨量丧失,影响后期修复治疗效果,甚至导致种植手术失败。GBR位点保存术是结合骨替代材料和屏障膜实现骨再生的技术,被公认为拔牙位点保存的最有效方法之一[6-7]。
牙龈软组织的良好愈合在位点保存术中,可创造一个无菌密闭微环境,利于骨再生以及牙槽嵴形成,在种植术后,可避免细菌入侵以及种植体颈部暴露,利于种植体骨结合以及骨整合过程[8]。所以牙龈软组织的良好愈合是位点保存术后种植修复成功的关键因素。创面愈合时间通过肉眼观察即可得出结果,是评价创面愈合的传统指标。创面愈合率相对于组织病理学分析等方法,操作简单,是创面愈合的直接评价指标。本研究结果显示,观察组创面愈合时间为(11.87±3.85)d,显著短于对照组,观察组在术后1周和2周的创面愈合率分别为(68.21±7.57)%和(96.17±3.38)%,显著高于同一时间点对照组创面愈合率,以上提示PRF可有效促进创面愈合。原因在于纤维蛋白作为血管化天然基质,可促进新生血管形成,且PRF中含有高浓度血小板衍生因子(PDGF)、人成纤维细胞生长因子-B(FGFB)以及血管内皮生长因子(VEGF)等,可进一步促进创面血管化[9-10]。其次,PRF可促进上皮细胞分泌整合素αvβ3,紧密结合纤维蛋白,并在αvβ3作用下定植于纤维蛋白网状结构中进行增殖,引导创面组织覆盖[11]。最后,PRF可在创面炎症处释放趋化因子,促进中性粒细胞、巨噬细胞等向创面聚集,对炎症反应具有积极作用[12]。而胶原膜仅仅通过提供上皮细胞定植以及血管化条件,促进创面愈合,缺少PRF中的细胞因子。
PRF不仅对软组织具有修复作用,在硬组织修复中也起到关键作用。PRF中的多种生长因子可促进成骨细胞增殖分化及迁移、促进骨保护素表达、抑制破骨细胞形成及骨吸收[13]。国外有研究对拔牙后患者分别使用PRF和血凝块,并定期检测骨吸收情况,结果显示,8周之后,PRF组和血凝块组牙槽骨水平吸收量分别为0.70 mm和1.33 mm, PRF明显抑制了牙槽骨吸收[14]。本研究中,2组在术后3个月,牙槽骨宽度和高度较拔牙前均显著降低,但观察组降低幅度显著小于对照组,以上提示PRF有效抑制牙槽骨宽度和高度的丢失,保护牙槽骨残余骨量,与辛策等[15]研究结果一致。
牙龈组织学检查发现,观察组术后6个月牙龈组织排列以及牙龈成分愈合更好,认为这与PRF在牙龈早期愈合中不断释放生长因子以促进胶原形成、成熟以及改建有关。有研究指出PRF能持续28 d释放生长因子,使其在密闭环境下局部浓度明显升高,有助于胶原纤维改建[16]。位点保存术置入骨替代材料结合胶原膜覆盖虽可较好保留骨量,但会使拔牙窝骨愈合延迟,骨替代材料吸收较慢,新生骨较少,与本研究对照组结果一致。而观察组术后6个月新生骨百分比显著高于对照组,认为PRF可促进骨替代材料吸收,缩短引导成骨时间。
综上所述,PRF应用于拔牙后GBR位点保存术,可有效促进牙龈软组织创面恢复,抑制牙槽骨骨吸收,避免骨量进一步减少,并促进新骨形成,为术后种植手术提供良好条件。且PRF通过抽取自身静脉血、离心后处理即可获得,相对于海奥胶原膜而言,易制作且成本低,应用价值高。
[参考文献]
[1] 李一鸣, 尼加提·吐尔逊, 周 晶,等. 骨诱导活性材料复合富血小板纤维蛋白在拔牙位点保存中的作用[J]. 中华实用诊断与治疗杂志, 2015, 29(3):235-237.
[2] 张森林, 毛天球. 富含血小板血浆在骨组织工程中的应用进展[J]. 医学研究生学报, 2006, 19(8):737-740.
[3] 周红文, 刘向辉, 孙卫革. 磨牙残冠残根的保存治疗[J]. 东南国防医药, 2005, 7(5):368-368.
[4] 李 悦, 张燕婷, 何 晶,等. 联合应用骨劈开、骨挤压术、引导骨组织再生技术并同期种植手术方案的短期临床疗效分析[J]. 中国实用口腔科杂志, 2016, 9(9):532-537.
[5] 郭津源, 仲维剑, 柴松岭,等. 牙齿煅烧颗粒结合富血小板纤维蛋白修复骨缺损的实验研究[J]. 口腔医学研究, 2015, 31(11):1069-1072.
[6] 万 永, 赵 峰, 聂国军,等. PRF在牙槽嵴位点保存应用中的CBCT观察[J]. 西南国防医药, 2015, 25(12):1355-1358.
[7] 杨 芳, 雷志敏, 王林虎. 微创拔牙后植入不同材料对牙槽窝保存技术的影响研究[J]. 中国美容医学杂志, 2017, 26(2):102-104.
[8] 董 露. 富血小板纤维蛋白(PRF)诱导牙龈软组织修复再生的临床观察[D]. 四川医科大学, 2015.
[9] 杨世茂, 王明国, 李 静,等. 富血小板纤维蛋白与富血小板血浆体外释放生长因子的比较及其对脂肪干细胞增殖分化的影响[J]. 华西口腔医学杂志, 2012, 30(6):641-644.
[10] 顾杰林. 富血小板纤维蛋白用于口腔种植引导骨再生技术组织愈合效果分析[J]. 中国医疗美容, 2017, 7(1):48-50.
[11] 李淑慧, 戴晓玮, 张文丽,等. 自体骨髓间充质干细胞复合富血小板纤维蛋白促进拔牙窝骨愈合[J]. 中国组织工程研究, 2016, 20(1):3-7.
[12] 徐 庆. 富血小板纤维蛋白促进拔牙创愈合的Cochrane系统评价[D]. 西南医科大学, 2016.
[13] 柳 锋, 雷志敏. PRF联合珊瑚骨粉在前牙美学区拔牙位点保存的临床研究[J]. 西南国防医药, 2016, 26(6):643-646.
[14] Suttapreyasri S, Leepong N. Influence of platelet-rich fibrin on alveolar ridge preservation[J]. J Craniofac Surg, 2013, 24(4):1088-1094.
[15] 辛 策, 胡青芳, 吕 迪,等. PRF用于口腔种植GBR手术组织愈合效果初步研究[J]. 全科口腔医学电子杂志, 2016, 3(4):87-90.
[16] 李 琦. 富血小板纤维蛋白对牙周膜前体细胞成骨分化的影响及机制研究[D]. 吉林大学, 2013.

