云南蝙蝠携带新型汉坦病毒及其基因组分析
邓洪岩 王静林 李利利 信云云 刘蒙蒙 王云 段招军
266021青岛大学基础医学院病原生物系病原生物学专业(邓洪岩、刘蒙蒙、王云);650224 昆明,云南省畜牧兽医科学院/云南省热带亚热带动物病毒重点实验室(王静林);100051 北京,中国疾病预防控制中心病毒病预防控制所(李利利、段招军);410003 长沙,湖南师范大学附属第一医院儿童医学中心(信云云)
由于汉坦病毒(hantavirus, HV)的多样性,2016 年国际病毒学分类委员会(ICTV)规定 HV 属于布尼亚病毒目(bunyavirales)汉坦病毒科(hantaviridae)汉坦病毒属(genus hantavirus),是有包膜分节段的单股负链 RNA 病毒。HV 基因组由大(L)、中(M)、小(S)3个节段组成,每个基因节段都只有一个开放阅读码框(open reading frame, ORF),L 节段编码RNA依赖的 RNA 多聚酶(RdRp),M 节段编码糖蛋白(G1、G2)的前体糖蛋白,S 节段编码核衣壳蛋白[1]。人类感染HV后主要导致两种严重疾病,即肾综合征出血热(hemorrhagic fever with renal syndrome, HFRS)和汉坦病毒肺综合征(hantavirus pulmonary syndrome, HPS)[2]。每年全世界发生的 HFRS 病例中有超过 90% 发生在亚洲,其中多数感染病例分布于中国的29个省份和地区[3-5]。近几年HV的研究进展较快,新型或新亚型病毒不断被发现,在证实的40多个 HV 血清型/基因型中有7个型的 HV 可引起 HFRS,15个型引起 HPS,其余型别的 HV 与人类疾病的关系尚不太清楚[3]。
HV 的天然宿主是啮齿类动物[3-4, 6];但最近发现蝙蝠和食虫目动物也携带多种 HV[7-9]。蝙蝠是多种新发现的高致病性病毒的重要储存库,比如,狂犬病毒、尼帕病毒和SARS样冠状病毒,由于蝙蝠具有长距离飞行的能力和冬眠的特性,使其具有传播病原体范围较广且能够携带多种病毒的特点[10],因此对于蝙蝠体内新型病毒的研究具有重要意义。本研究利用病毒宏基因组学方法在云南普洱地区蝙蝠脾脏发现了HV的存在,同时我们对该病毒进行了筛查、全基因组扩增、相似性和进化分析。
1 材料与方法
1.1标本来源和处理本实验中的标本采集通过了中国疾控中心病毒病预防控制所动物实验伦理委员会的审查(编号:20160715023)。于2016年7~8月份在云南普洱地区随机捕捉 84 只蝙蝠,经低温保存并运送至本实验室,在二级生物安全柜中解剖肝、脾、肺、肠道和肌肉组织,每种组织取黄豆粒大小放入 2 ml 离心管并加入 1 ml DMEM,其中肌肉组织用于鉴定蝙蝠种类,组织研磨后按照本实验室建立的高通量测序前标本处理方法进行样本过滤、混合、消化、提取核酸并扩增后进行高通量测序。
1.2所用试剂核酸提取试剂盒Viral Nucleic Acid Extraction Kit Ⅱ购于 Geneaid 公司;SuperscriptⅢ反转录酶,RNA 酶抑制剂,dNTP mix 购于 Invitrogen 公司;I-5TM2×High-Fidelity Master Mix 购自于北京擎科新业生物技术有限公司;Random Primers 购于 Promega 公司;引物合成及 PCR 产物测序均委托于北京擎科新业生物技术有限公司。
1.3病毒核酸提取及cDNA的合成吸取上述蝙蝠组织研磨液上清 200 μl,按照 Viral Nucleic Acid Extraction Kit Ⅱ 说明书提取病毒核酸,利用 SuperscriptⅢ 进行逆转录合成 cDNA。
1.4病毒基因组的扩增对注释到 HV 的高通量测序读长拼接后设计引物进行 PCR 验证,根据获得的序列设计引物扩增未知序列区域,根据汉坦病毒3‘和 5′端保守区序列设计引物扩增两端序列。扩增产物经过 1.2% 琼脂凝胶电泳鉴定并送北京擎科新业生物技术有限公司测序。
1.5标本筛查和蝙蝠种类鉴定根据扩增的全长基因组设计筛查引物,对收集的 84 只蝙蝠的肺、脾共 168 份标本中的 DodeHV 流行情况进行筛查。蝙蝠种类的鉴定使用引物PCR方法对肌肉线粒体细胞色素 B 基因进行扩增[11]。
1.6非同义突变替换率/同义突变替换率(dN/dS)比率分析dN/dS 比值使用在线软件 DataMokeny[12]与同源性最高的蝙蝠 HV(XSV)3个节段分别进行计算分析。
1.7系统进化和同源性分析下载已知的蝙蝠 HV 及其他啮齿类动物、鼹鼠和人群中发现的相关 HV 的 L、M、S 基因序列和M节段的氨基酸序列,将 DodeHV与上述下载的序列利用 MEGA6.0 软件分别进行多序列比对并采用邻接法(neighbor-joining)建立系统发育树,将 bootstrap 值设定为1,000;用 MegAlign 进行同源性分析。
2 结果
2.1蝙蝠种类本研究中的 84 只蝙蝠经过特异性 PCR 鉴定,结果显示 17 只为中华菊头蝠、67 只为小蹄蝠。
2.2DodeHV的发现与筛查对蝙蝠高通量测序数据进行生物信息学分析,发现在脾脏组织中有27条读长(Reads)注释到 HV,根据拼接后的序列设计引物进行验证和筛查,发现有 4 只小蹄蝠的肺脏和脾脏显示 HV 阳性,阳性率为 5.97%(4/67),将该 HV 命名为 DodeHV。检出 DodeHV 阳性的蝙蝠均为来自云南普洱地区的小蹄蝠(H. pomona andersen)。
2.3DodeHV的基因组本研究获得的DodeHV 3个节段的长度分别为 S 1,702 bp、M 2,994 bp、L 6 521b,序列分析发现:S节段包括完整的 1 284 bp ORF 区以及 57 bp 完整的 5′ 端非编码区和 361 bp 不完整的 3′ 端非编码区,编码 427 个氨基酸的核衣壳蛋白;M 节段是部分核苷酸序列;L 节段获得了完整的序列,ORF 区位于nt40~6477 的位置,5′ 和 3′ 端包含 9 bp 高度保守的的反向互补序列(TAGTAGTAG),可使 5′ 和 3′ 形成稳定的锅柄状结构,这是布尼亚病毒科基因组的典型特征。S、M、L 的基因序列在 GenBank 中的登录号分别为:MG637438、MG637437、MG637436。
2.4DodeHV序列相似性分析序列分析结果显示 DodeHV 3个节段与 2013 年越南富寿省小蹄蝠体内发现的 Xuan son virus(XSV)[13]各基因节段相似度最高,S、M、L节段核苷酸序列和氨基酸序列相似度分别为: 79.0%和 93.4%, 79.2%和 94.8%,79.9%和 96.6%。DodeHV 与2015 年在广西来宾市蝙蝠中发现的 LBV[14]相似度相对较小,和在中国湖北蝙蝠中发现的两种病毒 HUPV 和 LQUV 基因序列相似度更低(表1)。我们同时将本次四份阳性标本的 M 节段核苷酸部分编码区序列进行了同源性分析,发现它们之间没有差别。DodeHV 与 XSV 的 dN/dS 比值分别为 S 0.00420、M 0.00736、L 0.000247。
2.5遗传进化分析S、M、L 3个节段核苷酸序列进化分析发现汉坦病毒均可以分成了 4 个簇(Ⅰ-Ⅳ),而且显示 DodeHV 在进化关系中均与越南富寿省报道的 XSV最接近,这与基因序列相似性分析的结果相一致,提示DodeHV 与 XSV 来自共同的祖先(图1、2、3)。
表 1 DodeHV 与 GenBank 中已有蝙蝠汉坦病毒核苷酸序列和氨基酸序列的相似度(%)比较
Tab.1Nucleotide and amino acid sequence of bat hantaviruses from GenBank and their identity (%) with DodeHV
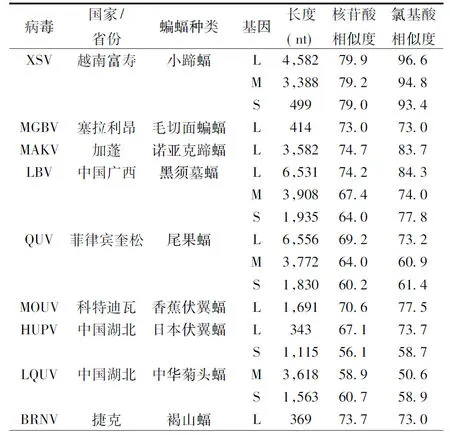
注:病毒名称缩写与 GenBank编号:
Note: Abbreviation and accession No XSV, Xuan son virus-VN1982B4 (JX912953, KU976427, KC688335); MGBV, Magboi virus 1209 (JN037851); MAKV, Makokou virus GB303 (KT316176); LBV, Laibin virus BT20 (KM102249, KM102248, KM102247); QUV, Queaon virus MT1720/1657 (KU950715, KU950714, KU950713); MOUV, Mouyassue virus (JQ287716); HUPV, Huangpi virus Pa-1 (JX465369, JX473273); LQUV, Lonquan virus Ra-25 (JX456397, JX465415); BRNV, Brno virus (KR920360)
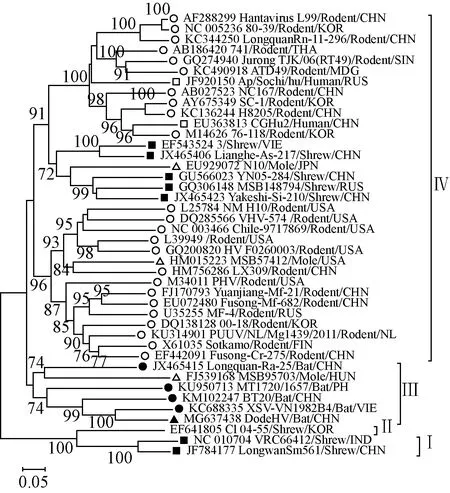
注:▲是本研究中的 DodeHV,●是已报道的蝙蝠体内发现的 HV,■是宿主为啮齿类动物的HV,□是宿主为人类的HV,■是宿主为鼩鼱的HV,△是宿主为鼹鼠的HV图1 DodeHV S 节段部分核苷酸序列(位置 731-1,230)系统进化树Note:▲indicates DodeHV of this study, ●indicates bat-borne HV already found, ■indicates rodent-borne HV, □indicates HV found in human, ■indicates shrew-borne HV, △indicates mole-borne HVFig.1 Phylogenetic tree for partial nucleotide sequence of DodeHV S segment (positions 731-1,230)
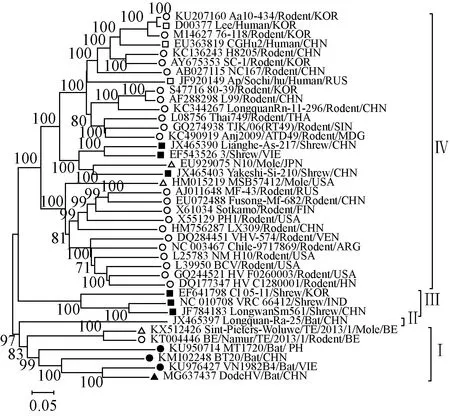
注:▲是本研究中的 DodeHV,●是已报道的蝙蝠体内发现的 HV,■是宿主为啮齿类动物的HV,□是宿主为人类的HV,■是宿主为鼩鼱的HV,△是宿主为鼹鼠的HV图2 DodeHV M 节段部分核苷酸序列(位置 300-2,810)系统进化树Note:▲indicates DodeHV of this study, ●indicates bat-borne HV already found, ■indicates rodent-borne HV, □indicates HV found in human, ■indicates shrew-borne HV, △indicates mole-borne HVFig.2 Phylogenetic tree for partial nucleotide sequence of DodeHV M segment (positions 300-2,810)

注:▲是本研究中的 DodeHV,●是已报道的蝙蝠体内发现的 HV,■是宿主为啮齿类动物的HV,□是宿主为人类的HV,■是宿主为鼩鼱的HV,△是宿主为鼹鼠的HV图3 DodeHV L 节段部分核苷酸序列(位置 2,960-3,274)系统进化树Note:▲indicates DodeHV of this study, ●indicates bat-borne HV already found, ■indicates rodent-borne HV, □indicates HV found in human, ■indicates shrew-borne HV, △indicates mole-borne HVFig.3 Phylogenetic tree for partial nucleotide sequence of DodeHV L segment (positions 2,960-3,274)
3 讨论
自首次在黑线姬鼠被分离以来[15],汉坦病毒相继在不同的宿主体内被分离或发现,如蝙蝠和食虫目动物等[7-9]。蝙蝠具有携带并传播多种人类病毒的优势[10]。至今,蝙蝠携带的HV也不断被报道,近3年时间就发现了4例,包括:中国广西的 LBV[15]、非洲加蓬的 MAKV[16]、菲律宾奎松的 QUV[17]、欧洲捷克的 BRNV。蝙蝠携带HV的研究对人类动物性病毒病的预防和控制具有重要的公共卫生意义。
ICTV 第九次会议认为HV的分型标准之(https://talk.ictvonline.org/ictv-reports/ictv_9th_report):病毒和其他HV N蛋白氨基酸序列和G蛋白氨基酸序列相比至少有 7%的不同。DodeHV与XSV N和G蛋白氨基酸序列相似度分别为93.4%和94.8%。本研究DodeHV M序列不完整,但根据G蛋白534个氨基酸序列进化分析发现与M节段核酸序列进化分析结果一致。DodeHV 与越南 XSV 属于HV同一基因型中不同的病毒株,这在我国境内属于首次报道。
云南是多种病毒的疫源地[18-20],与越南、缅甸等东南亚国家接壤,在地理位置上具有重要的连通作用。本研究标本采集的普洱地区临近边境,对于充分理解边境地区蝙蝠携带病毒的多样性及东南亚国家蝙蝠病毒的系统进化关系具有重要意义。序列和进化分析显示 DodeHV 与越南富寿省发现的 XSV 亲缘关系最近,提示它们可能来源于同一祖先。但是 DodeHV 与广西LBV、湖北龙泉 LQUV 以及湖北黄陂HUPV 进化关系相对较远,且同源性较低,暗示汉坦病毒多样性可能是通过病毒在种群间或个体间不断传播形成的,而本研究云南株与广西和湖北流行株的差异较大可能是由于蝙蝠飞行距离的限制,导致了地理隔离。
dN(dS)表示每一个非同义(同义)位点上的平均非同义(同义)替换率,是描述同义替换和非同义替换的一个参数。DodeHV 与 XSV 的各节段 dN/dS 比率分别为 S 0.00420、M0.00736、L 0.000247,说明这3个节段都存在较多的同义突变,同时可以解释该病毒与已知病毒核酸序列和氨基酸序列相似性差异较大的原因。
据报道 HV 与啮齿类动物会具有共进化的关系,HV 在同一类宿主内传播时,不会发生明显的基因突变,但是当 HV 感染其他种类宿主时,病毒为了适应新宿主的遗传环境,它会伴随宿主而进化[21],本研究发现的DodeHV与同源性最近的越南XSV宿主都是小蹄蝠,而与其他蝙蝠种类所携带的汉坦病毒在进化关系中相差较远,进一步提示了 HV 与宿主蝙蝠可能存在共进化关系,这可能也是 HV 在宿主转换过程中可能产生病毒遗传多样性的原因。
总之,本研究发现的 DodeHV 不仅丰富了我国蝙蝠的病毒库,而且促进了对汉坦病毒进化的理解。加大在全国各地对蝙蝠HV的监测与研究力度,充分掌握我国各地不同基因型HV的分布情况,才可以对新发暴发HV疫情做出及时有效的判断,以最大限度挽救人们的生命财产。世界范围内,不同种类蝙蝠体内不断被发现各种新的病毒也提示我们应该更加深入研究蝙蝠 HV 的传播对人类以及其他动物造成的影响。
利益冲突:无。
参考文献
[1] Mir MA, Panganiban AT. The Hantavirus Nucleocapsid Protein Recognizes Specific Features of the Viral RNA Panhandle and Is Altered in Conformation upon RNA Binding[J]. J Virol, 2005,79(3):1824-1835. DOI:10.1128/JVI.79.3.1824-1835.2005.
[2] Schmaljohn CS, Hasty SE, Dalrymple JM, et al. Antigenic and genetic properties of viruses linked to hemorrhagic fever with renal syndrome[J]. Science, 1985,227(4690):1041.
[3] Jonsson CB, Figueiredo LTM, Vapalahti O. A Global Perspective on Hantavirus Ecology, Epidemiology, and Disease[J]. Clin Microbiol Rev, 2010,23(2):412-441. DOI: 10.1128/CMR.00062-09.
[4] Zhang YZ, Yang Z, Fu ZF, et al. Hantavirus Infections in Humans and Animals, China[J]. Emerg Infect Dis, 2010,16(8):1195. DOI: 10.3201/eid1608.090470.
[5] Kariwa H, Yoshimatsu K, Arikawa J. Hantavirus infection in East Asia[J]. Comp Immunol Microbiol Infect Dis, 2007,
30(5-6):341. DOI: 10.1016/j.cimid.2007.05.011.
[6] Schmaljohn C S, T. N S. Bunyaviridae[M]//Knipe D M H P. Fields Virology, fifth ed. Lippincott, Williams & Wilkins, Philadelphia: Morgan Kaufmann, 2007:1741-1789.
[7] Zhang YZ. Discovery of hantaviruses in bats and insectivores and the evolution of the genus Hantavirus[J]. Virus Res, 2014,187:15. DOI: 10.1016/j.virusres.2013.12.035.
[8] Guo WP, Lin XD, Wang W, et al. Phylogeny and Origins of Hantaviruses Harbored by Bats, Insectivores, and Rodents[J]. Plos Pathog, 2013,9(2):e1003159. DOI: 10.1371/journal.ppat.1003159.
[9] Sabrina W, Witkowski PT, Brita A, et al. Hantavirus in Bat, Sierra Leone[J]. Emerg Infect Dis, 2012,18(1):159-161. DOI: 10.3201/eid1801.111026.
[10] Calisher CH, Childs JE, Field HE, et al. Bats: Important Reservoir Hosts of Emerging Viruses[J]. Clin Microbiol Rev, 2006,19(3):531-545. DOI: 10.1128/CMR.00017-06.
[11] 何彪. 蝙蝠病毒组学及其新病毒的发现与鉴定[D]. 中国人民解放军军事医学科学院, 2014.
[12] Delport W, Poon AFY, Frost SDW, et al. Datamonkey 2010: a suite of phylogenetic analysis tools for evolutionary biology[J]. Bioinformatics, 2010,26(19):2455. DOI: 10.1093/bioinformatics/btq429.
[13] Arai S, Nguyen ST, Boldgiv B, et al. Novel bat-borne hantavirus, Vietnam.[J]. Emerg Infect Dis, 2013,19(7):1159-1161. DOI: 10.3201/eid1907.121549.
[14] Xu L, Wu J, He B, et al. Novel hantavirus identified in black-bearded tomb bats, China[J]. Infect Genet Evol, 2015,31:158-160. DOI: 10.1016/j.meegid.2015.01.018.
[15] Lee HW, Lee PW, Johnson KM. Isolation of the etiologic agent of Korean Hemorrhagic fever.[J]. J Infect Dis, 1978,137(3):298.
[16] Witkowski PT, Drexler JF, Kallies R, et al. Phylogenetic analysis of a newfound bat-borne hantavirus supports a laurasiatherian host association for ancestral mammalian hantaviruses.[J]. Infect Genet Evol, 2016,41:113-119. DOI: 10.1016/j.meegid.2016.03.036.
[17] Arai S, Taniguchi S, Aoki K, et al. Molecular phylogeny of a genetically divergent hantavirus harbored by the Geoffroy′s rousette (Rousettus amplexicaudatus), a frugivorous bat species in the Philippines.[J]. Infect Genet Evol, 2016,45:26-32. DOI: 10.1016/j.meegid.2016. 08.008.
[18] 杜春红, 赵文红, 刘正祥, 等. 2012年云南省德钦县鼠疫疫源地调查实验室检测结果与分析[J]. 疾病监测, 2013,28(11):917-919.
[19] 张玉芬, 杜春红, 苏超, 等. 云南省贡山县鼠疫指示动物血清流行病学调查[J]. 疾病监测, 2015,30(11):922-924.
[20] Wang B, Feng Y, Li Z, et al. Distribution and diversity of hepatitis B virus genotypes in Yunnan, China.[J]. J Med Virol, 2014,86(10):1675. DOI: 10.1002/jmv.24002.
[21] Plyusnin A, Morzunov S P. Virus evolution and genetic diversity of hantaviruses and their rodent hosts.[J]. Curr Top Microbiol Immunol, 2001,256:47-75.

