高表达microRNA-155的骨髓间充质干细胞对免疫调节的影响
谢林岑 陈月秋 沈振亚
间充质干细胞(mesenchymal stem cells,MSC)已广泛应用于心血管疾病和移植物抗宿主病等疾病的治疗[1-3],但由于移植需要细胞数量巨大[4-5]、难以精确控制分化、治疗效果不明显等问题的暴露,MSC的临床应用受到很大的限制。为了拓宽MSC的临床应用,对MSC进行特异性干预就显得尤为重要。有科学家对MSC进行改变基因表达[6]、炎症因子预处理[7]、药物预处理[8]等干预,其中改变MSC基因表达调控MSC免疫功能的研究相对较少。本研究前期发现同种异体心脏移植受体的miR-155表达明显升高,经MSC诱导免疫耐受可降低其miR-155的表达[9]。
miR-155是与免疫密切相关的多功能基因,广泛参与机体炎症反应、免疫排斥等多个生物过程。多个研究表明miR-155在移植物抗宿主病[10]、系统性红斑狼疮[11]、类风湿关节炎[12]等自身免疫性疾病的发生发展中起着重要作用,有望成为新的治疗靶点[13-14]。
树突状细胞(dendritic cells,DC)是机体免疫反应的起始细胞,有不依赖于MHC Ⅱ类分子途径的抗原识别能力,在移植物抗宿主免疫、自身免疫耐受等免疫反应中发挥关键作用[15-17]。有研究表明MSC可以通过抑制DC成熟和迁移发挥免疫调节功能[18-19]。通过诱导DC发挥免疫调节作用,与MSC对T细胞直接作用相比较,或许有更好的临床应用价值。作为免疫调节的效应细胞,T细胞介导细胞毒性与局部炎症相关的免疫应答,在对抗肿瘤的免疫反应中起着非常重要的作用。选择性地调节T细胞水平,通过逆转疾病过程中T细胞的漂移状态,达到治疗某些疾病的目的,具有一定的临床应用价值[20-21]。本实验旨在通过诱导DC途径,探索miR-155基因修饰后的骨髓间充质干细胞(bone marrow-derived mesenchymal stem cells,BMSC)对免疫调节的影响,为BMSC的临床应用提供新的方向和思路。
材料与方法
一、主要材料
SPF 级健康 2 ~ 3 周和 7 ~ 8 周雌性 C57BL/6小鼠,购买于昭衍(苏州)新药研究中心有限公司。Lipofectamine 2000转染试剂盒及Trizol试剂购于美国Sigma公司;Murine GM-CSF购于美国Peprotech公司,RMPI-1640培养基购于美国Hyclone公司;红细胞裂解液,购于中国碧云天公司;Transwell小室,购于美国Corning公司。FITC-抗小鼠 CD90、PE-抗小鼠 CD105、PE-抗小鼠CD73、APC-抗小鼠CD44、APC-抗小鼠CD31、FITC-抗小鼠CD45、FITC-抗小鼠CD4,IFN购于美国Biolegend公司。microRNA(序列如表1)、PCR引物由苏州吉玛基因股份有限公司合成。

表1 人工合成microRNA序列
二、实验方法
1.MSC的转染、转染效率和miRNA-155表达量检测:该部分实验分为Control组(不转染对照组)、agomir NC-Fam组(观察转染效率的荧光组)、miR-155-agomir NC组(高表达组的对照组)、miR-155-agomir组(高表达组 )、miR-155-antagomir NC组(抑制表达组的对照组)、miR-155-antagomir组(抑制表达组)。从2 ~ 3周小鼠骨髓中分离培养BMSCs,流式细胞仪检测其表面标志CD90、CD105、CD73、CD31和CD45以鉴定获得培养的P3 代 BMSCs。4 μl Lipofectamine 2 000 和 4 μl miRNA分别稀释于200 μl DMEM/F12不完全培养基中孵育5 min;将miRNA稀释液缓慢加入Lipofectamine 2000稀释液中,室温孵育10 min。6孔板用无血清DMEM/F12培养基换液(600 μl/孔),分别加入400 μl Lipofectamine 2000/siRNA复合物400 μl。转染 6 h后,换液为 DMEM/F12完全培养基。转染24 h后,在倒置荧光显微镜下观察Fam组绿色荧光初步判断转染效率,流式细胞检测技术进一步确定转染效率,实时荧光定量PCR仪检测各个组miR-155的表达量,反应体系如表2所示。
2.DC的获取、培养和迁移实验:该部分实验分为 DC only组、MSCs组(不转染组)、miR-155-agomir组(高 表 达 组)、miR-155-agomir NC 组(高表达组的对照组)、miR-155-antagomir组(抑制表达组)、miR-155-antagomir NC组(抑制表达组的对照组)。获取DC:无菌条件下取4只7 ~ 8周C57BL/6小鼠双侧股骨,冲洗骨髓得到的细胞悬液通过 40 μm 滤网过滤后,300×g离心 5 min,弃上清液,3 ml红细胞裂解液重悬沉淀,室温下反应2 min,加入含有5﹪血清的RMPI-1640 15 ml终止反应,300×g离心 5 min,弃上清液,1×PBS重悬离心洗涤细胞3遍,配置好的DC培养液(RMPI-1640+10 ﹪ FBS+1 ﹪ Glutamine+50 μmol/L β-巯基乙醇+40 ng/ ml GM-CSF)[22]重悬沉淀并接种于3 个6 cm培养皿中,37 ℃、5﹪CO2恒温培养箱中培养,48 h后首次换液,选用培养3 d的细胞。Transwell小室中将microRNA转染的BMSC与DC共培养48 h后,(1)通过标记DC的成熟相关的表面标志MHCⅡ、CD40和CD86的表达水平,判断DC的成熟度;(2)将共培养的DC细胞放入Transwell的上层小室,ATP溶液放入下层小室,12 h观察DC向ATP溶液的迁移情况。棉签涂抹去上层未迁移细胞,保留迁移的DC,DAPI染色10min后,倒置荧光显微镜下计数并统计;(3)提取DC的总蛋白,Western Blot法以GAPDH为内参,检测AKT、NF-κβ信号通路蛋白表达情况,探索影响机制。

表2 实时荧光定量PCR体系
3.T细胞增殖检测:脾脏来源单个核细胞的获取,无菌条件下取3只7 ~ 8周C57BL/6小鼠的脾脏,研磨脾脏获得细胞悬液,40 μm滤网过滤,经红细胞裂解液裂解后获得单个核细胞悬液。在Transwell小室中将经BMSC诱导后的DC与脾脏来源的细胞共培养72 h后,流式细胞检测共培养后T细胞增殖能力。初步探索诱导后的DC对T细胞影响。
三、统计学分析方法
采用GraphPad Prism 5.0 统计软件,数据统计采用± s表示。miR-155表达水平的组间差异和DC迁移能力组间差异以One-way ANOVA进行比较分析;DC表面标志和NF-κB,AKT信号通路蛋白两组间差异以t检验统计分析,以P< 0.05为差异具有统计学意义。
结 果
一、转染效率及miR-155表达水平
首先将分离培养的P3代BMSCs进行表型的鉴定,结果显示分离培养的BMSC为CD90、CD105、CD73、CD44阳 性,CD31和 CD45阴 性(图1),符合BMSCs的表型特征。应用Lip2000对BMSC进行转染,将转染BMSC 24 h后倒置荧光显微镜下观察,转染成功的BMSC为亮绿色,流式细胞计数Fam荧光提示转染效率为100﹪(图2、3),实时荧光定量PCR检测转染后miR-155的表达量,miR-155 agomir组miR-155表达水平较对照组升高了10 000倍,miR-155antagomir组miR-155的表达水平较对照组下降(表3)。
表3 转染后miR-155表达结果(± s)
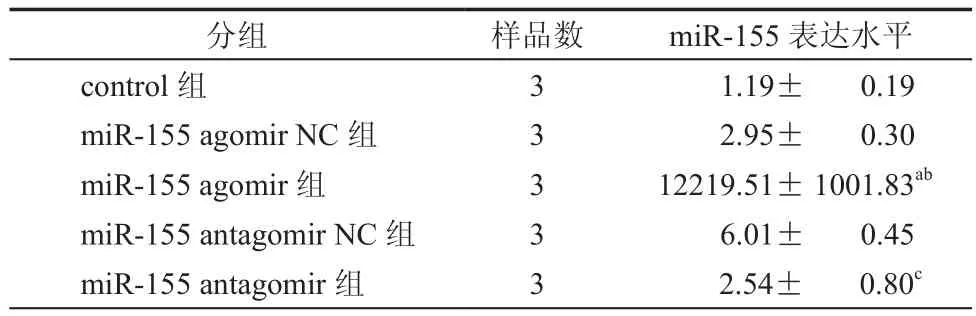
表3 转染后miR-155表达结果(± s)
注:F=446.077,P<0.001;与control组比较,aP<0.05;与miR-155 agomir NC组比较,bP<0.05;与miR-155 antagomirNC组比较,cP<0.05
分组 样品数 miR-155表达水平control组 3 1.19± 0.19 miR-155 agomir NC组 3 2.95± 0.30 miR-155 agomir组 3 12219.51± 1001.83ab miR-155 antagomir NC组 3 6.01± 0.45 miR-155 antagomir组 3 2.54± 0.80c
二、DC表型、迁移能力检测及其机制探索
在Transwell小室中,转染后的BMSC诱导DC 48 h后,进行 MHC Ⅱ,CD40,CD86的流式检测(图4),以明确诱导过程对DC免疫成熟度的影响,检测发现转染miR-155后的BMSC与DC共培养后,DC表面标志CD40阳性率从100﹪下降至85﹪(t=33.71,P< 0.05),CD86从 100﹪下降至 75﹪(t=57.00,P< 0.05),即减少了DC的成熟度(表4);DAPI核染迁移后的DC细胞,倒置荧光显微镜下计数并统计(图5),高表达miR-155组DC迁移能力降低(t=7.35,P< 0.05),抑制 miR-155 表达组,DC 迁移能力增加(表5)。Western Blot检测其信号通路蛋白表达情况(图6),miR-155 agomir组AKT信号通路蛋白相对表达下降(t=22.21,P< 0.05),NF-κβ通路蛋白相对表达降低(t=23.32,P< 0.05,表 6)。
三、miR-155高表达降低T细胞增殖能力
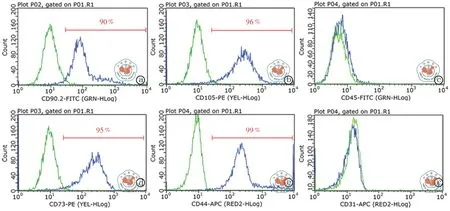
图1 BMSC表型的鉴定
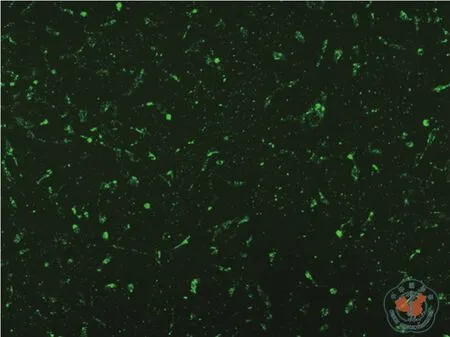
图2 倒置相差显微镜下观察转染后的间充质干细胞(×100)

图3 流式细胞检测Fam组荧光提示转染效率为100﹪
经诱导后的DC与脾脏来源T细胞共培养72h后,流式细胞术检测各组T细胞增殖能力,结果显示miR-155 agomir组T细胞增殖能力相对减弱,miR-155 antagomir组T细胞增殖能力相对增强(图 7)。
表4 DC表面标志表达结果(﹪, ± s)

表4 DC表面标志表达结果(﹪, ± s)
表面标志 转染前 转染后 t值 P值MHC II 99.57±0.39 97.96±0.57 2.224 0.09 CD40 99.69±034 85.18±0.66 33.710 <0.001 CD86 99.58±0.45 75.26±0.64 57.000 <0.001
表5 Transwell小室中迁移DC数目(个, ± s)
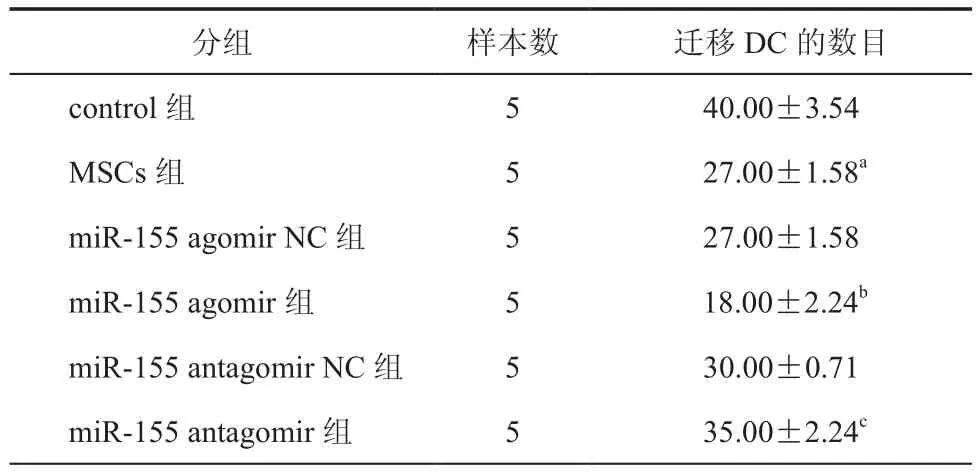
表5 Transwell小室中迁移DC数目(个, ± s)
注:F=61.179,P< 0.001与 control组比较,aP < 0.05;与 miR-155 agomir NC 组比较,bP < 0.05;与 miR-155 antagomirNC组比较,cP <0.05
分组 样本数 迁移DC的数目control组 5 40.00±3.54 MSCs组 5 27.00±1.58a miR-155 agomir NC组 5 27.00±1.58 miR-155 agomir组 5 18.00±2.24b miR-155 antagomir NC组 5 30.00±0.71 miR-155 antagomir组 5 35.00±2.24c
表6 AKT和NF-κβ信号通路蛋白相对表达情况结果( ± s)
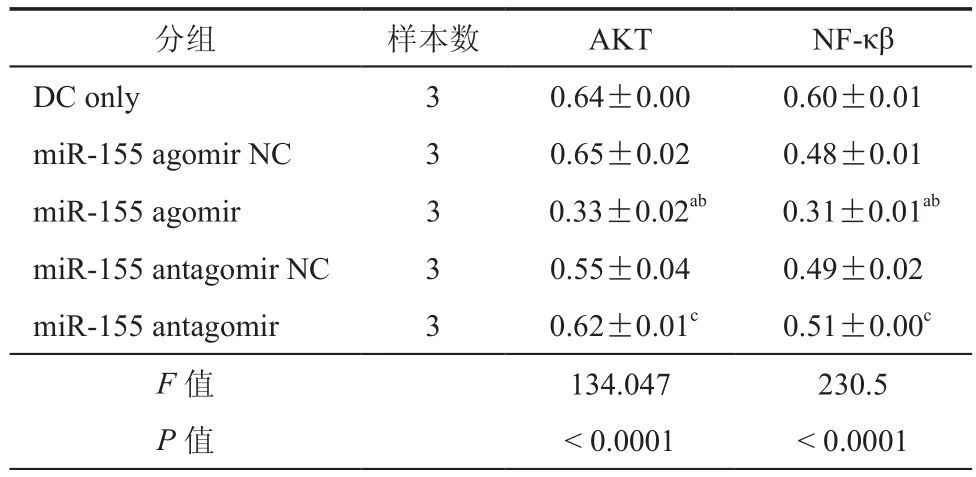
表6 AKT和NF-κβ信号通路蛋白相对表达情况结果( ± s)
注:与DC only组比较,aP < 0.05;与miR-155 agomir NC组比较,bP< 0.05;与 miR-155 antagomir NC 组比较,cP < 0.05
分组 样本数 AKT NF-κβ DC only 3 0.64±0.00 0.60±0.01 miR-155 agomir NC 3 0.65±0.02 0.48±0.01 miR-155 agomir 3 0.33±0.02ab 0.31±0.01ab miR-155 antagomir NC 3 0.55±0.04 0.49±0.02 miR-155 antagomir 3 0.62±0.01c 0.51±0.00c F值 134.047 230.5 P值 < 0.0001 < 0.0001
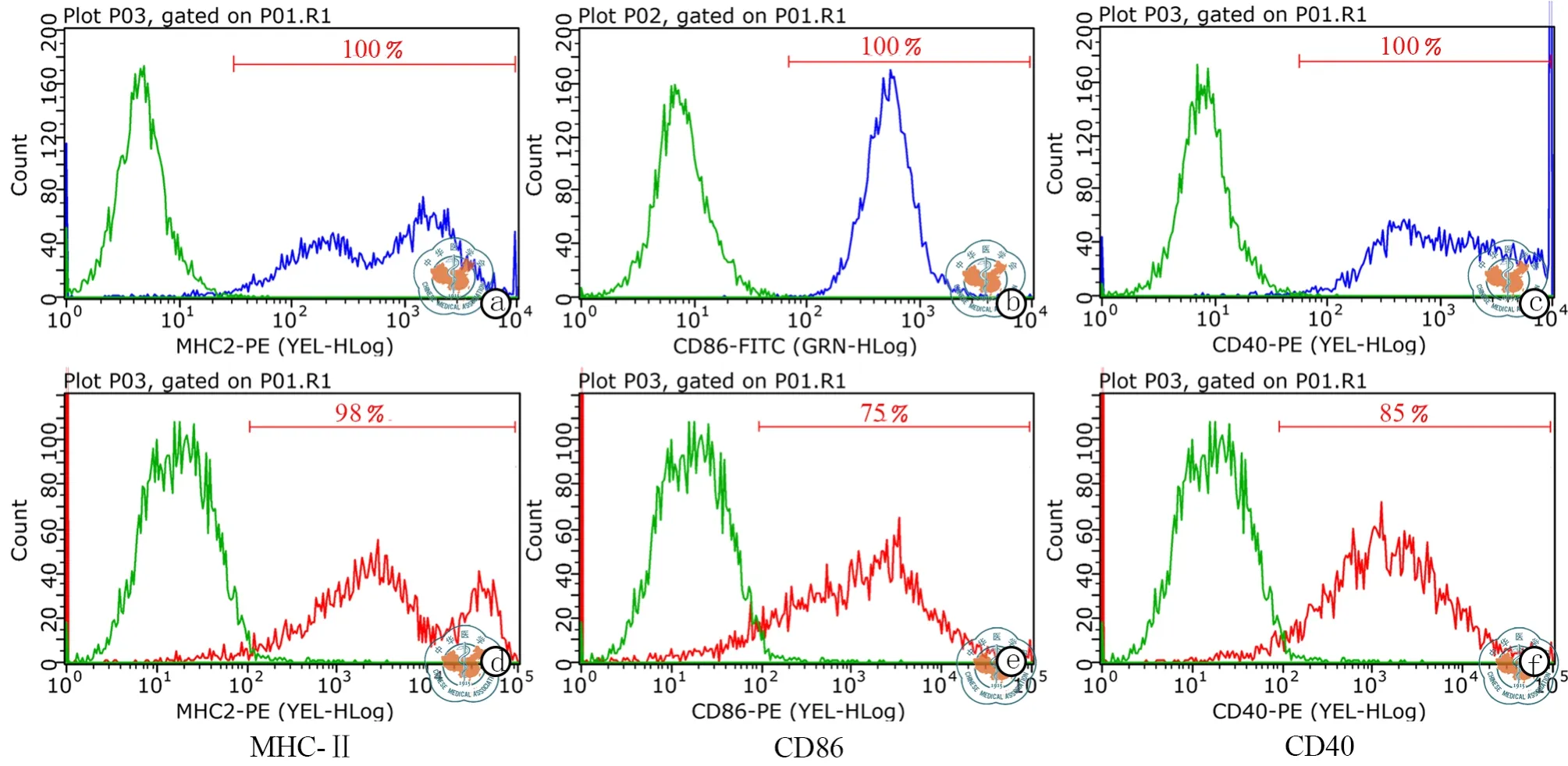
图4 转染前后DC表面标志表达情况
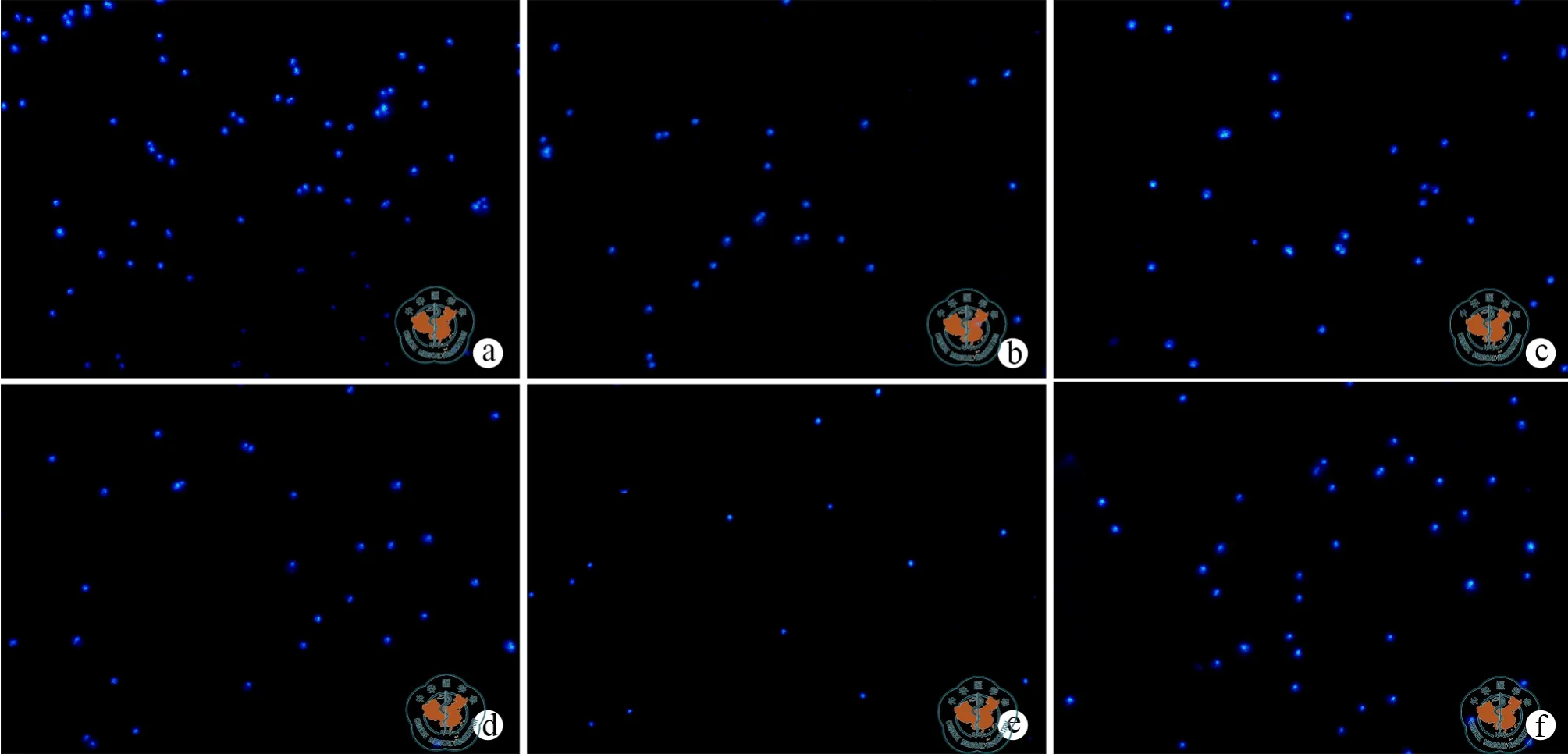
图5 倒置相差显微镜下观察DC迁移能力(×100)

图6 Western Blot检测信号通路蛋白表达情况
讨 论
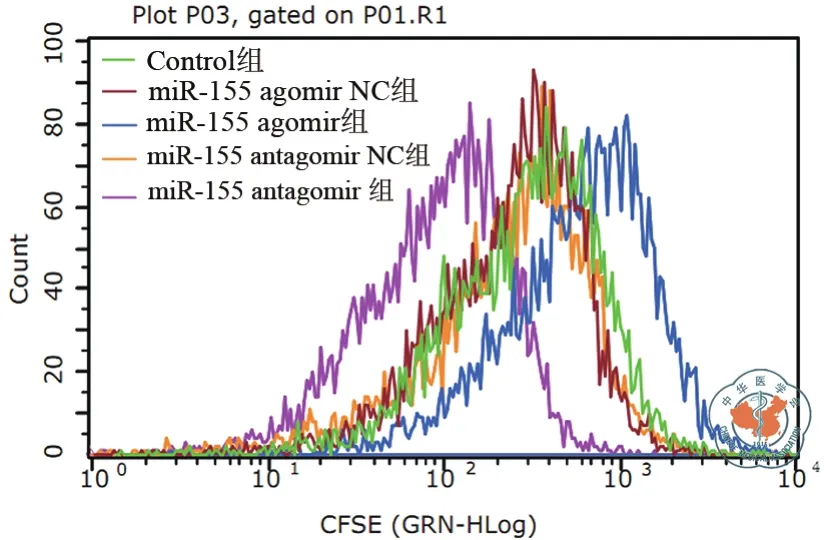
图7 流式细胞检测T细胞增殖能力
BMSC作为获取最便捷的干细胞,除了用于组织修复外,还具有免疫调节、诱导免疫耐受等功能,且广泛应用于移植物抗宿主病、类风湿关节炎等疾病的治疗[23-24]。但是,干细胞注射治疗存在移植细胞数量巨大、作用机制不明确等问题,限制了它的临床应用,许多学者考虑对其进行特异性干预以适应临床应用,其中有学者对JAM-A、OX40Ig、MicroRNA Let-7a等位点进行基因修饰[6,25-26],经过修饰的MSC均有更好的临床应用价值。前期实验发现,在大鼠同种异体心脏移植模型中,受体miR- 155表达水平增高,但是经过BMSC诱导免疫耐受后,miR-155表达水平下降,即注射BMSC能逆转miR-155的表达[9],这说明miR- 155在MSC发挥免疫调节中或许起着重要作用。有研究报道miR-155在类风湿关节炎、系统性红斑狼疮、溃疡性结肠炎等许多自身免疫性疾病的发生、发展中起着重要作用,众多研究表明其可能是潜在的治疗靶点[27-29]。另外,DC是人体内功能最强大的抗原提呈细胞,是免疫反应的启动者,MSC的培养上清可抑制DC中TLR(Toll样受体)3和TLR9的表达[18],与MSC共培养的DC可抑制CD4+T细胞增殖[17],相比较于BMSC与T细胞直接作用,通过DC发挥免疫调节这一途径或许有更好的临床应用前景。
本研究探究miR-155修饰后的BMSC通过DC这一途径发挥免疫调节作用。本研究成功构建了不同miR-155表达水平的BMSC。将预处理的BMSC与骨髓来源的DC细胞进行共培养,对DC进行诱导。转染后BMSC诱导DC结果说明了,miR-155的高表达有助于抑制DC表面分子CD40和CD86的表达,即抑制了DC的成熟,并且miR- 155agomir组DC可以减少DC的迁移,WB结果显示miR-155的高表达可能通过阻断AKT和NF-κβ途径诱导耐受性DC的形成。诱导后DC与T细胞共培养的结果提示,高表达miR- 155可以减少T细胞增殖能力。本研究结果表明miR-155的高表达可扩大BMSC的免疫调节作用,为以后进一步发挥BMSC免疫调节能力提供了一个方向,为临床应用BMSC诱导免疫耐受和治疗自身免疫性疾病提供一个思路。
综上所述,本研究证明了特异性调控BMSC的miR-155表达水平后,不同miR-155表达水平对BMSC免疫调节能力的影响,可以通过诱导DC这一途径实现。高表达miR-155的BMSC可通过抑制NF-κβ和AKT途径诱导耐受性DC形成,通过对T细胞增殖能力的检测,明确miR-155的高表达可加强BMSC的免疫调节能力。在临床应用中,一方面或许可以提高治疗移植物抗宿主病、类风湿关节炎、克罗恩病等自身免疫性疾病的效果,另一方面可能减少干细胞注射剂量,大大降低大剂量注射干细胞产生副作用。为扩大BMSC的临床应用提供了一个思路。
1 Keto J, Kaartinen T, Salmenniemi U, et al.Immunomonitoring of MSCTreated GvHD patients reveals only moderate potential for response prediction but indicates treatment safety[J].Mol Ther Methods Clin Dev, 2018, 9:109-118.
2 Wang XL, Zhao YY, Sun L, et al.Exosomes derived from human umbilical cord mesenchymal stem cells improve myocardial repair via upregulation of Smad7[J].Int J Mol Med, 2018, 41(5):3063-3072.
3 张玲, 张祥忠, 李晓青, 等.脐带间充质干细胞治疗难治性慢性移植物抗宿主病的疗效观察[J].器官移植, 2016, 7(6):459-462.
4 Zhao K, Lou R, Huang F, et al.Immunomodulation effects of mesenchymal stromal cells on acute graft-versus-host disease after hematopoietic stem cell transplantation[J].Biol Blood Marrow Transplant, 2015, 21(1):97-104.
5 Muller I, Kordowich S, Holzwarth C, et al.Application of multipotent mesenchymal stromal cells in pediatric patients following allogeneic stem cell transplantation[J].Blood Cells Mol Dis, 2008, 40(1):25-32.
6 Liu T, Zhang Y, Shen Z, et al.Immunomodulatory effects of OX40Ig gene-modif i ed adipose tissue-derived mesenchymal stem cells on rat kidney transplantation[J].Int J Mol Med, 2017, 39(1):144-152.
7 Jin X, Su R, Li R, et al.Crucial role of pro-inflammatory cytokines from respiratory tract upon PM2.5 exposure in causing the BMSCs differentiation in cells and animals[J].Oncotarget, 2018, 9(2):1745-1759.
8 Fang Y, Chu L, Li L, et al.Tetramethylpyrazine protects bone marrowderived mesenchymal stem cells against hydrogen peroxide-induced apoptosis through PI3K/Akt and ERK1/2 pathways[J].Biol Pharm Bull, 2017, 40(12):2146-2152.
9 Huang H, He J, Teng X, et al.Combined intrathymic and intravenous injection of mesenchymal stem cells can prolong the survival of rat cardiac allograft associated with decrease in miR-155 expression[J].J Surg Res, 2013, 185(2):896-903.
10 Zhang A, Wang K, Zhou C, et al.Knockout of microRNA-155 ameliorates the Th1/Th17 immune response and tissue injury in chronic rejection[J].J Heart Lung Transplant, 2017, 36(2):175-184.
11 Aboelenein HR, Hamza MT, Marzouk H, et al.Reduction of CD19 autoimmunity marker on B cells of paediatric SLE patients through repressing PU.1/TNF-alpha/BAFF axis pathway by miR-155[J].Growth Factors, 2017, 35(2-3):49-60.
12 Elmesmari A, Fraser AR, Wood C, et al.MicroRNA-155 regulates monocyte chemokine and chemokine receptor expression in Rheumatoid Arthritis[J].Rheumatology (Oxford), 2016, 55(11):2056-2065.
13 Garcia-Rodriguez S, Arias-Santiago S, Blasco-Morente G, et al.Increased expression of microRNA-155 in peripheral blood mononuclear cells from psoriasis patients is related to disease activity[J].J Eur Acad Dermatol Venereol, 2017, 31(2):312-322.
14 Yan L, Hu F, Yan X, et al.Inhibition of microRNA-155 ameliorates experimental autoimmune myocarditis by modulating Th17/Treg immune response[J].J Mol Med (Berl), 2016, 94(9):1063-1079.
15 Iberg CA, Jones A, Hawiger D.Dendritic cells as inducers of peripheral tolerance[J].Trends Immunol, 2017, 38(11):793-804.
16 Huang C, Zhang L, Ling F, et al.Effect of immune tolerance induced by immature dendritic cells and CTLA4-Ig on systemic lupus erythematosus: An in vivo study[J].Exp Ther Med, 2018, 15(3):2499-2506.
17 Wan J, Huang F, Hao S, et al.Interleukin-10 gene-modif i ed dendritic cell-induced type 1 regulatory T cells induce transplant-tolerance and impede graft versus host disease after allogeneic stem cell transplantation[J].Cell Physiol Biochem, 2017, 43(1):353-366.
18 Lee YS, Sah SK, Lee JH, et al.Human umbilical cord blood-derived mesenchymal stem cells ameliorate psoriasis-like skin inf l ammation in mice[J].Biochem Biophys Rep, 2017, 9:281-288.
19 Sadeghi L, Karimi MH, Kamali-Sarvestani E, et al.The immunomodulatory effect of bone-marrow mesenchymal stem cells on expression of TLR3 and TLR9 in mice dendritic cells[J].Int J Organ Transplant Med, 2017, 8(1): 5-42.
20 Tsukamoto H, Fujieda K, Hirayama M, et al.Soluble IL6R expressed by myeloid cells reduces tumor-specif i c Th1 differentiation and drives tumor progression[J].Cancer Res, 2017, 77(9):2279-2291.
21 Pichler R, Gruenbacher G, Culig Z, et al.Intratumoral Th2 predisposition combines with an increased Th1 functional phenotype in clinical response to intravesical BCG in bladder cancer[J].Cancer Immunol Immunother, 2017, 66(4):427-440.
22 Dewitte H, Verbeke R, Breckpot K, et al.Choose your models wisely:how different murine bone marrow-derived dendritic cell protocols inf l uence the success of nanoparticulate vaccinesin vitro[J].J Control Release, 2014, 195:138-146.
23 Salmenniemi U, Itala-Remes M, Nystedt J, et al.Good responses but high TRM in adult patients after MSC therapy for GvHD[J].Bone Marrow Transplant, 2017, 52(4):606-608.
24 Sun Y, Kong W, Huang S, et al.Comparable therapeutic potential of umbilical cord mesenchymal stem cells in collagen-induced arthritis to TNF inhibitor or anti-CD20 treatment[J].Clin Exp Rheumatol, 2017,35(2):288-295.
25 Yu Y, Liao L, Shao B, et al.Knockdown of MicroRNA Let-7a improves the functionality of bone marrow-derived mesenchymal stem cells in immunotherapy[J].Mol Ther, 2017, 25(2):480-493.
26 Wu M, Guo X, Yang L, et al.Mesenchymal stem cells with modif i cation of junctional adhesion molecule a induce hair formation[J].Stem Cells Transl Med, 2014, 3(4):481-488.
27 Li Y, Duo Y, Bi J, et al.Targeted delivery of anti-miR-155 by functionalized mesoporous silica nanoparticles for colorectal cancer therapy[J].Int J Nanomedicine, 2018, 13:1241-1256.
28 Tu YX, Wang SB, Fu LQ, et al.Ovatodiolide targets chronic myeloid leukemia stem cells by epigenetically upregulating hsa-miR-155,suppressing the BCR-ABL fusion gene and dysregulating the PI3K/AKT/mTOR pathway[J].Oncotarget, 2018, 9(3):3267-3277.
29 Peng J, Liu H, Liu C.MiR-155 promotes uveal melanoma cell proliferation and invasion by regulating NDFIP1 expression[J].Technol Cancer Res Treat, 2017, 16(6):1160-1167.

