CA19-9时间分辨荧光免疫层析检测方法的建立
王云龙,米亚双,李玉林,王继创,程蕾,闫生辉,邓黎黎
1 河南师范大学 生命科学学院,河南 新乡 453002
2 河南省生物工程技术研究中心,河南 郑州 450121
3 郑州职业技术学院,河南 郑州 450121
4 生物标志物定量检测河南省工程实验室,河南 郑州 450121
糖链抗原 19-9 (Carbohydrate antigen 19-9,CA19-9) 是 Koprowski等发现的一种由消化系统肿瘤组织所产生的特异性糖蛋白,也是唾液酸 Lewisa血型抗原的标志[1-2]。CA19-9属于消化系统相关抗原,主要表达于胰腺上皮细胞,抗原的分子量约为10 kDa,正常人体血清中的含量小于37 U/mL[3-6]。研究表明,CA19-9在消化系统恶性肿瘤患者体内有异常表达,其中在胰腺癌、胆道癌、胃癌、结肠癌、食管癌、肝癌中存在较高的阳性率,而胰腺癌患者中CA19-9的阳性率最高,达到86%,并且在胰腺癌初期,血清中CA19-9的含量达到406 U/mL,CA19-9可作为胰腺癌重要的早期诊断指标之一[7-12]。
目前,国内针对CA19-9的检测方法有放射免疫测定法、化学发光法、电化学发光法、酶联免疫法等,这些方法需要在实验室借助设备进行,均不适宜用于床旁快速诊断。荧光快速层析检测技术具有安全、费用低、操作简便、可实现床旁快速检测等优点[13-15]。基于此,本研究建立了一种荧光定量免疫层析快速检测CA19-9的技术和方法,以满足临床床旁快速检测和基层社区医院的需要。
1 材料与方法
1.1 材料
1.1.1 实验材料
PVC板、吸水纸、硝酸纤维素膜 (CN-140)、玻璃纤维棉由郑州宝赛生物科技公司提供。临床定值血清标本由河南省生物工程技术研究中心提供。
1.1.2 试剂
羧基修饰时间分辨荧光微球、CA19-9配对单克隆抗体、羊抗鼠IgG、CA19-9线性参考品 (1 000、900、800、400、200、100、50、25、12.5、6.25 U/mL)、CA19-9精密性质控品 (400、100、30 U/mL)、特异性质控品 (CEA、AFP、CA125、CA153,4份质控品中 CA19-9的含量均为 200 U/mL,CEA质控品中CEA含量为400 ng/mL,AFP质控品中AFP含量为 400 U/mL,CA125质控品中 CA125含量为400 U/mL,CA153质控品中CA153含量为400 U/mL)均由河南省生物工程技术研究中心提供。
1.1.3 仪器
荧光免疫层析读数仪购自杭州峰航科技有限公司;紫外分析仪 (JY03型) 购自北京君意东方电泳设备有限公司;台式高速离心机 (H1850) 购自湖南湘仪实验室仪器开发有限公司;三维喷金点膜仪、微电脑自动斩条机购自上海金标生物科技有限公司。
1.2 方法
1.2.1 免疫微球的制备
取 20 μL荧光微球于 1.5 mL离心管中,加入1 000 μL 硼酸缓冲液 (0.05 mol/L,pH 8.0,下同)混匀,13 000 r/min离心15 min,弃上清;加入1 000 μL硼酸缓冲液进行重悬,加入15 μL EDC (10 mg/mL),混匀后室温振荡活化18 min,13 000 r/min离心13 min,弃去上清;加1 000 μL硼酸缓冲液进行重悬,加入CA19-9标记抗体100 μg,振荡混匀,超声振荡5 min,低速振荡标记2 h;14 000 r/min离心20 min,弃上清,400 μL 复溶液重悬,加入 20 μL BSA (20%),振荡混匀,低速振荡封闭1 h,4 ℃密封保存。
1.2.2 CA19-9荧光免疫层析定量检测试纸条的制备
调节三维平面点膜喷金仪,将 2 mg/mL 的CA19-9包被抗体和 1 mg/mL羊抗鼠包被于 NC膜上分别作检测线 (T线) 和质控线 (C线),包被量为 1 μL/cm;将制备好的免疫微球喷涂到微球结合垫上,喷涂量为6 μL/cm。包被抗体的NC膜和微球结合垫37 ℃干燥1.5 h。将吸水纸、NC膜、结合垫、样品垫分别按照相应的位置组合于PVC底板上,用微电脑自动斩条机切成 3.8 mm宽的试纸条,组装卡壳,4 ℃密封保存。
1.2.3 检测
取 70 μL血清样本加入到试纸条的点样窗口,用荧光免疫层析读数仪检测质控线与检测线的荧光强度。
1.2.4 最佳标记蛋白量与包被蛋白量的确定
采用二因素多水平实验确定最佳 CA19-9标记抗体与CA19-9包被抗体的量,设计20 μL荧光微球的标记抗体梯度为 40、60、80、100 μg,CA19-9包被抗体浓度梯度为0.5、1.0、1.5、2.0 mg/mL。按照1.2.1与1.2.2的方法进行试纸条的制备,用线性参考品检测试纸条的线性范围与R2。
1.2.5 检测时间的确定
用线性参考品 (200、100、50 U/mL) 按照 70 μL的加样量进行点样,分别在点样后5、8、10、12、15、18、20、22 min检测试纸条的C、T线荧光强度,记录T线的荧光值,计算T/C。
1.2.6 方法学评价
线性范围:使用CA19-9线性参考品,以T/C的值为纵坐标,CA19-9浓度为横坐标,制作标准曲线,建立线性方程。
最低检出限:用空白对照进行重复检测20次,求出T/C的平均值,+2s代入零浓度和相邻线性参考品拟合的一次方程得出最低检出限。
交叉反应:取 CEA、AFP、CA125、CA153共4份特异性质控品评价试纸条的特异性。
精密性: 用精密性质控品 (400、100、30 U/mL)对同一批次和3个不同批次试纸条重复检测各10次,分别计算批内与批间试纸条的精密性(CV),计算公式如下:
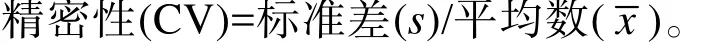
回收实验:用基质血清将800 U/mL CA19-9血清进行稀释,获得3份血清,预测浓度分别为200、100、50 U/mL。用制备好的试纸条进行检测,计算试纸条的回收率。
回收率=测定值/预测值×100%。
稳定性:将制备的试纸条,分别存放于4 ℃和37 ℃,在第6、12、18、21、24天分别用精密性质控品 (100 U/mL) 检测试纸条的T线荧光强度和T/C的值。
临床评价:用所建立的 CA19-9荧光定量检测试纸条与罗氏电化学发光法检测试剂盒 (郑州大学第一附属医院检测) 平行检测 50份临床血清,对两种检测方法进行比较,得到相关性曲线。
2 结果
2.1 最佳标记抗体量与包被抗体浓度的确定
如表 1所示,20 μL荧光微球的标记抗体量为 80 μg,包被抗体浓度为 1.5 mg/mL时,试纸条的线性范围最宽,R2最大,分别为12.5–800.0 U/mL,R2=0.996 8。
2.2 最适检测时间的确定
实验结果见图 1。由图可知荧光强度随时间的变化而增大,12 min后T/C值趋于平稳,选择15 min作为最适检测时间。15 min后紫外分析仪检测结果如图2所示。
2.3 方法学评价
线性范围:测得 CA19-9线性范围为 12.5–800 U/mL。
最低检出限:CA19-9荧光层析试纸条的最低检出限为6.32 U/mL。
特异性:结果如表2所示,4份特异性质控品检测结果差异不显著,本试纸条的特异性较好。
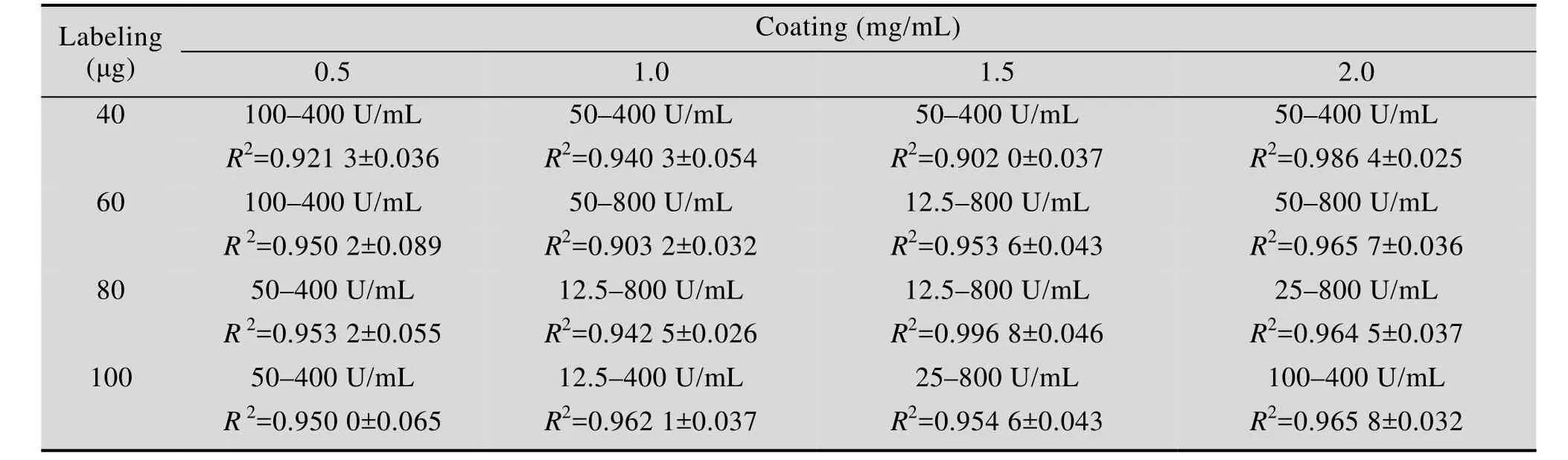
表1 最佳标记蛋白量与包被蛋白量结果Table 1 The best amount of labeling and coating
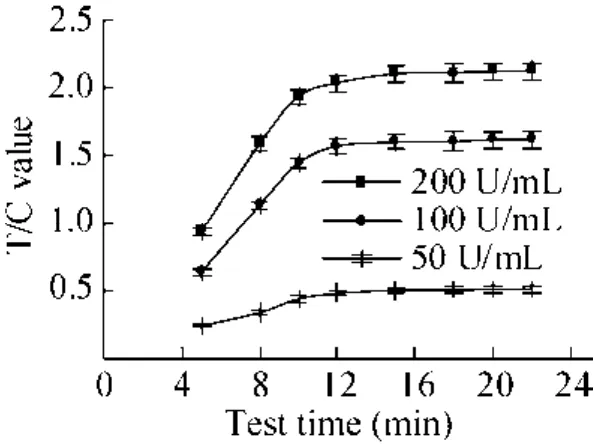
图1 最适检测时间结果Fig. 1 The results of best detection time.
图2 15 min紫外检测结果Fig. 2 The results of UV detection in 15 min. 1: 50 U/mL;2: 100 U/mL; 3: 200 U/mL.
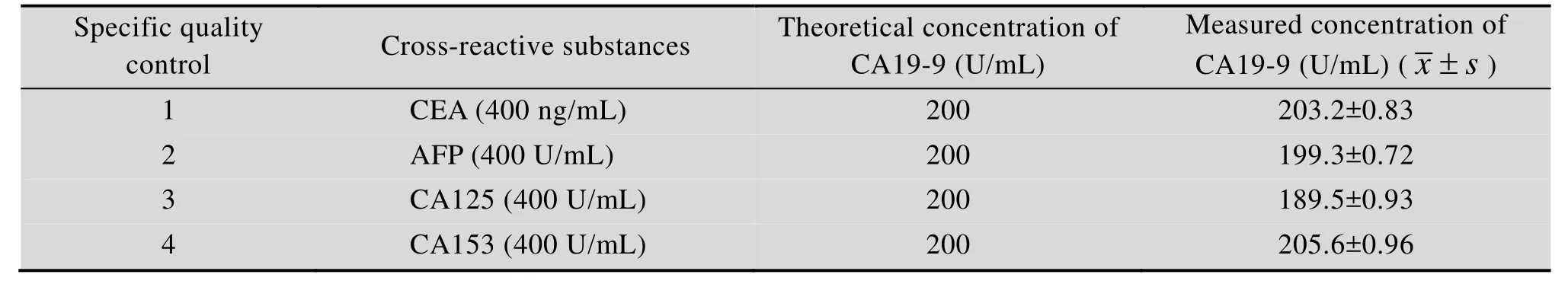
表2 特异性质控品检测结果Table 2 The results of specific control test
精密性:3份精密性质控品 (400、100、30 U/mL)检测试纸条批内精密性分别为 4.32%±0.16%、5.70%±0.21%、6.02%±0.19%,批间精密性分别为4.26%±0.18%、6.46%±0.23%、7.21%±0.19%。均符合小于15%的要求。
回收实验:试纸条检测3份血清的回收率分别为101%、103%和99%,平均回收率为101%,符合要求。
稳定性:检测结果如图 3、图 4所示,试纸条在37 ℃存放24 d后T值明显下降,但是T/C值无明显变化,说明试纸条的稳定性良好。
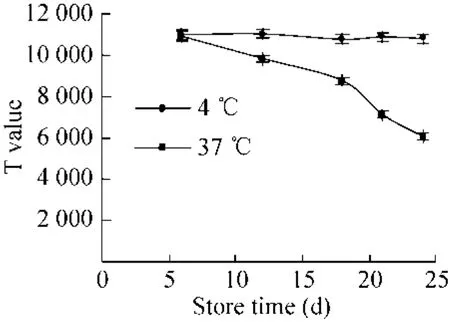
图3 试纸条稳定性T值Fig. 3 T value of test strip stability.
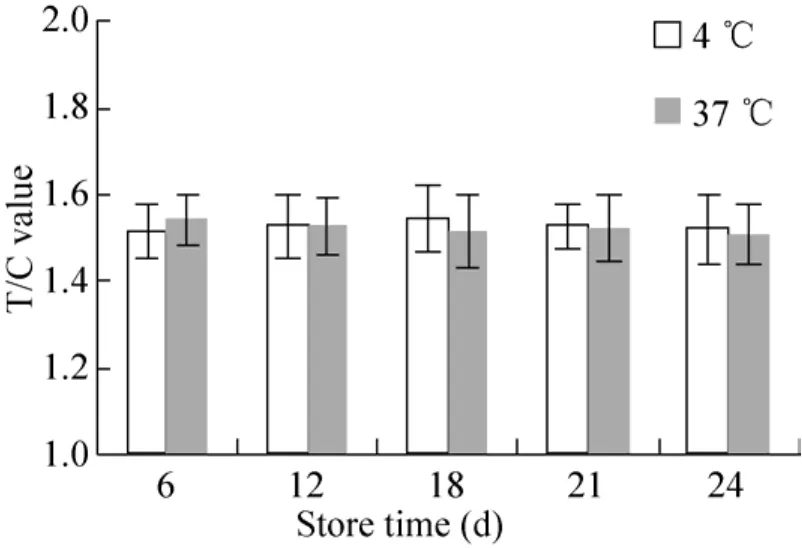
图4 试纸条稳定性T/C值Fig. 4 T/C value of test strip stability.
临床评价:分别用两种方法对50份样本进行检测,结果如图5所示,两种检测方法的相关系数为0.980 6,两者相关性良好。
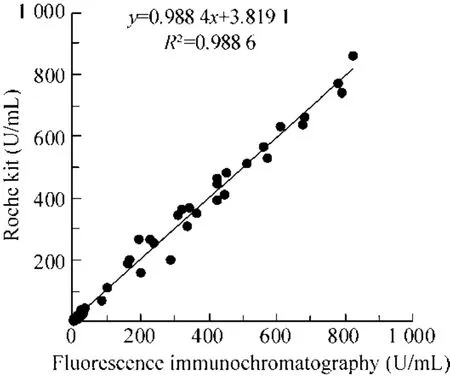
图5 临床样本检测结果Fig. 5 The results of clinical sample test.
3 讨论
时间分辨荧光免疫层析具有无放射性污染、无背景荧光干扰等优点,其原理为血清中的CA19-9在层析作用下,与微球垫上的CA19-9单抗结合形成其微球-抗体-抗原复合物,在硝酸纤维素膜的毛细管作用下与包被在膜上的 CA19-9单抗结合,15 min后可检测荧光信号,实现定量检测。该方法作为POCT发展的新方向之一,成为目前的研究热点,在临床检测中具有广阔的发展前景。
虽然有学者进行 CA19-9时间分辨荧光免疫层析产品的相关研究,但目前他们的研究水平线性范围窄,试纸条的准确度差等。王青[16]、黄飚等[17]分别利用Eu3+作为标记物、96孔板作为固相载体进行 CA19-9时间分辨荧光免疫分析方法的建立,该方法需进行洗涤等一系列繁琐的操作步骤,检测设备昂贵,不适应床旁快速检测。蒋能辉等[18]申请了肿瘤标志物的定量检测试剂条专利,采用CA19-9单克隆抗体与抗IgG抗体分别标记荧光微球,包被CA19-9单抗与抗IgG制备检测试纸条,其试纸条线性范围为0–200 U/mL,不能完全满足临床需要。
为解决试纸条的线性范围窄、样品需额外稀释等问题,我们采用新的思路与方法,在制备工艺微球的偶联等方面进行诸多创新,采用CA19-9单克隆抗体的单独标记,同时在抗体配对的选择上采用独特的方法。本研究设计二因素多水平实验对最佳包被抗体量与最佳标记抗体量进行研究。发现包被抗体量的增加,可使线性范围增宽,但是包被抗体量过多会引起假阳性率增高。羧基荧光微球经过活化后羧基与标记抗体的氨基缩合形成酰胺键,羧基荧光微球表面的羧基量是一定的,因此荧光微球与 CA19-9标记抗体的比例对于试纸条的性能至关重要。标记抗体量过少,荧光强度弱,试纸条灵敏性低;抗体量过多,则造成荧光微球聚集。结合试验结果最优与经济的原则,最终确定20 μL微球的最佳CA19-9标记抗体量为80 μg,包被抗体浓度为1.5 mg/mL。
荧光微球中包裹了成千上万个荧光分子,荧光强度高,制备的试纸条在检测时质控线 (C线)和检测线 (T线) 均能随着抗原梯度而表现出一定的趋势。但是试纸条在长期存放过程中,C、T线的荧光值会出现衰减,而T/C的值比较稳定。本研究的稳定性检测,将试纸条存放在 4 ℃与37 ℃ (加速破坏实验) 后,结果显示37 ℃存放24 d后T/C的值没有明显变化,因此根据T/C值与抗原浓度建立线性方程。本研究采用线性范围、精密性、特异性等作为衡量 CA19-9荧光免疫层析试纸条的性能评价标准,经过多次重复,确定线性范围为 12.5–800 U/mL,批内精密性与批间精密性均满足小于15%的要求,与常见的肿瘤标志物 (CEA、AFP、CA125、CA153) 均无交叉反应,与罗氏电化学发光法对比,其相关系数达到0.980 6。罗氏电化学发光法检测CA19-9,由于仪器试剂昂贵,对操作人员要求较高,在大型医院的检测费用达到上百元,检测时间需要20 min;而CA19-9荧光免疫层析试纸条对检测仪器及操作人员要求不高,费用低廉、操作简单,检测费用仅为20元左右,15 min即可出结果,能满足基层社区医院的需求。本研究建立了一种精密性好、简便、检测范围宽、能满足床旁快速定量检测的 CA19-9荧光免疫层析检测方法,具有潜在的临床应用价值。进一步研究将增加 CA19-9荧光免疫层析试纸条的生产批次,加大检测的样本数量,为其应用于临床打下基础。
REFERENCES
[1]Koprowski H, Steplewski Z, Mitchell K, et al.Colorectal carcinoma antigens detected by hybridoma antibodies. Somatic Cell Genet, 1979, 5(6): 957–971.
[2]Ni XG, Zhao P, Wang GQ. The clinical value of serum CA19-9 in the diagnosis and prognosis of pancreatic cancer. J Clin Exp Med, 2008, 45(5): 14–15(in Chinese).倪晓光, 赵平, 王贵齐. 血清肿瘤标志物CA19-9在胰腺癌诊断和预后中的价值. 临床和实验医学杂志,2008, 45(5): 14–15.
[3]Tempero MA, Uchida E, Takasaki H, et al.Relationship of carbohydrate antigen 19-9 and Lewis antigens in pancreatic cancer. Cancer Res, 1987,47(20): 5501–5503.
[4]Albert MB, Steinberg WM, Henry JP. Elevated serum levels of tumor marker CA19-9 in acute cholangitis.Digest Dis Sci, 1988, 33(10): 1223–1225.
[5]Kodera Y, Yamamura Y, Torii A, et al. The prognostic value of preoperative serum levels of CEA and CA19-9 in patients with gastric cancer. Am J Gastroenterol, 1996, 91(1): 49–53.
[6]Kochi M, Fujii M, Kanamori N, et al. Evaluation of serum CEA and CA19-9 levels as prognostic factors in patients with gastric cancer. Gastric Cancer, 2000,3(4): 177–186.
[7]Yan QF, Chen YL, Wang YZ. Development of a CA19-9 immunoradiometric assay. J Isot, 2007,20(1): 16–19 (in Chinese).燕强奋, 陈永利, 王衍真. CA19-9双位点夹心免疫放射分析法的建立. 同位素, 2007, 20(1): 16–19.
[8]An XY. Evaluation of domestic CA19-9 chemiluminescence assay kits. J Jiangsu Univ: Med Sci, 2010, 20(4): 317–320 (in Chinese).安仙园. 国产CA19-9化学发光检测试剂盒的评价.江苏大学学报: 医学版, 2010, 20(4): 317–320.
[9]Kouri M, Pyrhönen S, Kuusela P. Elevated CA19-9 as the most significant prognostic factor in advanced colorectal carcinoma. J Surg Oncol, 1992, 49(2):78–85.
[10]Li FH, Wang XD, Xiang X. Clinical value of serum CA199 assays in the diagnosis of alimentary canal malignancy. Chin J Med Guide, 2013, 15(5):876–878 (in Chinese).李凤焕, 王晓东, 向鑫. 消化道恶性肿瘤血清CA199检测的临床意义. 中国医药导刊, 2013,15(5): 876–878.
[11]Qin W. Detection of CA19-9 for the diagnosis of early pancreatic cancer. Chin J Clin Oncology Rehabilitation, 2013, 20(4): 385–386 (in Chinese).秦伟. 糖类抗原CA19-9诊断早期胰腺癌的效果观察. 中国肿瘤临床与康复, 2013, 20(4): 385–386.
[12]Morita S, Nomura T, Fukushima Y, et al. Does serum CA19-9 play a practical role in the management of patients with colorectal cancer? Dis Colon Rectum,2004, 47(2): 227–232.
[13]Wang YL, Tang QY, Chen XY. Practical Diagnostic Techniques of Immunodiagnostics. Beijing: China Ocean Press, 2009: 79–180 (in Chinese).王云龙, 唐秋艳, 陈兴业. 免疫诊断试剂实用技术. 北京: 海洋出版社, 2009: 79–180.
[14]Yang YJ. Fluorescent microspheres immunochromatographic assays for rapid detection of prealbumin and bone alkaline phosphatase[D].Nanchang: Nanchang University, 2016 (in Chinese).杨亚杰. 荧光免疫层析法快速定量检测前白蛋白和骨特异性碱性磷酸酶[D]. 南昌: 南昌大学,2016.
[15]Zhu L, Zhou Y, Huang B, et al. Establishment of a TRFIA-POCT for FER antibody and its clinical applecanon. Curr Immunol, 2016(1): 50–53 (in Chinese).朱岚, 周衍, 黄飚, 等. 铁蛋白时间分辨荧光免疫层析法的建立及临床应用. 现代免疫学, 2016(1):50–53.
[16]Wang Q, Sheng SL, Huang G. Development of TRFIA for CA19-9 and effect of EDTA on CA19-9 measurement. Labeled Immun Clin Med, 2007,14(2): 100–102 (in Chinese).王青, 盛世乐, 黄钢. CA19-9时间分辨荧光免疫分析方法建立及 EDTA处理血浆对其测定结果的影响. 标记免疫分析与临床, 2007, 14(2): 100–102.
[17]Huang B, Xiao HL, Zhu LG, et al. Study and application of time-resolved fluoroimmunoassay of CA19-9. Labeled Immun Clin Med, 2001, 8(1):25–27 (in Chinese).黄飚, 肖华龙, 朱利国, 等. CA19-9时间分辨荧光免疫分析方法的建立及应用. 标记免疫分析与临床, 2001, 8(1): 25–27.
[18]Jiang NH, Chang WW, Tang S, et al. Preparation and test of test strip for quantitative detection of tumor markers: China, CN201610105566.X. 2017-09-01(in Chinese).蒋能辉, 常文伟, 唐盛, 等. 定量检测肿瘤标志物的试纸、制备方法及检测方法: 中国,CN201610105566.X. 2017-09-01.

