Wnt3a蛋白诱导BMSC定向分化并促进大鼠创面修复的实验研究
曹华平,叶 涛,李永忠,喻 璐,闵 华
烧伤或高能量损伤所致的大面积皮肤软组织缺损伤口的修复一直是临床上较为棘手的难题,全球每年在此类患者的诊治工作上耗费了大量的人力物力,但临床疗效远不能令人满意[1]。
血管内皮细胞、周细胞及血管平滑肌细胞在复杂性创面的修复与愈合中扮演着重要角色,也是伤口肉芽组织再生及成熟的必须组织细胞来源[2-3]。由此,如何在体外大量扩增或在创面局部刺激诱导再生上述细胞,是临床上应用组织工程修复治疗难愈性创面的关键。
干细胞治疗,特别是利用骨髓来源的间充质干细胞(BMSCs)强大的定向分化能力,已经被证实可参与皮肤伤口的修复,尤其在上皮细胞再生以及血管重建过程中扮演着重要角色[4-5]。但遗憾的是,一直以来,外源性的BMSCs在移植至受体后较低的存活率以及移植成功率极大地阻碍了其在临床上的应用。有学者分析这可能与创面愈合过程中Wnt/β-catenin信号通路功能低下有关[6]。
Wnt 蛋白负责调节细胞增殖、分化、活力、极性等一系列的生物学行为[7]。新近研究表明 Wnt 蛋白及其下游信号通路在间充质干细胞的增殖及分化过程中发挥重要作用[8]。但目前为止关于经典 Wnt 信号通路对于干细胞,尤其是诱导BMSCs向皮肤伤口重建所需细胞的定向分化中的调节作用尚无定论。因此,本实验中将BMSCs作为种子细胞移植于皮肤软组织缺损动物伤口,并通过分子生物学方法观察经典Wnt蛋白(Wnt3a)对BMSCs的定向分化是否具有正向诱导作用,以及BMSCs与Wnt3a联合应用后对创面修复是否具有促进作用,从而为临床上难愈性创面修复的治疗提供新的思路。
材料与方法
1 实验材料与仪器
清洁级SD大鼠80只,雄性,3周龄,体重40~50g,购自武汉大学-实验动物中心。OLYMPUS 倒置显微镜(IX-51)(OLYMPUS公司,日本),超净工作台 (中国苏州安泰空气技术有限公司,解剖器械:组织剪,血管钳,组织镊,显微器械,手术刀(片)(上海医疗器械集团有限公司,中国),二氧化碳恒温培养箱 (Forma公司,美国),荧光定量PCR仪(StepOneTM Real-Time PCR System)。Wnt3a蛋白(R&D公司)。兔抗大鼠抗体CD31,a-SMA,VEGF,NG2(Abcam,美国)。大鼠TGF-β试剂盒Rat LAP(TGF beta 1)Ready-SET-Go(eBiocsience,美国)。
2 实验方法
2.1大鼠骨髓间充质干细胞(BMSC)提取、分离、培养及鉴定 过量乙醚处死大鼠,以75%乙醇浸泡5min消毒。用无菌手术器械在尽量保持大鼠双股骨和胫骨的完整性的条件下剔除皮肤、皮下组织、脂肪、肌腱、韧带、神经及血管。用组织剪分别剪去长骨两端骨骺,暴露骨髓腔,以20mL注射器吸取含低糖DMEM培养液(含15%血清,1%双抗)反复冲洗骨髓腔,待骨髓收集完全,骨组织冲至发白后,将收集到的骨髓细胞及组织悬液离心(1 200r/min,7min),弃上清,加入完全培养基,重悬细胞。接种于25cm2培养瓶,置37℃、5%CO2培养箱中培养,并标记为原代。待细胞铺满培养瓶底(约90%密度)时以0.25%胰蛋白酶消化细胞后传代培养。选择第三代用于后续实验。
2.2BMSC细胞分组及处理
将BMSC分为对照组及Wnt3a组,6孔板培养,每组3个复孔。对照组以DMEM培养基培养,Wnt3a组以DMEM+Wnt3a信号通路激动剂Wnt3a(终浓度为200μg/L)培养。置于37℃、5%CO2培养箱中,每隔3d换液1次,共培养7~10d。
2.3动物模型制作、分组及相关处理 动物按照随机数字法分为4组(每组20只)。实验第1天,所有动物施行麻醉(腹腔注射60mg/kg盐酸氯胺酮)。手术过程由同一位具有丰富外科手术经验的医师施行(单盲)。大鼠取俯卧位,背部脱毛,碘伏消毒,铺单。以后正中线为纵径,行椭圆形全层皮肤切口(直径2cm),切除皮肤,皮下组织直至腰背筋膜。BMSCs注射组:约3× 106个BMSCs以100μL PBS重悬成单细胞悬液,经1mL注射器在皮肤伤口周缘等分以后分12点皮下注射;Wnt3a组:约500μL 含Wnt3a的PBS溶液(200μg/L),经1mL注射器在皮肤伤口周缘等分以后分12点皮下注射;BMSCs+Wnt3a组: 先行Wnt3a注射,再行BMSC注射,注射部位及注射量同前述分组;假手术组:除全层皮肤切口以外,不做其余处理。四组大鼠手术完毕后均以生物半透膜(VSD医疗技术公司,武汉)覆盖以封闭伤口,避免水凝胶外漏及伤口干燥。健康SD大鼠作为空白对照。所有大鼠均单笼饲养。
于术后第3、7、11和16天,取伤口处组织活检行后续实验。为后续组织学病理检测,所得活检组织立即经OCT包埋剂包埋,-80°C保存,供后续RT-PCR检测用,或经4%多聚甲醛固定过夜然后由石蜡包埋行HE染色,Masson’s Trichrome 染色,免疫荧光染色等。所有病理检测均由两位病理医师操作及读片(单盲)。
2001年,按照国家计委、交通部的统一部署,做为主要技术业务骨干,王世君参与完成了全县地方道路的公路网络规划工作。2010年在鸡东县交通运输局作为主要技术骨干之一参与完成鸡东县交通局“十二五规划”工作,为该县的农村公路建设打好了基础。
2.4免疫荧光染色观察相关标志物表达 BMSCs(对照组及Wnt3a组)免疫荧光染色法观察相关标志物(Oct4,Klf4,NG2,CD31,VEGF,a-SMA)的表达。去掉培养皿或孔板中的培养基,加入4%多聚甲醛室温固定细胞20min。PBS漂洗3次,加破膜工作液孵育10min,加入3%过氧化氢溶液,室温避光孵育10min。甩干后5%BSA封闭20min,加入约50μL稀释的一抗[兔抗大鼠VEGF(1:200),CD31(1:100),NG2(1:50),a-SMA(1:100),Oct4(1:100),Klf4(1:100)]覆盖玻片,4℃过夜。加50μL二抗[Cy3-AffiniPure F(ab’)2 Fragment Goat Anti-Rabbit IgG(H+L),1:50],4℃孵育50min。加DAPI染液,避光孵育5min。滴加抗荧光淬灭封片剂,荧光显微镜下观察并拍照。
2.5Real-Time PCR 取各组处理后的BMSCs,去除板中培养液,加1m LPBS溶液(4℃),小心洗涤;对于组织中相关指标的检测,将各组大鼠在各时间点行伤口组织取活检后用TaKaRa MiniBEST Universal RNA Extraction Kit(Takara Bio,Japan)提取RNA。使用EasyScript First-Strand cDNA Synthesis SuperMix进行cDNA合成。取12.5μL的2× qPCR Mix,2.0μL的2.5μM内标引物,2.0μL的cDNA,8.5μL的双蒸水,按以下程序进行PCR扩增:预变性(1min,95℃),紧接着为40个循环扩增(分别为95℃下15s,58℃下20s,72℃下20s),最后再以72℃持续5min后以每20s升温1℃的速度进行溶解。以2-△△Ct法计算结果。RT-PCR所用引物序列见表1。
3 统计学分析
结 果
1 大鼠骨髓间充质干细胞(BMSCs)的体外分离、纯化、培养及鉴定
所分离的细胞72h后在光镜下观察时可见呈纺锤状或梭形,伪足明显(见图1a)。继续换液观察,见纺锤状细胞逐渐形成集落,呈簇状生长。10d后类似于成纤维细胞,细胞间隙变小,形成漩涡状(见图1b)。免疫荧光染色显示,在所提取细胞核内,Oct4及Klf4呈强阳性表达,提示所提取细胞具有干细胞多能分化的特性(图1c)。

表1 RT-PCR所用引物序列
注:引物由Invitrogen Biotechnology Co.,LTD中国公司合成
2 Wnt3a诱导 BMSCs的定向分化
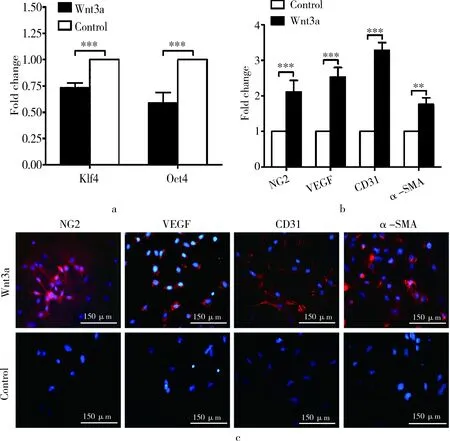
RT-PCR的结果显示,Wnt3a组在加入Wnt3a激动剂培养7d以后,BMSCs的干细胞相关分子Klf4,Oct4表达水平相比对照组有相应下降(0.732±0.048,0.591±0.097,倍比数,P<0.001)(图2a),证实BMSCs发生了相应的分化行为,一定比例的干细胞分化成为体细胞。进一步研究发现,代表周细胞、血管内皮细胞及血管平滑肌细胞的标志物-NG2、VEGF、CD31及α-SMA在Wnt3a作用下mRNA表达水平明显增高(图2b)。免疫荧光染色的结果与RT-PCR一致(图2c)。
3 Wnt3a联合BMSCs移植修复皮肤创面的动物创面大体观察和组织病理学检测
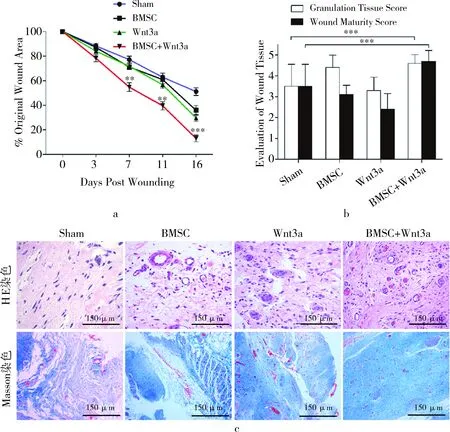
运用单因素方差分析统计,笔者发现术后第16天,BMSCs+Wnt3a组大鼠伤口创面愈合率为(87.05±1.93)%,远优于假手术组(48.88±3.62)%,差异有显著统计学意义(P<0.001)(图3a,图4g)。
为观察BMSCs/+Wnt3a移植后对皮肤伤口修复过程中创面肉芽组织再生和胶原沉积情况,笔者运用组织病理学方法(HE染色,Masson三色染色法)观察伤口情况。结果显示,在第16天,BMSC+Wnt3a移植大鼠伤口创面显示出生长良好的肉芽组织,以丰富的血管组织及周围的胶原纤维为标志,且胶原排列整齐,叠加有序。与之相比,假手术组中则仅能观察到少数肉芽组织和疏松的结缔组织(图3c)。
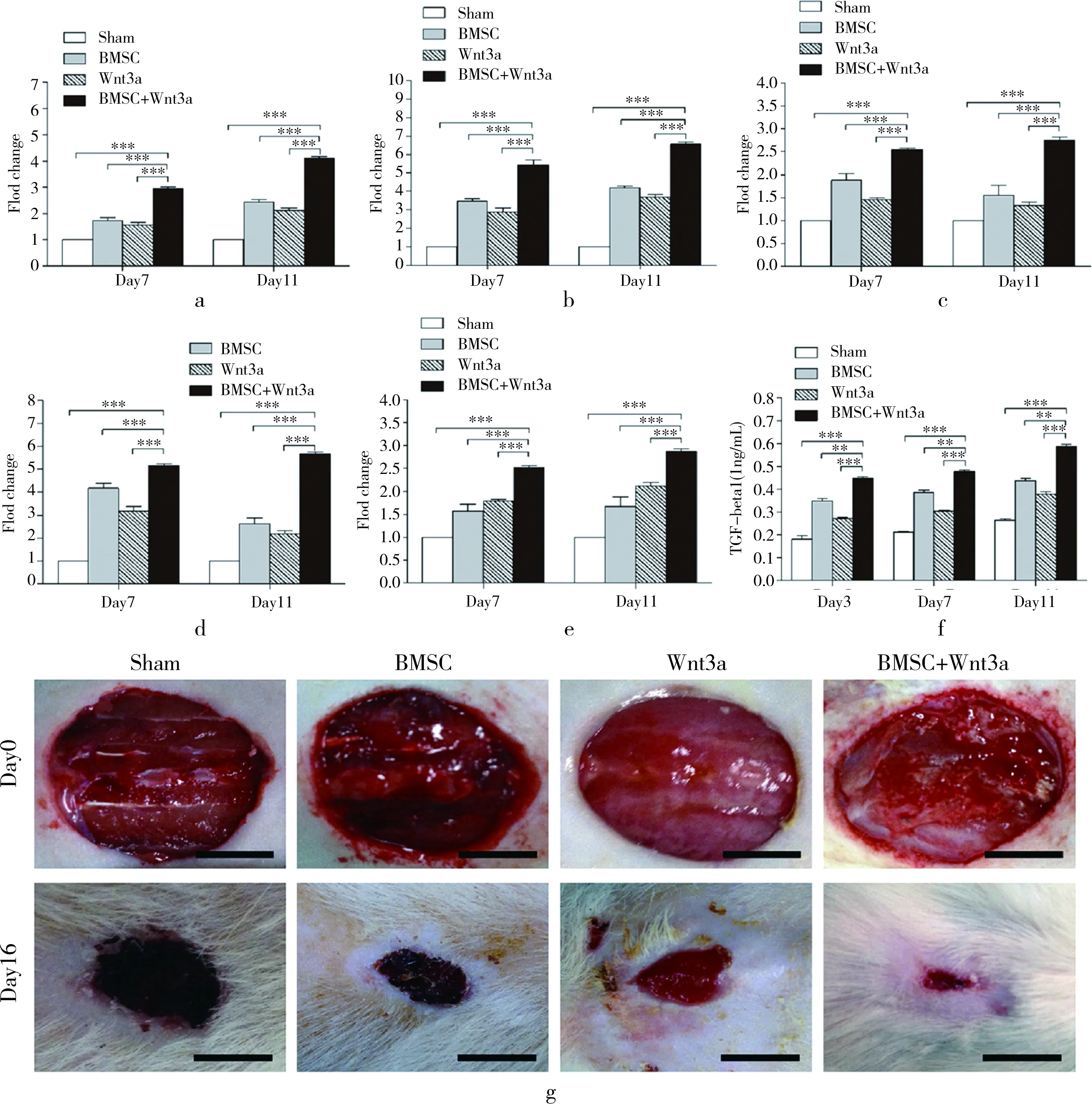
慢性伤口由于多种原因造成的病理过程可产生过度的炎性环境,尤其是中性粒细胞/及高含量的基质金属蛋白酶的存在,引起伤口修复过程中产生的新生胶原蛋白分解,而PDGF(血小板源性生长因子)的存在能够缓解及抑制上述病理过程的发生发展,从而促进创面愈合[9]。因此,笔者对创面促血管化因子PDGF的mRNA表达进行了检测,结果表明BMSCs/Wnt3a组大鼠创面PDGF的基因表达水平明显高于其余3组(P<0.001,图4a)。本研究运用分子生物学的方法观察术后第7及第11天,各组大鼠伤口创面血管化相关指标(NG2,CD31,VEGF,α-SMA)的mRNA水平。与前述结果类似,BMSCs/Wnt3a联合治疗后大鼠在各时间点的上述指标表达水平均明显高于假手术组(P<0.001)( 图4b~e)。除此之外,作为创面血管化的始动因子,BMSCs/Wnt3a联合治疗后大鼠创面TGF-β1的含量在各时间点均高于其余3组(P<0.001)(图4f)。
讨 论
目前已有诸多研究结果证实骨髓间充质干细胞(BMSCs)在皮肤创面的血管化再生中扮演着重要角色[4]。理想状态下,当皮肤伤口形成后,机体将动员自身MSCs进入血液循环,归巢于皮肤伤口创面,并分化为创面修复所需的目标细胞[10]。但临床上能够真正迁徙至创面的内源性MSCs实际上十分有限。因此,许多学者开始研究将外源性干细胞,或者将自体骨髓干细胞提取后体外扩增再回植于创面,并取得一定效果[11]。本实验即采用经典且简单有效的全骨髓贴壁法分离BMSCs,可见BMSCs成簇状集团式贴壁生长,随着时间推移细胞胞体逐渐两极化,呈梭形生长,为BMSCs早期典型形态。这表明全骨髓贴壁分离法对BMSCs的生长状态影响较小,与既往已有报道吻合[12]。此外,骨髓间充质干细胞具有干细胞的多能分化特性,可定向分化为一些组织和器官细胞,其细胞核高表达干细胞相关标志物(Oct4,Klf4,Nanog等)[13]。本实验运用免疫荧光染色技术对所提取的细胞爬片后进行染色,结果表明细胞核内高表干细胞多能性相关标志物Oct4及Klf4,进一步证实所提取细胞为骨髓来源的间充质干细胞。
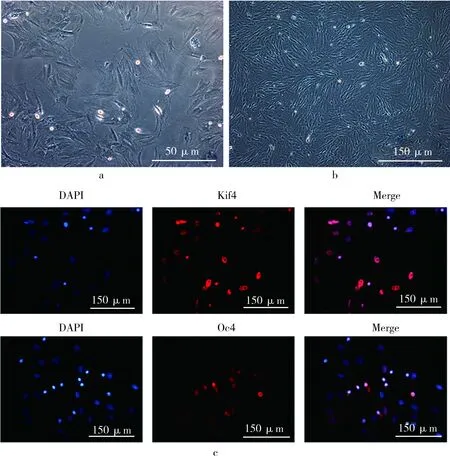
图1 骨髓间充质干细胞的形态学观察及鉴定结果。a.72h后BMSCs贴壁生长情况(×100);b.10d后BMSCs贴壁生长情况(×100);c.免疫荧光染色证实所提取细胞细胞核内高表达干细胞多能性相关标记物Oct4及Klf4(×100)
**P<0.01,***P<0.001
图2 Wnt3a诱导BMSCs定向分化的体外实验。a.RT-PCR结果显示Wnt3a诱导后BMSCs的多能干细胞相关标记物Oct4以及Klf4的mRNA水平较对照组(普通培养)有明显下降(P<0.001);b、c.分别显示运用RT-PCR以及免疫荧光染色观察三维培养下BMSCs的定向分化情况以及相关特异性标记物的mRNA水平及蛋白表达情况(×100)
BMSC+Wnt3a组大鼠与假手术组相比:**P<0.01,***P<0.001
图3 各组大鼠术后创面修复病理学观察。a.伤口愈合曲线证实BMSC+Wnt3a联合应用组大鼠伤口愈合优于其余三组;b.各组大鼠肉芽组织形成及创面成熟度评分;c.HE染色、Masson三色染色显示术后第11天各组大鼠创面肉芽组织形成及血管再生情况(×100)
**P<0.01,***P<0.001。标尺=0.8cm
图4 各组大鼠术后创面血管化再生指标观察。a~e.RT-PCR观察各组大鼠术后第7、11天PDGF、NG2、α-SMA、CD31以及VEGF的mRNA水平;f.ELISA法检测创面第3、7、11天TGF-β含量对比;g.各组大鼠在手术当日及手术后第16天皮肤伤口的大体照片
临床上,仅仅提高BMSCs在创面的移植率是不够的,远不足以发挥其特有的再生修复特性。创面修复中,创面血管化是关键的步骤。其包括血管芽生和初始血管的重排,由此引起壁细胞的定植和活化(在小血管中为周细胞,大血管中为血管平滑肌细胞)[14]。另一方面,血管内皮细胞和壁细胞之间的相互作用也对微血管的稳定至关重要,从而进一步影响伤口后期血管的成熟[14]。由此可见,周细胞、血管内皮细胞以及血管平滑肌细胞在创面血管化中扮演了重要作用。故BMSCs在移植后如何定向分化为上述关键细胞,将是BMSCs在皮肤伤口修复应用中的关键所在。
近年来研究发现,Wnt信号通路对干细胞分化、细胞增殖及生长有重要的调节作用[15]。经典Wnt 通路信号因子包括Wnt1、Wnt3a 和Wnt8a等,可通过调控β连环蛋白(β-catenin)的水平发挥其生理作用,最终激活β-Catenin进入细胞核内激活下游相关靶基因的转录[16]。有报道证实,Wnt3a蛋白能够促进骨髓间充质干细胞的增殖,但会抑制其向软骨细胞的分化[17];另有研究指出,小剂量(10μg/L)Wnt3a能在bFGF存在的情况下诱导MSC向神经元细胞方向分化[18]。在体外实验中,笔者运用大剂量Wnt3a蛋白(200μg/L)加入培养基,在7d诱导培养之后发现,代表周细胞、血管内皮细胞及血管平滑肌细胞的标志物——NG2、VEGF、CD31及α-SMA的mRNA表达水平明显增高,免疫荧光染色显示上述标志物在细胞质内高表达,证实BMSC发生了相应的定向分化。笔者分析,这与大剂量Wnt3a蛋白激活了经典Wnt信号途径,并诱导β-Catenin进入细胞核内,从而激活相关下游靶基因的转录有关,这与Fan等[19]的研究结果一致,即经典的Wnt信号通路能够与非经典的Wnt信号通路相互作用,最终实现干细胞向体细胞的定向分化。
随后,笔者在大鼠全层皮肤缺损的动物模型上联合应用BMSCs与Wnt3a蛋白,结果发现代表两者联合应用能够显著缩短创面愈合时间,促进伤口肉芽组织的再生与成熟。不仅如此,笔者首次发现BMSC与Wnt3a联合应用组大鼠创面新生血管的生成速度明显高于对照组,且创面PDGF及TGF-β的mRNA水平明显升高,这反映了创面血管的成熟化加速,由此大大促进了肉芽组织再生及伤口重建。这一发现对临床上复杂性及难愈性创面的干细胞治疗具有重要意义。
综上所述,笔者的实验结果发现,大鼠骨髓间充质干细胞在大剂量Wnt信号通路激动剂(Wnt3a蛋白)的诱导下,具有定向分化为皮肤创面修复所需关键细胞的作用,在此过程中,经典的Wnt信号通路被激活,与非经典的Wnt信号通路相互作用,最终实现干细胞向体细胞的定向分化。本实验结果不仅有助于提高临床上外源性间充质干细胞移植修复创面的存活率,还可为干细胞定向分化促进创面愈合与修复提供新的治疗思路。相对于传统纱布包扎及换药而言,此联合疗法具有省时,简单易行,有效的优点,具有十分重要的临床意义。
参考文献:
[1] Kanda N,Morimoto N,Ayvazyan AA,et al.Evaluation of a novel collagen-gelatin scaffold for achieving the sustained release of basic fibroblast growth factor in a diabetic mouse model[J].J Tissue Eng Regen Med, 2014,8(1):29-40.
[2] Pirila E,Korpi JT,Korkiamaki T,et al.Collagenase-2 (MMP-8) and matrilysin-2 (MMP-26) expression in human wounds of different etiologies[J].Wound Repair Regen,2007,15(1):47-57.
[3] Zhao S,Li L,Wang H,et al.Wound dressings composed of copper-doped borate bioactive glass microfibers stimulate angiogenesis and heal full-thickness skin defects in a rodent model[J].Biomaterials,2015,53:379-391.
[4] Wu Y,Zhao RC,Tredget EE.Concise review: bone marrow-derived stem/progenitor cells in cutaneous repair andregeneration[J].Stem Cells,2010,28(5):905-915.
[5] Ramos TV,Wang T,Maki CB,et al.Adipose stem cell side population in the mouse[J].J Tissue Eng Regen Med,2009,3(6):430.
[6] Qi W,Yang C,Dai Z,et al.High levels of pigment epithelium-derived factor in diabetes impair wound healing through suppression of Wnt signaling[J].Diabetes,2015,64(4):1407-1419.
[7] McBride JD,Menocal-Rodriguez L,Candanedo A,et al.Bone marrow mesenchymal stem cell-derived CD63+ exosomes transport Wnt3a exteriorly and enhance dermal fibroblast proliferation,migration and angiogenesis in vitro[J].Stem Cells Dev,2017,26(19):1384-1398.
[8] Shen J,Chen X,Jia H,et al.Effects of WNT3A and WNT16 on the osteogenic and adipogenic differentiation of perivascular stem/stromal cells[J].Tissue Eng Part A,2018,24(1-2):68-80.
[9] Wilkes RP,McNulty AK,Feeley TD,et al.Bioreactor for application of subatmospheric pressure to three-dimensional cell culture[J].Tissue Eng,2007,13(12):3003-3010.
[10] Badiavas EV,Falanga V.Treatment of chronic wounds with bone marrow-derived cells[J].Arch Dermatol,2003,139(4):510-6.
[11] Bauer SM,Goldstein LJ,Bauer RJ,et al.The bone marrow-derived endothelial progenitor cell response is impaired in delayed wound healing from ischemia[J].J Vasc Surg,2006,43(1):134-41.
[12] Friedenstein A,Piatetzky-Shapiro I,Petrakova K.Osteogenesis in transplants of bone marrow cells[J].Development,1966,16(3):381-390.
[13] Rustad KC,Wong VW,Sorkin M,et al.Enhancement of mesenchymal stem cell angiogenic capacity and stemness by a biomimetic hydrogel scaffold[J].Biomaterials,2012,33(1):80-90.
[14] Shea TM,Laun J,Gonzalez-Blohm SA,et al.Designs and techniques that improve the pullout strength of pedicle screws in osteoporotic vertebrae: current status[J].Biomed Res Int,2014,2014:748393.
[15] Ring A,Kim YM,Kahn M.Wnt/catenin signaling in adult stem cell physiology and disease[J].Stem Cell Rev,2014,10(4):512-525.
[16] Nusse R.Wnt signaling and stem cell control[J].Cell Res,2008,18(5):523-527.
[17] Nalesso G,Sherwood J,Bertrand J,et al.WNT-3A modulates articular chondrocyte phenotype by activating both canonical and noncanonical pathways[J].J Cell Biol,2011,193(3):551-564.
[18] Yue W,Yan F,Zhang YL,et al.Differentiation of Rat bone marrow mesenchymal stem cells into neuron-like cells in vitro and co-cultured with biological scaffold as transplantation carrier[J].Med Sci Monit,2016,22:1766-1772.
[19] Fan J,Wei Q,Liao J,et al.Noncanonical Wnt signaling plays an important role in modulating canonical Wnt-regulated stemness,proliferation and terminal differentiation of hepatic progenitors[J].Oncotarget,2017,8(16):27105-27119.

