冬凌草甲素联合顺铂对宫颈癌SiHa细胞凋亡及FOXL2、Ki67表达的影响
王彦秋
0 引言
宫颈癌(Cervical cancer)是发生于女性生殖器的一种恶性肿瘤,其中85%的宫颈癌患者分布在发展中国家,严重威胁女性生命安全[1]。目前,治疗宫颈癌的主要方法是手术清除辅以放化疗治疗,顺铂(Cisplatin,DDP)是常用的化疗药物之一[2]。近年研究发现,某些宫颈癌患者易对顺铂产生耐药性[3]。冬凌草甲素(Oridonin,ORI)因其具有调节免疫、抗氧化、抗炎症等药理活性[4],已作为一种抗肿瘤中药应用于乳腺癌[5]、肺癌[6]等恶性肿瘤的治疗。目前,尚未见关于联合采用冬凌草甲素、顺铂治疗宫颈癌的相关研究。因此,本研究通过观察冬凌草甲素、顺铂联合用药对宫颈癌SiHa细胞凋亡的影响,探讨其机制,试图为临床治疗宫颈癌提供新思路。
1 材料与方法
1.1 材料
1.1.1 细胞 人宫颈癌SiHa细胞,购自中科院上海细胞库。
1.1.2 主要试剂与仪器 冬凌草甲素(纯度>98%),购自上海麦克林生化科技有限公司;顺铂注射液,购自江苏豪森药业公司,批准文号:H20040813;DMSO、DMEM培养基、链霉素、青霉素,购自美国Sigma公司;AnnexinV-FITC/PI细胞凋亡双染试剂盒、MTT试剂盒,购自碧云天公司;96孔板(Bio-Rad);反转试剂盒、Trizol试剂、反转录试剂、SYBR®Premix Ex TaqTMⅡ(Tli RNaseH Plus),购自日本Takara公司;蛋白裂解buffer;BCA试剂盒,购自美国Thermo公司;抗体,购自美国CST公司。CO2培养箱;日本Sanyo公司;Elx800酶标仪,购自Bio-Rad公司;Thermal Cycler Dice Real Time System,购自日本Takara公司;荧光显微镜,购自美国Olympus公司。
1.2 方法
1.2.1 细胞培养 人宫颈癌SiHa细胞系,加入DMEM培养基(含15%胎牛血清)进行培养,加入链霉素(100 μg/mL)和青霉素(100 U/mL)防止细菌污染,于CO2培养箱(5% CO2,37 ℃)进行培养,所有操作在无菌条件进行,收集进入对数生长期的细胞进行后续实验。
1.2.2 MTT实验检测SiHa细胞增殖情况 采用MTT实验对冬凌草甲素和顺铂单独作用SiHa细胞增殖情况进行检测。将对数期SiHa细胞(1.0×105个/孔)接种至96孔板,培养24 h后分别加入冬凌草甲素(4、8、16、32、64 μg/mL)、顺铂(1、2、4、8、16 μg/mL)处理SiHa细胞,同时设置冬凌草甲素空白对照组(加入等量0.1% DMSO)和顺铂空白对照组(加入等量0.9%生理盐水)。分别在作用12、24、36、48、60、72 h后,收集细胞,按照MTT试剂盒说明书进行操作,使用全自动酶标仪检测570 nm波长下各孔细胞吸光值(OD)。计算不同药物浓度对SiHa细胞的生长抑制率。细胞生长抑制率(%)=(1-药物处理组吸光值/对照组吸光值)×100%。每个浓度设置4个重复,实验重复3次。
1.2.3 MTT实验检测冬凌草甲素联合顺铂作用SiHa细胞增殖情况 根据“1.2.2”项所得细胞生长抑制率曲线,结合临床冬凌草甲素和顺铂的使用剂量,选择冬凌草甲素的最适用药浓度:32 μg/mL;顺铂的最适用药浓度:4 μg/mL。将对数期SiHa细胞(3.0×105个/孔)接种至96孔板,培养24 h后将SiHa细胞分为4组:对照组(0.1% DMSO)、冬凌草甲素组(32 μg/mL)、顺铂组(4 μg/mL)、冬凌草甲素联合顺铂组,分别加入相应药物,作用48 h后收集细胞,按照“1.2.2”项方法,计算不同药物对SiHa细胞的生长抑制率。细胞增殖率(%)=药物处理组吸光值/对照组吸光值×100%,每组设置4个重复,实验重复3次。
1.2.4 流式AnnexinV-FITC/PI双标法检测宫颈癌SiHa细胞凋亡情况 收集冬凌草甲素、顺铂单独或联合处理的SiHa细胞(参见“1.2.3”项),严格按照AnnexinV-FITC/PI细胞凋亡双染试剂盒说明书,逐步进行操作,利用流式细胞仪进行检测,采用BD FACSDiva Software对试验结果进行采集并分析。每组设置4个重复,实验重复3次。
1.2.5 Hoechest33258染色法检测细胞凋亡 收集冬凌草甲素、顺铂单独或联合处理的SiHa细胞(参见“1.2.3”项),按照Hoechest33258荧光染色法说明进行操作,置于荧光显微镜下观察SiHa细胞形态。在340 nm激光下,活细胞呈均匀弥散蓝色荧光,凋亡细胞核或细胞质内可见浓染致密的颗粒块状荧光。
1.2.6 qRT-PCR检测宫颈癌SiHa细胞FOXL2、Ki67 mRNA水平 收集冬凌草甲素、顺铂单独用药和联合用药处理的细胞(参见“1.2.3”项),Trizol法提取总RNA,并检测其浓度和质量。按照反转录试剂盒说明,反转录合成cDNA。FOXL2、Ki67 mRNA表达水平按照SYBR®Premix Ex TaqTMⅡ(Tli RNaseH Plus)操作说明,在Takara荧光定量PCR仪上进行检测。反应体系总体积10 μL∶cDNA模板(50 ng/μL)1 μL,正反向引物(10 μmol/L)各0.5 μL,SYBR®Premix Ex TaqTMⅡ 6 μL,dH2O 2 μL。按反应条件进行扩增:95 ℃,3 min;95 ℃,10 s;60 ℃,20 s;72 ℃,20 s;40个循环。扩增标准曲线结果显示,R2≥0.98,扩增效率0.95~1.1,表明引物扩增效率高且特异性符合标准。每个浓度做3个重复。采用2-ΔΔCT法,对qRT-PCR结果进行表达差异分析。FOXL2、Ki67及内参基因GAPDH qRT-PCR引物,如表1所示。

表1 FOXL2、Ki67、GAPDH qRT-PCR引物
1.2.7 Western blot检测宫颈癌SiHa细胞FOXL2、Ki67蛋白水平 收集冬凌草甲素、顺铂单独用药和联合用药处理的细胞(参见“1.2.3”项),加入蛋白裂解buffer(含有protease inhibitor Cocktail),提取各组细胞总蛋白。采用BCA蛋白试剂盒对细胞中总蛋白含量进行测定。以GAPDH蛋白表达水平作为内参,采用Western blot对细胞中FOXL2、Ki67蛋白水平进行检测。采用Tanon 6100图像分析系统对Western结果拍照并进行定量分析。

2 结果
2.1 冬凌草甲素、顺铂单独用药对SiHa细胞增殖的影响 与对照组比较,16、32、64 μg/mL冬凌草甲素能显著抑制SiHa细胞增殖,32 μg/mL冬凌草甲素作用SiHa细胞48 h,对细胞生长抑制率达52.7%±1.6%(见图1A)。与对照组比较,4、8、16 μg/mL顺铂均能显著抑制SiHa细胞增殖,8 μg/mL顺铂作用SiHa细胞,对细胞生长抑制率为50.9%±4.7%(见图1B)。据此,本研究选择冬凌草甲素32 μg/mL、顺铂4 μg/mL作用48 h,进行后续实验。
2.2 冬凌草甲素联合顺铂抑制SiHa细胞增殖 MTT法检测发现,冬凌草甲素联合顺铂组细胞增殖率为27.33%±4.98%,显著低于冬凌草甲素组55.00%±5.03%、顺铂组59.00%±5.77%、对照组102.30%±4.49%,差异有统计学意义(P<0.05);冬凌草甲素组、顺铂组细胞增殖率均明显低于对照组(P<0.05)(见图2)。根据活细胞数计算得出冬凌草甲素和顺铂CDI为0.01。

图1 冬凌草甲素、顺铂单独用药对SiHa细胞增殖的影响
注:与对照组比较,*P<0.05,**P<0.01;A.不同浓度冬凌草甲素对SiHa细胞增殖的影响,B.不同浓度顺铂对SiHa细胞增殖的影响
2.3 冬凌草甲素联合顺铂促进SiHa细胞凋亡 流式细胞仪检测结果见图3,冬凌草甲素联合顺铂组细胞凋亡率为31.47%±2.24%,显著高于冬凌草甲素组11.40%±1.01%、顺铂组19.30%±1.03%、对照组4.90%±0.87%,差异均有统计学意义(P<0.05);冬凌草甲素组、顺铂组细胞凋亡率均显著高于对照组(P<0.05)。

图2 冬凌草甲素联合顺铂用药对SiHa细胞增殖的影响
注:与对照组比较,*P<0.05;与冬凌草甲素组比较,#P<0.05;与顺铂组比较,△P<0.05
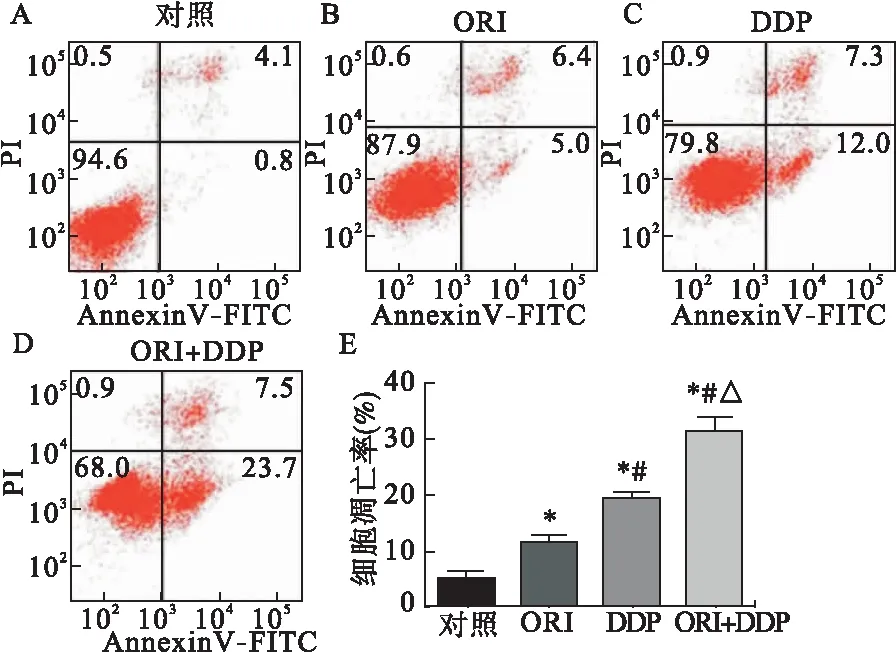
图3 冬凌草甲素联合顺铂用药对SiHa细胞凋亡的影响
注:A~D:流式AnnexinV-FITC/PI双标法检测各组细胞凋亡情况(A.对照组,B.冬凌草甲素组,C.顺铂组,D.冬凌草甲素联合顺铂组);E:冬凌草甲素、顺铂单独或联合用药,SiHa细胞凋亡情况定量分析。与对照组比较,*P<0.05;与冬凌草甲素组比较,#P<0.05;与顺铂组比较,△P<0.05
Hoechest33258染色结果可见,与对照组比较,冬凌草甲素组、顺铂组及冬凌草甲素联合顺铂组部分细胞出现细胞质固缩,细胞核碎裂(见图4),其中联合用药组中呈现凋亡状态的细胞数目显著多于单独用药组。
2.4 冬凌草甲素联合顺铂促进FOXL2 mRNA和蛋白表达 如图5所示,与对照组比较,冬凌草甲素组、顺铂组、冬凌草甲素联合顺铂组FOXL2 mRNA和蛋白水平均显著上调,差异有统计学意义(P<0.05);与冬凌草甲素组比较,冬凌草甲素联合顺铂组FOXL2 mRNA和蛋白水平显著升高(P<0.05);与顺铂组比较,冬凌草甲素联合顺铂组FOXL2 mRNA和蛋白水平显著升高(P<0.05)。

图4 SiHa细胞Hoechest33258荧光染色结果
2.5 冬凌草甲素联合顺铂抑制Ki67 mRNA和蛋白水平 与对照组比较,冬凌草甲素、顺铂单独及联合用药组Ki67 mRNA和蛋白水平均显著下调,差异有统计学意义(P<0.05);与冬凌草甲素组比较,联合用药组Ki67 mRNA和蛋白水平显著降低(P<0.05);与顺铂组比较,联合用药组Ki67 mRNA和蛋白水平显著下降(P<0.05)。见图6。

图5 冬凌草甲素联合顺铂用药对SiHa细胞FOXL2 mRNA和蛋白水平的影响

图6 冬凌草甲素联合顺铂用药对SiHa细胞Ki67 mRNA和蛋白水平的影响
3 讨论
随着国内外对宫颈癌诊治技术的不断改进和完善、宫颈癌发病趋于年轻化,使得保留患者生育能力的要求和可能性逐渐提高。因化疗在宫颈癌中取得的肯定疗效,现已逐渐成为综合治疗宫颈癌的重要手段之一[8]。本研究以宫颈癌SiHa细胞为研究材料,观察冬凌草甲素、顺铂联合用药对SiHa细胞凋亡的影响,并对冬凌草甲素联合顺铂作用后细胞中FOXL2、Ki67 表达水平进行检测,以揭示其作用机制,为冬凌草甲素、顺铂联合应用于宫颈癌的临床治疗提供一定理论依据。
冬凌草甲素是分离自唇形科植物冬凌草的一种天然萜类化合物,具有抗氧化、调节免疫、抗病毒等多种药理活性[9]。临床应用表明,冬凌草甲素对细胞的毒副作用小且不易产生耐药性。已有研究发现,冬凌草甲素对肿瘤具有很强的预防和治疗作用,能够抑制肝癌细胞[9]、结肠癌细胞[10]及肺腺癌细胞[11]等多种肿瘤细胞的增殖,促进其凋亡。Ma等[12]研究表明,冬凌草甲素能有效逆转人卵巢癌细胞对顺铂的耐药性,诱导卵巢癌细胞凋亡。He等[13]研究表明,冬凌草甲素也能逆转胃癌细胞对顺铂的耐药性,诱导细胞凋亡。本研究发现,与对照组和单独用药组比较,冬凌草联合顺铂作用宫颈癌SiHa细胞时,细胞增殖能力显著降低,凋亡能力显著升高。利用CDI对冬凌草甲素和顺铂相互作用的性质进行评价,根据CDI=两药联合组细胞吸光值/冬凌草甲素组细胞吸光值×顺铂组细胞吸光值,得到CDI为0.01[7],表明冬凌草甲素和顺铂作用性质为协同,且协同作用极显著。
FOXL2是一种近年来新发现的转录因子[14]。研究发现,FOXL2基因突变或异常表达与一些发育性疾病及卵巢颗粒细胞瘤[15-16]、垂体瘤[17]等恶性肿瘤的发生发展密切相关。研究发现,FOXL2基因能够抑制子宫内膜异位症的产生[18]。Liu等[19]研究表明,FOXL2基因在宫颈癌患者癌组织中异常高水平表达,且过表达FOXL2基因能够抑制宫颈癌细胞Hela的增殖,促进其凋亡。本研究发现,冬凌草甲素联合顺铂作用于宫颈癌SiHa细胞时,细胞中FOXL2基因mRNA和蛋白水平都明显上调,显著高于单独用药组和对照组。推测冬凌草甲素通过促进FOXL2基因上调表达,进一步加强顺铂对细胞增殖的抑制作用及其对细胞凋亡的促进作用,提示FOXL2在宫颈癌发生发展过程中可能作为抑癌基因发挥作用。
Ki67蛋白也称MKI67,与细胞增殖密切相关,定位于细胞核,可作为细胞增殖的可靠标记物[20]。已有研究表明,Ki67与乳腺癌[21]、胃癌[22]、宫颈癌[23]的发生发展及预后有关。已有研究发现,Ki67能作为结直肠癌[24]、乳腺癌[25]等恶性肿瘤的分子诊断标记。陈敏丽[26]研究发现,Ki67的表达在宫颈癌中显著增高,与脉管浸润及盆腔淋巴结转移呈现正相关。本研究发现,与对照组和单独用药组比较,冬凌草甲素联合顺铂组Ki67 mRNA和蛋白水平均显著下降。推测冬凌草甲素通过抑制Ki67表达,增强顺铂对细胞凋亡的促进作用。
综上所述,冬凌草甲素能够有效增强顺铂对宫颈癌SiHa细胞的促凋亡作用,推测其机制是通过上调抑癌基因FOXL2表达,下调Ki67表达,从而实现抑制细胞增殖、促进细胞凋亡的作用。这为冬凌草甲素、顺铂联合应用于治疗宫颈癌的临床推广提供了新依据。
参考文献:
[1] 周晖,卢淮武,彭永排,等.《2015年NCCN宫颈癌临床实践指南》解读[J] .中国实用妇科与产科杂志,2015,31(3):185-191.
[2] Leekha A,Gurjar BS,Tyagi A,et al.Vitamin C in synergism with cisplatin induces cell death in cervical cancer cells through altered redox cycling and p53 upregulation[J] .J Cancer Res Clin Oncol,2016,142(12):2503-2514.
[3] Aggarwal U,Goyal AK,Rath G.Development and characterization of the cisplatin loaded nanofibers for the treatment of cervical cancer[J] .Mater Sci Eng C Mater Biol Appl,2017,75:125-132.
[4] 李舒荃,沈灿,杨亚洋,等.冬凌草甲素抑制人胰腺癌细胞IL-1家族细胞因子表达的研究[J] .科技通报,2017,33(4):47-51,60.
[5] 齐琦,张配,李其响,等.冬凌草甲素诱导三阴乳腺癌MDA-MB-231细胞凋亡及对细胞内活性氧水平的影响[J] .中国中药杂志,2017,42(12):2361-2365.
[6] 柳悄然,张在云,于晓明,等.冬凌草甲素对人肺癌NCI-H460细胞侵袭和迁移的影响[J] .中国病理生理杂志,2014,30(8):1497-1500.
[7] 汤秀红,秦叔逵,陈惠英,等.三氧化二砷与顺铂合用抗人肝癌细胞株QGY-7701的实验研究[J] .肿瘤防治研究,2002,29(5):362-364.
[8] 刘畅.苦参碱及联合顺铂对宫颈癌SiHa细胞中TSLC1基因表达的影响[D] .兰州大学,2014.
[9] 郭文治,王冬雨,李功权,等.冬凌草甲素诱导肝癌细胞凋亡作用及其机制[J] .中华实验外科杂志,2015,32(9):2157-2159.
[10] 邵换璋,许隽颖,丁军利,等.冬凌草甲素抑制结肠癌细胞HT-29的作用及其机制[J] .中华实验外科杂志,2016,33(3):574-576.
[11] 王允,张玉媛,申玲.冬凌草甲素对肺腺癌A549细胞凋亡的影响及相关机制的研究[J] .毒理学杂志,2013,27(3):204-206.
[12] Ma S,Tan W,Du B,et al.Oridonin effectively reverses cisplatin drug resistance in human ovarian cancer cells via induction of cell apoptosis and inhibition of matrix metalloproteinase expression[J] .Mol Med Rep,2016,13(4):3342-3348.
[13] He Z,Xiao X,Li S,et al.Oridonin induces apoptosis and reverses drug resistance in cisplatin resistant human gastric cancer cells[J] .Oncol Lett,2017,14(2):2499-2504.
[14] Georges A,Auguste A,Bessière L,et al.FOXL2:a central transcription factor of the ovary[J] .J Mol Endocrinol,2014,52(1):R17-R33.
[15] Rosario R,Cohen PA,Shelling AN.The role of FOXL2 in the pathogenesis of adult ovarian granulosa cell tumours[J] .Gynecol Oncol,2014,133(2):382-387.
[16] Anttonen M,Pihlajoki M,Andersson N,et al.FOXL2,GATA4,and SMAD3 co-operatively modulate gene expression,cell viability and apoptosis in ovarian granulosa cell tumor cells[J] .PLoS One,2014,9(1):e85545.
[17] Chesnokova V,Zonis S,Wawrowsky K,et al.Clusterin and FOXL2 act concordantly to regulate pituitary gonadotroph adenoma growth[J] .Mol Endocrinol,2012,26(12):2092-2103.
[18] L′Hte D,Georges A,Todeschini AL,et al.Discovery of novel protein partners of the transcription factor FOXL2 provides insights into its physiopathological roles[J] .Hum Mol Genet,2012,21(14):3264-3274.
[19] Liu XL,Meng YH,Wang JL,et al.FOXL2 suppresses proliferation,invasion and promotes apoptosis of cervical cancer cells[J] .Int J Clin Exp Pathol,2014,7(4):1534-1543.
[20] Petrelli F,Viale G,Cabiddu M,et al.Prognostic value of different cut-off levels of Ki-67 in breast cancer:a systematic review and meta-analysis of 64,196 patients[J] .Breast Cancer Res Treat,2015,153(3):477-491.
[21] Elkablawy MA,Albasri AM,Mohammed RA,et al.Ki67 expression in breast cancer.Correlation with prognostic markers and clinicopathological parameters in Saudi patients[J] .Saudi Med J,2016,37(2):137-141.
[22] Li N,Deng W,Ma J,et al.Prognostic evaluation of Nanog,Oct4,Sox2,PCNA,Ki67 and E-cadherin expression in gastric cancer[J] .Med Oncol,2015,32(1):433.
[23] Kanthiya K,Khunnarong J,Tangjitgamol S,et al.Expression of the p16 and Ki67 in cervical squamous intraepithelial lesions and cancer[J] .Asian Pac J Cancer Prev,2016,17(7):3201-3206.
[24] Yang Y,Li J,Jin L,et al.Independent correlation between Ki67 index and circulating tumor cells in the diagnosis of colorectal cancer[J] .Anticancer Res,2017,37(8):4693-4700.
[25] Jalali C,Ghaderi B,Amini S,et al.Association of XRCC1 Trp194 allele with risk of breast cancer,and Ki67 protein status in breast tumor tissues[J] .Saudi Med J,2016,37(6):624-630.
[26] 陈敏利.VEGF和Ki67在宫颈鳞癌组织的表达及临床意义[D] .延安大学,2016.

