利用HRM技术快速筛选低镉烟草突变体
张超,张吉顺,王仁刚,曾吉凡,王自力,任学良,舒庆尧,武立权,赵海军
1 烟草行业分子遗传重点实验室,贵州省烟草科学研究院,贵州贵阳 550081;
2 浙江大学农业与生物技术学院,浙江杭州 310058;
3 安徽农业大学农学院,安徽合肥 230036
镉(Cd)是土壤和环境中毒性和生物迁移性最强的重金属元素之一,镉污染居我国土壤重金属污染首位[1]。据统计,全球约2.35 × 1012m2的耕地受到重金属污染,中国约有2.79 × 109m2的镉污染农田[2-3]。土壤中,即使极低浓度的镉也可被植物吸收富集,并通过食物链进入人体,进而损害肾脏、肺、心血管和肌肉骨骼系统的功能,严重危害人类健康[4]。
烟草是全球重要的经济作物之一,但相比其他农作物,烟草具有较强的Cd富集能力[5]。而烟草中的镉含量与烟气中镉含量相关性高,在卷烟燃烧过程中,烟叶中约有20%的镉进入烟气,约10%的镉可通过烟气进入人体肺部,危害人体健康[3,6-7]。此外,Cd做为植物生长非必需元素之一,土壤中较高浓度的Cd会影响烟草根系生长、叶绿体形成,进而影响其生物学产量,并通过抑制钾等元素的吸收影响烟叶品质等[8]。因此,降低烟叶中的Cd含量是近年来烟草科学研究的热点之一。相比土壤修复和烟草栽培方法改进等措施,选育低Cd烟草新品种可从源头上解决上述问题,日益受到烟草遗传育种研究人员的重视。
重金属转运ATP酶(HMA)参与植物体内重金属离子的吸收 转运。水稻OsHMA3基因控制根中Cd向液泡的运输,研究发现过表达OsHMA3基因可使Cd在根的液泡中沉积,从而减少地上部分中Cd的含量[9];OsHMA2基因主要在根中的维管束中表达,负责Cd和锌向根中木质部的装载和向水稻地上部分的转运,研究发现抑制OsHMA2基因的表达可降低水稻叶片和籽粒中的Cd含量[10]。拟南芥中AtHMA2和AtHMA4负责Cd和锌从根向地上部的运输[11]。烟草为异源四倍体,与AtHMA2和AtHMA4同源的两个基因,NtHMA4.1(NtHMAα)和NtHMA4.2(NtHMAβ),分别来自烟草两个祖先种林烟草(N. sylvestris)和绒毛状烟草(N. tomentosiformis),二者具有高达97%编码区核酸序列相似性,利用诱发突变技术获得的单、双基因突变烟叶和利用基因沉默技术获得的转基因烟叶中Cd含量大幅减少,降幅可高达90%[3-12]。NtHMA2(NtHMA4.1,NtHMAα)基因的无义突变导致云烟87 EMS诱变材料hma2-23叶片中镉含量相比野生型下降36.84%[12-13]。NtNrɑmp5(天然抗性相关巨噬细胞蛋白5)和NtNrɑmp1基因的等位变异分别导致相应的蛋白C端截短,引起烟叶中镉含量下降[14-15]。上述研究为低镉烟草种质筛选提供了理论与实践支持。
利用理化诱变技术创制新种质已成为作物育种的重要手段。其中,突变基因分子筛选是诱变育种的关键。针对烟草EMS等诱变群体,目前已经建立了一些突变基因筛选方法,如基于CELI核酸内切酶的TILLING[16]技术,基于变性凝胶电泳的SSLP检测[17],和近年新发展的基于高通量DNA测序的Seq-TILLING方法[18]。但上述方法耗时、耗力或成本较高,迫切需要建立一种简易、快速的烟草突变基因检测体系。
HRM(高熔解曲线分辨技术)是一种新兴分子诊断技术,其依据碱基序列不同导致核苷酸片段熔解温度不同的物理性质,在实时荧光定量PCR的基础上通过饱和染料监控核酸的熔解曲线变化来判断核苷酸片段性质[19]。HRM技术具有操作简单、PCR产物无需后处理(如酶切、电泳等)可直接闭管快速检测等优势,已在玉米、小麦、油菜等作物的突变位点扫描和基因分型等方面得到广泛应用[20-23]。但其在烟草突变基因检测方面迄今尚未见报道。
本研究以EMS诱变产生的贵烟1号烟草品种的M2代群体为筛选材料,以烟草Cd转运基因NtHMA4为目标基因,探讨了利用HRM技术筛选低Cd烟草突变材料的可行性,研究结果不仅为低Cd烟草新品种的选育提供理论和实践依据,同时也为烟草其他重要农艺性状的突变材料筛选提供技术借鉴。
1 材料与方法
1.1 诱变处理与材料种植
烟草品种贵烟1号用甲基磺酸乙酯(EMS)处理,半致死浓度为0.6%(V/V)。诱变处理流程大致如下:先将健康、饱满的烟草种子用蒸馏水浸泡20 h,然后用滤纸吸干水分,转移至含有0.6% EMS溶液的三角瓶中,用封口膜密封;26℃110 rpm转摇床震荡处理16 h;处理后的种子用预冷的pH 7.0的0.1 M磷酸缓冲液中浸泡冲洗,每隔10 min冲洗一次,共冲洗6次,流水冲洗3 h后晾干备用。所有试验材料播种于贵州省烟草科学研究院福泉基地,M1代单株编号,收获。M2代于按株行种植,每个株系10株,共计2020个株系。烟草田间常规种植管理。
1.2 样品采集及DNA提取
于烟草团棵期采集嫩叶,每株系取样6株,每3株叶片层叠后,利用打孔器获取等量叶片用于构建基因池,利用改良的CTAB法[24]提取烟草基因组DNA,终溶于适量TE缓冲液,用Nanodrop 2000紫外分光光度计(Thermo scientific,USA)测定每个样品DNA浓度,并以1%琼脂糖凝胶电泳检测DNA质量。将合格的DNA样本统一稀释至100 ng/μL,-20℃保存在96孔PCR板。
1.3 HRM检测NtHMA4基因突变体
参照NCBI数据库上公布的烟草NtHMA4基因序列(HF675181, HF937054),利用Primer Premier 5.0引物软件设计NtHMA4基因的HRM检测引物(表1),其中引物HMA4-1至HMA4-5来自Hermand[12],其余2对引物自行设计。引物均在上海生物工程有限公司合成。所有引物经PCR优化、测序验证后用于后续试验。
PCR 体系包括 5 μL的 2×Gene Solution master mix(上海硕盟生物科技有限公司),20×EvaGreen Dye(Biotium,Hayward,USA)0.5 μL,各 0.2 μL 的正、反向引物(10 μ mol/L)以及1 μL的模板DNA(~100 ng/μL),去离子无菌水补足至10 μL,最后加一滴矿物油防止溶液蒸发。PCR反应程序为:94℃预变性5min;94℃变性30s,根据表1中不同引物对应的退火温度退火30s,72℃延伸30s,40个循环;72℃终延伸7min;4℃保存。
PCR结束后,将PCR板短暂离心后直接用HRM检 测 仪 器 LightScanner96(Idaho Technology Inc.,USA)对PCR产物进行扫描。PCR产物以每秒0.1℃的速度从55℃加热至95℃,荧光信号强度随温度升高而发生变化形成熔解曲线,之后用LightScanner数据分析软件Call IT TM 2.0(Idaho Technology Inc.)根据操作说明分析数据。观察分析表示样本与对照(野生型)的荧光值相对差异(Δ Fluorescence,ΔF)的荧光变化曲线以及非标记探针分型的荧光值随温度变化的导数(-dF/dT)曲线。当荧光曲线峰值ΔF ≥ 0.05认为有明显的差异[25],筛选的突变材料3次重复验证。
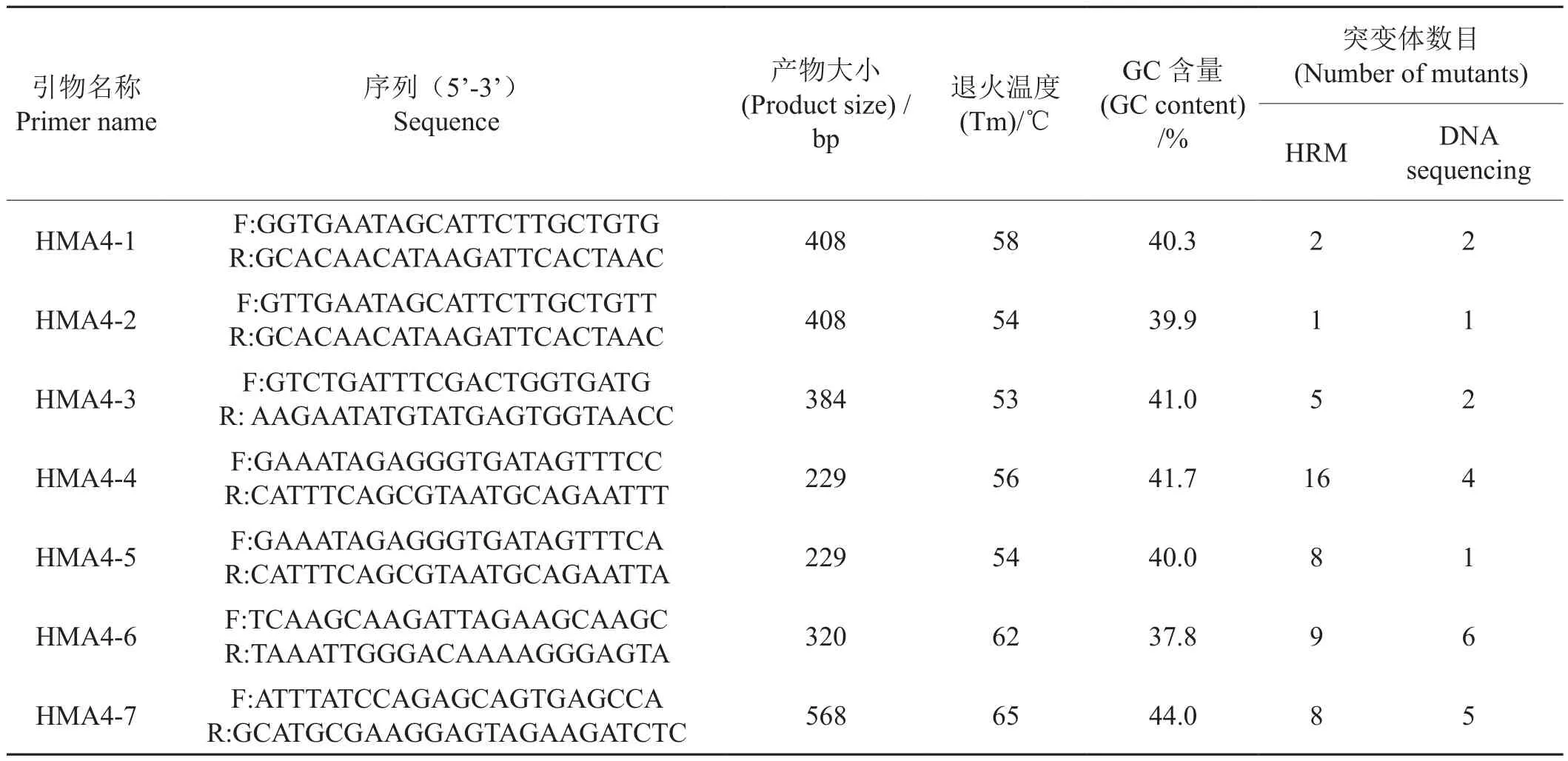
表1 用于NtHMA4基因突变材料筛选的引物信息Tab.1 Primers used for screening of the EMS population for mutations in NtHMA4
1.4 PCR产物的测序验证
筛选获得的HMA4基因候选突变材料,利用相应的引物,采用KOD高保真Taq酶(上海东洋纺生物科技有限公司)进行PCR反应,PCR反应体系及扩增程序参照产品说明书。PCR产物经1%琼脂糖凝胶电泳分离后,在凝胶紫外分析仪下用手术刀切割目的片段,并用AxyPrep凝胶回收试剂盒(杭州爱思进生物技术有限公司)回收纯化。纯化后的PCR产物送北京擎科生物公司测序。
1.5 突变材料的Cd含量测定
对11份镉含量待测材料(包括贵烟1号对照),挑选健康饱满的烟草种子,每份约50粒,消毒后播入灭菌后的泥炭/蛭石培养基质,在人工气候箱(白天28℃,光照14 h,光强1000 lux;黑夜20℃,10 h)培养至4到5叶期,选取生长一致的烟苗,移栽至7.5升长方形塑料盆中,于温室(白天16 h,光强800 lux;夜晚10 h,恒温25℃)中进行液体培养,营养液配方参照Hermand等(2014)[12],每3 d更换一次营养液。试验采用随机区组设计,3次重复。液体培养6周时,以终浓度1 mM CdCl2进行Cd处理,7 d后收集烟草植株,超纯水漂洗3次,分离烟草地上部分,120℃杀青处理10 min,50℃烘干48 h,样品采用组织研磨仪研磨成细粉,密封后4℃备用。
样品中二价Cd元素含量的测定参照Siemianowski等[26]方法进行,大致如下:称取0.1 g样品粉末置入消煮管,加入5 mL HNO3和1 mL H2O2,采用微波消解法消煮样品,过滤入50 mL离心管中,加超纯水定容到30 mL待测,采用ICP-MS(Elan 9000型号,Perkin Elmer Sciex, 加拿大)测定材料中的Cd含量,内标溶液浓度为1 μg/mL。3次生物学重复。
所有数据采用Excel 2010和SPSS 16.0进行统计和数据分析。
2 结果与分析
2.1 NtHMA4基因突变材料的HRM检测
EMS诱变处理后的贵烟1号M1单株收获后,M2代共移栽2020个株系,由于田间成活率等因素,对有6个单株以上的株系进行取样、编号、提取DNA、构建DNA池,最终获得3696个 DNA池。分别对7组NtHMA4基因的特异性引物进行PCR优化,然后对上述DNA池利用HRM进行突变基因的筛选,重复验证后,共获得49份NtHMA4基因疑似突变材料,部分突变材料的HRM熔解曲线见图1a。以野生型材料贵烟1号(组II)做为对照,可见96孔PCR板中的样品的HRM熔解曲线依据曲线类型不同可分为I、II、III 3个组。组I和III的HRM熔解曲线明显与组II曲线不同,为疑似基因突变材料。且组I与组III之间的熔解曲线类型也不相同,暗示其碱基突变类型和位点不同。
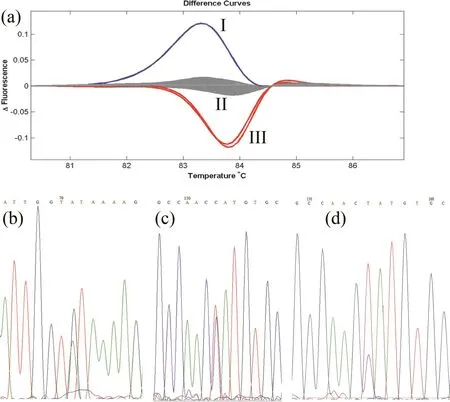
图1 鉴定烟草NtHMA4突变基因Fig.1 Identification of tobacco NtHMA4 mutation gene
2.2 突变基因的测序鉴定
对图1a中筛选获得的3份候选基因突变材料基因进行DNA测序,发现组I的碱基突变类型G/A(图1b),组III里的两个突变材料则为同一位点的C/T突变(图1c,d)。类似的,经过对上述49份候选突变材料逐一测序,发现共有21份材料为SNP突变,HRM检出假阳性为57.1%。这21个SNP突变包括G/A类型突变9例,C/T类型突变8例,A/G类型突变3例,G/T类型突变1例。经过生物信息学分析,21个SNP中有15个为错义突变,导致密码子翻译的氨基酸序列发生变化,其余6个则为同义突变(表2)。
2.3 NtHMA4基因突变材料M3代的跟踪检测与基因分型
表2中15份M2代错义突变株系中,有5份材料无法获得种子或种子不萌发。利用HRM检测方法跟踪检测其余10份M3家系,一方面跟踪确认M3代纯合单株用于后续Cd表型测定分析;另一方面利用HRM技术结合DNA测序对M3代NtHMA4基因杂合突变后代进行基因分型。

表2 NtHMA4基因突变材料的序列分析Tab.2 Sequence analysis of NtHMA4 mutations
如编号151的M3代株系内单株的HRM熔解曲线可分为3组类型(图2a),组I的曲线类型与对照野生型材料贵烟1号一致,组II曲线类型与杂合型突变曲线相仿,组III是一种新类型的曲线,推测应该为基因纯合突变类型。随后的DNA测序结果表明,所有组I类型的材料在SNP位点均为野生型GG纯合类型,组II则为杂合型突变GA类型,而组III则为AA类型纯合突变材料。类似的,编号953杂合突变后代的HRM基因分型与DNA测序结果表明(图2b),组I、II、III分别对应为野生型CC类型,CT杂合类型和TT纯合类型。且杂合型突变荧光曲线峰值ΔF值比纯合型突变材料高,ΔF值依次约为0.15,0.05。

图2 利用HRM对NtHMA4突变材料151(a)和953(b)的M3后代进行基因分型Fig.2 HRM analysis of M3 individual derived from NtHMA4 mutant materials 151(a) and 953 (b)
2.4 NtHMA4基因突变体的Cd表型分析
为明确上述10份NtHMA4基因纯合突变对Cd表型的影响,本研究利用ICP-MS比较分析了苗期Cd处理条件下,突变体与野生型之间的Cd含量变化。这10份材料Cd含量均比野生型贵烟1号下降,降幅在4.72%~42.08%之间。其中原始编号为953、709、151、546、1727、370、149、1099这 8份突变体材料的Cd含量与野生型贵阳1号存在显著性差异(P<0.05)。编号为953的突变材料Cd含量下降幅度最大(表3),最具有低Cd烟草育种的潜力。

表3 NtHMA4基因纯合突变材料叶片中的Cd含量Tab.3 Content of Cd in leaves of homozygous mutant of NtHMA4 gene
3 讨论
新种质资源是农作物新品种选育的基础,主要通过对自然资源库大规模的筛选,转基因和利用理化诱变创制突变体3种途径获得。但低Cd烟草资源在自然界中极其匮乏,转基因农作物尚有争论,转基因烟草暂时难以推广应用。突变体则成为基因功能鉴定、农作物种质创新和品种遗传改良的重要材料[27]。如何快速、高效筛选目标基因突变材料是遗传育种研究人员关注的焦点之一。相比其他EMS诱变群体检测方法,HRM主要有以下优点:1)操作简单、快速。PCR后直接放进HRM仪,仅需要15 min即可完成检测分析,而TILLING和SSLP等方法中的凝胶电泳检测则需耗费数小时。2)高通量。充分利用了96孔或384孔PCR板的优势,再结合PCR自动加样仪器,极大提高检测效率。但HRM需购买专门的HRM检测仪器,要一定的投资成本,检测过程中也需要使用饱和荧光染料。其单个样品3次重复检测成本约为Sanger测序的30%[23],随着检测技术和荧光染料的不断发展,HRM检测成本的不断下降将使得HRM在植物科学研究领域得到广泛应用。
HRM检测的敏感性与检出效率与引物的特异性、PCR产物的长度、GC含量、碱基组成、染料类型等因素相关[28]。因此, HRM技术筛选基因突变材料之前,必须首先对PCR体系进行优化,保证目的片段的特异性,检测片段在1 kb 以内,以100-400 bp最佳,片段GC含量适中40% ~60%[22,28]。虽然本研究预先对每对引物的HRM检测体系进行了优化,但筛选NtHMA4突变基因的7对引物的平均假阳性为57.1%,比其他报道较高[21-22],且假阳性主要集中在引物对HMA4-4和HMA4-5上(表1),但其GC含量、产物大小均符合HRM引物设计要求。HRM较高的假阳性通常与HRM检测体系相关,也可能是由于异源四倍体烟草相比水稻、拟南芥等模式作物具有较大的基因组和序列复杂性;此外,Gady等[29]的研究表明样品混合检测池中样本数目的多少也会影响假阳性,其具体原因仍需进一步研究。
NtHMA4.1和NtHMA4.2基因已在烟草中成功克隆,二者均主要在根中表达,负责锌和Cd从根向地上部分的转运[12]。本研究以烟草品种贵烟1号的EMS诱变后代为筛选材料,利用HRM技术筛选NtHMA4基因突变材料,并结合DNA测序,最终鉴定出21份NtHMA4基因突变纯合材料,包括15份引起氨基酸改变的错义突变材料,首次证实HRM技术可用于烟草基因突变材料的筛选检测。同时,跟踪分析突变杂合材料分离群体后代发现,根据突变材料的已知序列变化信息,HRM能快速准确的对其杂交后代或突变位点分离后代进行基因分型。因此,本研究结果不仅可加快烟草分子育种进程,也对筛选鉴定其他控制烟草重要农艺性状的基因突变材料提供了技术借鉴。
本研究共鉴定出10份低Cd烟草纯合突变体,水培试验Cd处理后的表型分析表明,相比野生型贵烟1号,突变体Cd含量下降幅度在4.72 % ~ 42.08 %之间,其中有8份材料相比贵烟1号野生型存在显著性差异(P<0.05),编号953材料下降幅度最大,这些材料为低Cd烟草新品种的的选育提供了较为丰富的种质资源。此外,在利用NtHMA4.1和NtHMA4.2基因的单突变材料杂交聚合获得的双突变纯合基因型材料中,通过表型鉴定有望获极端低Cd烟草材料。Hermand等[12]研究发现NtHMAα(NtHMA4.1)、NtHMAβ(NtHMA4.2)任何一个基因的纯合突变材料的烟叶中Cd和锌的含量均显著下降,这与本研究相符(表2,表3)。但Liedschulte等[3]的研究则发现单一NtHMA4.1或NtHMA4.2基因的纯合突变体相比野生型,锌含量下降但Cd含量无显著变化,只有NtHMA4.1、NtHMA4.2这两个基因同时发生突变后,其基因型纯合的双突变材料才具有低Cd、低锌的表现型,并推测这可能与材料种植环境相关。
此外,在NtHMA4基因突变获得低Cd表型的同时,也可能伴随有其他不良的农艺性状,如花粉活力下降、烟草长势缓慢等。本研究也发现苗期部分突变体相比野生型,叶片出现斑点,长势缓慢,这可能与NtHMA4基因同时参与烟草体内其他生物学功能相关,也可能是由于控制其他农艺性状的基因在E MS处理过程中也发生了突变,其原因有待进一步研究。将NtHMA4基因突变材料导入不同遗传背景的烟草材料,同时对不同位置的SNP突变或其他低镉材料[13]进行优化组合,结合HRM技术筛选,可望选育出具有应用价值的低Cd烟草新种质。
[1]YANG Yang, GE Yichen, ZENG Hongyuan, et al. Phytoextraction of cadmium-contaminated soil and potential of regenerated tobacco biomass for recovery of cadmium[J]. Scientific Reports, 2017, 7(1):7210.
[2]LIU Feng, LIU Xiangnan, DING Chao, et al. The dynamic simulation of rice growth parameters under cadmium stress with the assimilation of multi-period spectral indices and crop model[J].Field Crops Research, 2015, 183: 225-234.
[3]Liedschulte V, Laparra H, Battey J N, et al. Impairing bothHMA4homeologs is required for cadmium reduction in tobacco[J]. Plant,Cell & Environment, 2017, 40(3): 364-377.
[4]HU Yuanan, CHENG Hefa, TAO Shu. The Challenges and Solutions for Cadmium-contaminated Rice in China: A Critical Review[J]. Environment International, 2016, 92-93: 515-532.
[5]Mench M, Tancogne J, Gomez A, et al. Cadmium bioavailability to Nicotiana tabacum L.Nicotiɑnɑ rusticɑ L. ɑnd Zeɑ mɑys L.grown in soil amended or not amended with cadmium nitrate[J]. Biology& Fertility of Soils, 1989, 8(1): 48-53.
[6]周茂忠, 张悠金, 姚鹤鸣, 等. 卷烟主流烟气重金属迁移率与烟叶中重金属不同形态之间的关系研究[J]. 中国烟草学报, 2017,23(2): 1-12.ZHOU Maozhong, ZHANG Youjin, YAO Heming, et al. Study on relationships between occurrence forms of heavy metals in tocacco leaf and their migration ratios into mainstream cigarette smoke[J].Acta Tabacaria Sinica, 2017, 23(2): 1-12.
[7]Piadé J J, Jaccard G, Dolka C, et al. Differences in cadmium transfer from tobacco to cigarette smoke, compared to arsenic or lead[J]. Toxicology Reports, 2015, 2: 12-26.
[8]Tkalec M, Cvjetko P, Pavlica M, et al. The effects of cadmium-zinc interactions on biochemical responses in tobacco seedlings and adult plants[J]. PLOS ONE, 2014, 9(1): e87582.
[9]Miyadate H, Adachi S, Hiraizumi A, et al.OsHMA3, a P1B-type of ATPase affects root-to-shoot cadmium translocation in rice by mediating eラ ux into vacuoles[J]. New Phytologist, 2011, 189(1):190-199.
[10]Takahashi R, Ishimaru Y, Shimo H, et al. The OsHMA2 transporter is involved in root-to-shoot translocation of Zn and Cd in rice[J].Plant, Cell & Environment, 2012, 35(11): 1948-1957.
[11]Wong C K E, Cobbett C S. HMA P-type ATPases are the major mechanism for root-to-shoot Cd translocation inArɑbidopsis thɑliɑnɑ[J]. New Phytologist, 2009, 181(1): 71-78.
[12]Hermand V, Julio E, Dorlhac d B F, et al. Inactivation of two newly identified tobacco heavy metal ATPases leads to reduced Zn and Cd accumulation in shoots and reduced pollen germination[J].Metallomics, 2014, 6(8):1427-1440.
[13]高玉龙, 王丙武, 李文正, 等. 烟草镉转运基因突变体的鉴定和功能分析 [J], 烟草科技, 2017, 50 (9): 1-6.GAO Yulong, WANG Bingwu, LI Wenzheng, et al. Identification and functional analysis of a tobacco cadmium transporter gene mutant[J]. Tobacco Science & Technology, 2017, 50(9): 1-6.
[14]ZHONG Tang, CAI Hailin, LI Jie, et al. Allelic variation ofNtNrɑmp5associated with cultivar variation in cadmium accumulation in tobacco[J]. Plant Cell Physiology, 2017, 58(9):1583-1593.
[15]蔡海林, 李帆, 曾维爱, 等.NtNrɑmp1基因参与不同镉积累基因型烟草品种镉积累差异的功能解析[J], 中国烟草学报, 2017,23(4): 84-91.CAI Hailin, LI Fan, ZENG Weiai, et al. Functional analysis ofNtNrɑmp1participating in Cd accumulation in tobacco of different Cd accumulating genotypes[J]. Acta Tabacaria Sinica, 2017, 23(4):84-91.
[16]Till B J, Reynolds S H, Green E A, et al. Large-scale discovery of induced point mutations with high-throughput TILLING[J].Genome Research, 2003, 13(3): 524-530.
[17]Shirasawa K, Monna L, Kishitani S, et al. Single nucleotide polymorphisms in randomly selected genes amongjɑponicɑ rice(Oryzɑ sɑtivɑ L.) varieties identified by PCR-RF-SSCP[J]. DNA Research, 2004, 11(4): 275-283.
[18]Reddy T V, Dwivedi S, Sharma N K. Development of TILLING by sequencing platform towards enhanced leaf yield in tobacco[J].Industrial Crops & Products, 2012, 40(1): 324-335.
[19]Reed G H, Kent J O, Wittwer C T. High-resolution DNA melting analysis for simple and efficient molecular diagnostics[J].Pharmacogenomics, 2007, 8(6): 597-608.
[20]TAN Yuanyuan, FU Haowei, ZHAO Haijun, et al. Functional molecular markers and high-resolution melting curve analysis of low phytic acid mutations for marker-assisted selection in rice[J].Molecular Breeding, 2013, 31(3): 517-528.
[21]LI Yi-Dan, CHU Zhi-Zhan, LIU Xiang-Guo, et al. A cost-effective high-resolution melting approach using the EvaGreen dye for DNA polymorphism detection and genotyping in plants[J]. Journal of Integrative Plant Biology, 2010, 52(12): 1036-1042.
[22]Botticella E, Sestili F, Hernandez-Lopez A, et al. High resolution melting analysis for the detection of EMS induced mutations in wheatSBEIIɑgenes[J]. BMC Plant Biology, 2011, 11(1):156.
[23]Lochlainn S Ó, Stephen A, Graham N S, et al. High Resolution Melt (HRM) analysis is an effi cient tool to genotype EMS mutants in complex crop genomes[J]. Plant Methods, 2011, 7(1):1-9.
[24]卢扬江, 郑康乐. 提取水稻DNA的一种简易方法 [J].中国水稻科学, 1992, 6(1): 47-48.LU Yangjiang, ZHENG Kangle. A simple method for isolation of rice DNA[J], Chinese Journal of Rice Science, 1992, 6(1): 47-48.
[25]Hofinger B L, JING Hai-Chun, Hammond-Kosack K E, et al. Highresolution melting analysis of cDNA-derived PCR amplicons for rapid and cost-effective identification of novel alleles in barley[J],Theoretical and Applied Genetics, 2009, 119: 851-865.
[26]Siemianowski O, Barabasz A, Kendziorek M, et al.HMA4expression in tobacco reduces Cd accumulation due to the induction of the apoplastic barrier[J]. Journal of Experimental Botany, 2014,65(4): 1125-1139.
[27]刘贯山. 烟草基因组计划进展篇:2. 烟草突变体创制、筛选与鉴定 [J], 中国烟草科学, 2013, 34(2): 113-114.LIU Guanshan. Establishment, selection and identification of tobacco mutants[J], Chinese Tobacco Science, 2013, 34(2): 113-114.
[28]Reed G H, Wittwer C T. Sensitivity and specificity of singlenucleotide polymorphism scanning by high-resolution melting analysis[J]. Clinical Chemistry, 2004, 50(10), 1748-1754.
[29]Gady A L, Hermans F W, Wal M H V D, et al. Implementation of two high through-put techniques in a novel application: detecting point mutations in large EMS mutated plant populations[J]. Plant Methods, 2009, 5(1):13.

