解淀粉芽孢杆菌gfj-4发酵上清液及其混剂对番茄早疫病菌抑制活性研究
段海明,余 利,孙甜甜,黄伟东,余海兵
(安徽科技学院农学院,安徽 凤阳 233100)
番茄早疫病制约番茄生产[1]。该病害为茄链格孢菌(Alternaria solani)引起多循环病害,腐生性强,可随病残体在土壤中越冬,产生大量孢子随气流传播,适宜条件下连年发生,一般减产30%,严重可达50%以上。研究番茄早疫病高效防治具有重要意义[2-3]。
目前,番茄早疫病主要采取化学防治为主导病害控制模式,但化学农药过量、长期反复使用导致生态、抗性和食品安全问题,需更新传统病害防控方式,发展绿色环保防控新技术,降低化学药剂施用量[4]。生物防治和农药复配增效技术为化学农药减量施用重要措施[5]。杨蓉等筛选对番茄早疫病有显著抑制效果萎缩芽孢杆菌(Bacillus atrophaeus)和枯草芽孢杆菌(Bacillus subtilis),其发酵液对早疫病菌丝有显著致畸作用,相对防效达35%以上[6]。马桂珍等采用平板对峙法和打孔法测定1株多粘类芽孢杆菌L1-9菌株和无菌发酵液,培养4 d抑菌带宽分别为17.6和15.8 mm,无菌发酵液可显著降低孢子萌发率并抑制芽管伸长[7]。杨冬静等采用杯碟法测定枯草芽孢杆菌(Bacillus subtilis)NJ-18菌株对番茄早疫病菌菌丝生长有强烈拮抗作用,培养滤液使菌丝肿胀畸形[8]。目前,番茄早疫病生物防治相关研究主要以室内抑菌活性为主,由于生防菌防效慢、效果不稳定等因素导致其推广受限,难以实现田间大规模使用。通过查询农业部农药检定所网站农药登记数据库发现,防治番茄早疫病农药混配剂研发以两种化学杀菌剂间复配为主,微生物源活性物质和化学杀菌剂复配剂防治番茄早疫病研究未见报道。研究其混配组合防治作物病害对化学药剂减量增效具有重要价值[9]。
本研究对前期筛选出的一株对番茄早疫病菌有较强抑制活性解淀粉芽孢杆菌(Bacillus amyloliquefa⁃ciens)gfj-4,初步探究接种量、发酵培养时间对生防菌产抑菌活性物质影响及发酵上清液和脂肽粗提物抑菌活性,开展解淀粉芽孢杆菌gfj-4发酵上清液和化学杀菌剂复配研究,旨在为番茄早疫病防治提供新途径。
1 材料与方法
1.1 材料
1.1.1供试杀菌剂
95%苯醚甲环唑原药、96%腈菌唑原药分别购自山东亿嘉农化有限公司和山东联合农药工业有限公司;97%咪鲜胺原药和96%戊唑醇原药购自山东华阳农药化工有限公司;96%三唑酮原药和95%嘧菌酯原药购自山东潍坊润丰化工股份有限公司;95.7%丙环唑原油购自江苏丰登作物保护股份有限公司;97.5%吡唑醚菌酯原药购自青岛瀚生生物科技股份有限公司。杀菌剂原药采用丙酮溶解,配制1.0×104μg·mL-1母液置于4 ℃冰箱保存备用。
1.1.2供试菌株
番茄早疫病菌(A.solani)分离纯化自安徽省凤阳县郊区番茄早疫病典型发病叶片,分离纯培养。解淀粉芽孢杆菌(B.amyloliquefaciens)gfj-4于2014年9月24日保藏于中国典型培养物保藏中心(CCTCC NO:M 2014444),已获授权国家发明专利(ZL2014107885788)。
1.1.3供试培养基
PDA培养基:马铃薯200.0 g,葡萄糖18.0 g,琼脂15.0 g,去离子水1 L。
NA培养基:蛋白胨5.0 g,牛肉浸膏3.0 g,酵母膏1.0 g,葡萄糖10.0 g,琼脂15.0 g,pH 7.0(可不加琼脂制成NB培养基)。
1.2 方法
1.2.1解淀粉芽孢杆菌gfj-4生长曲线制作
参照文献[10]方法制作菌株gfj-4生长曲线,分别以 33 ℃、120 r·min-1振荡培养 3、4、6、8、10、12、14和16 h,测量菌体密度(OD600值)。
1.2.2不同接种量解淀粉芽孢杆菌gfj-4发酵上清液抑制番茄早疫病菌活性测定
解淀粉芽孢杆菌gfj-4在NA培养基上划线培养48 h,挑取单菌落菌苔转接入NB液体培养基中,33 ℃、120 r·min-1摇培12 h,以体积比(V/V)为10%接种量接种到NB培养基中,于33℃、120 r·min-1各培养8 h,培养结束以10 000 r·min-1、4℃离心10 min获得菌体,灭菌去离子水调节菌悬液OD600=1.0作为种子液,分别以0.125%、0.25%、0.50%、0.75%、1%和2%(V/V)接种量接种到100 mL NB培养基,然后以33 ℃、120 r·min-1摇培72 h,10 000 r·min-1、4℃离心20 min获取发酵上清液,经0.22 μm滤膜过滤后保存于4℃冰箱备用。采用菌丝生长速率法测定发酵上清液80倍稀释液对番茄早疫病菌抑制率,接种结束后置于26℃恒温恒湿培养箱中培养168 h,每一浓度处理3皿,重复3次,十字交叉法测量菌落直径,计算不同接种量发酵上清液病菌抑制率[11]。
1.2.3不同发酵培养时间发酵上清液抑制番茄早疫病菌活性测定
按照1.2.2方法获取种子液后以0.125%(V/V)接种量接入含100 mL NB发酵培养基250 mL三角瓶,分别以33 ℃、120 r·min-1摇培24、48、72、84、96和120 h,10 000 r·min-1、4 ℃离心20 min,获取发酵上清液后经0.22 μm滤膜过滤除菌后于4℃冰箱保存备用。计算不同发酵培养时间发酵上清液对番茄早疫病菌抑制率。
1.2.4不同稀释倍数发酵上清液对番茄早疫病菌抑制活性测定
将发酵培养时间为72 h发酵上清液按比例与50℃PDA培养基充分混匀,此时发酵上清液在PDA培养基中含量分别为1.56、3.13、4.17、6.25、10.0和12.5 μL·mL-1,测定不同稀释倍数发酵上清液对番茄早疫病菌抑制活性,SPSS 13.0软件计算发酵上清液对番茄早疫病菌EC50。
1.2.5脂肽粗提物制备及抑制活性测定
按照1.2.3方法摇培72 h离心获得发酵上清液,参照邓建良等脂肽粗提物制备方法,甲醇萃取3次,合并提取液备用[12]。脂肽粗提物按比例与50℃PDA培养基充分混匀,脂肽粗提物含量分别为0.50、0.625、0.833、1.25和2.50 μL·mL-1,测定不同稀释倍数脂肽粗提物对番茄早疫病菌抑制活性,计算脂肽粗提液对番茄早疫病菌EC50。
1.2.68种化学杀菌剂对番茄早疫病菌室内毒力测定
采用菌丝生长速率法测定咪鲜胺、苯醚甲环唑、丙环唑、吡唑醚菌酯、腈菌唑、戊唑醇、三唑酮和嘧菌酯8种化学杀菌剂对番茄早疫病菌抑制活性(见表1)[11]。接种完毕后置于26℃恒温恒湿培养箱中培养168 h,十字交叉法测量菌落直径。SPSS 13.0软件计算8种化学杀菌剂毒力回归方程、EC50、95%置信区间和R2。
1.2.7杀菌剂新型混剂毒性比率测定
采用陈福良等方法设计菌株gfj-4发酵上清液和化学杀菌剂混配试验,以发酵上清液和不同化学杀菌剂对番茄早疫病菌EC50为基础,按其EC50剂量比例分别设置0∶10、1∶9、2∶8、3∶7、4∶6、5∶5、6∶4,7∶3、8∶2、9∶1、10∶0计11个配比,以不加药剂处理为对照,采用菌丝生长速率法测定各配比抑菌率和毒性比[13]。
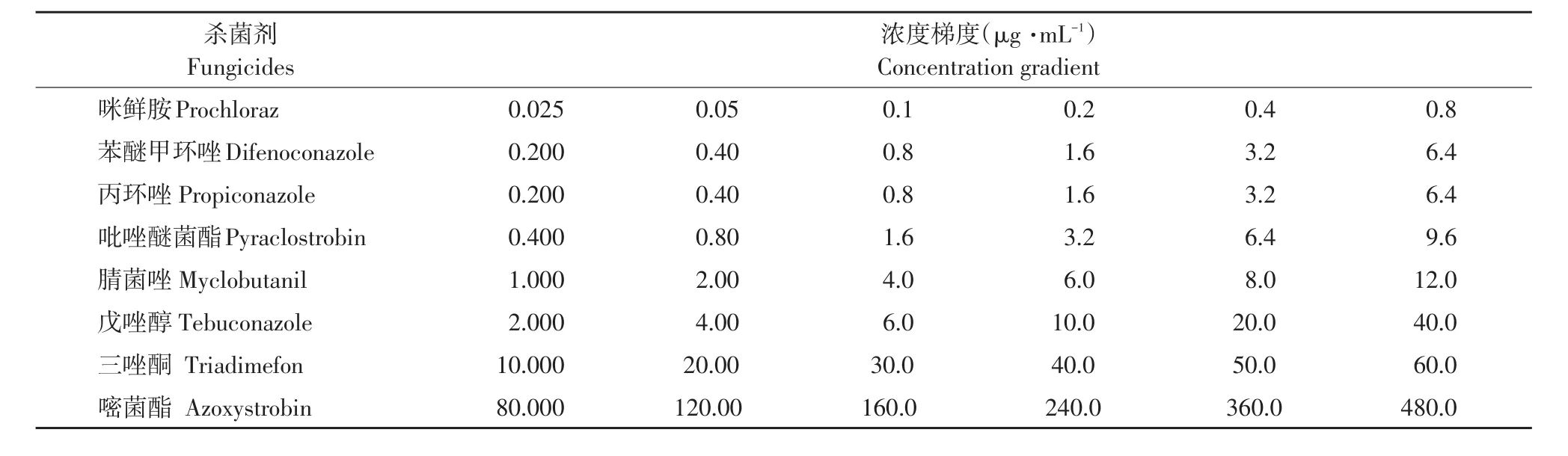
表1 8种化学杀菌剂浓度设置Table 1 Concentration gradient of eight fungicides
2 结果与分析
2.1 解淀粉芽孢杆菌gfj-4生长曲线
由图1可知,菌株gfj-4在3~4 h为延滞期,4~12 h为对数生长期,12~14 h为稳定期,14 h后进入衰退期。确定对数生长中期即培养8 h为后续研究种子液培养时间。
2.2 不同接种量种子液对解淀粉芽孢杆菌gfj-4发酵上清液抑菌活性影响
由图2可知,随菌株gfj-4种子液接种量增加,生防菌所产发酵上清液对番茄早疫病菌抑制率呈逐渐下降趋势。接种量(V/V)为0.125%和0.25%制得发酵上清液对病菌抑制率分别达78.57%和78.52%(P<0.05)。但接种量继续增加,菌株所产发酵上清液对病菌抑制率逐步下降,当接种量为2%时抑制率降至65.70%。
2.3 不同发酵培养时间对菌株gfj-4产发酵上清液抑制番茄早疫病菌影响
不同培养时间对菌株gfj-4发酵上清液抑菌活性影响见图3。

图1 解淀粉芽孢杆菌gfj-4生长曲线Fig.1 Growth curve of Bacillus amyloliquefaciens gfj-4

图2 不同接种量对菌株gfj-4发酵上清液抑菌活性影响Fig.2 Effects of different inoculation amount on antifungal activity of strain gfj-4 fermentation supernatant
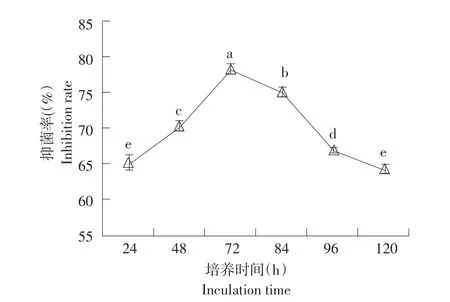
图3 不同培养时间对菌株gfj-4发酵上清液抑菌活性影响Fig.3 Effects of different culture time on antifungal activity of strain gfj-4 fermentation supernatant
由图3可知,随菌株gfj-4发酵培养时间延长,生防菌产发酵代谢活性物质对番茄早疫病菌抑制率先升后降。培养时间72 h时发酵上清液对病菌抑制率最大为78.50%(P<0.05)。培养时间继续增加,所产发酵上清液对病菌抑制率下降,培养时间为120 h时抑制率降至64.54%。
2.4 不同稀释倍数发酵上清液对番茄早疫病菌抑制活性的影响
由表2可知,解淀粉芽孢杆菌gfj-4发酵上清液浓度由1.56 μL·mL-1增至12.5 μL·mL-1,接种番茄早疫病菌培养168 h对病菌抑制率由22.0%增至78.6%,高浓度发酵液抑制效果较好。SPSS 13.0软件分析得出发酵上清液对番茄早疫病菌EC50为3.774 μL·mL-1(R2=0.94)。经解淀粉芽孢杆菌发酵上清液处理番茄早疫病菌丝扩展缓慢,生长稀疏,发酵上清液EC80浓度处理菌丝与对照相比可知,对照菌丝光滑,生长点较多,处理菌丝呈现扭曲、散乱的畸形状,原生质浓缩,出现色素沉积(见图4)。

表2 不同稀释倍数发酵上清液对番茄早疫病菌抑制率Table 2 Inhibition rate of different dilution times of B.amyloliquefaciens fermentation supernatant to A.solani
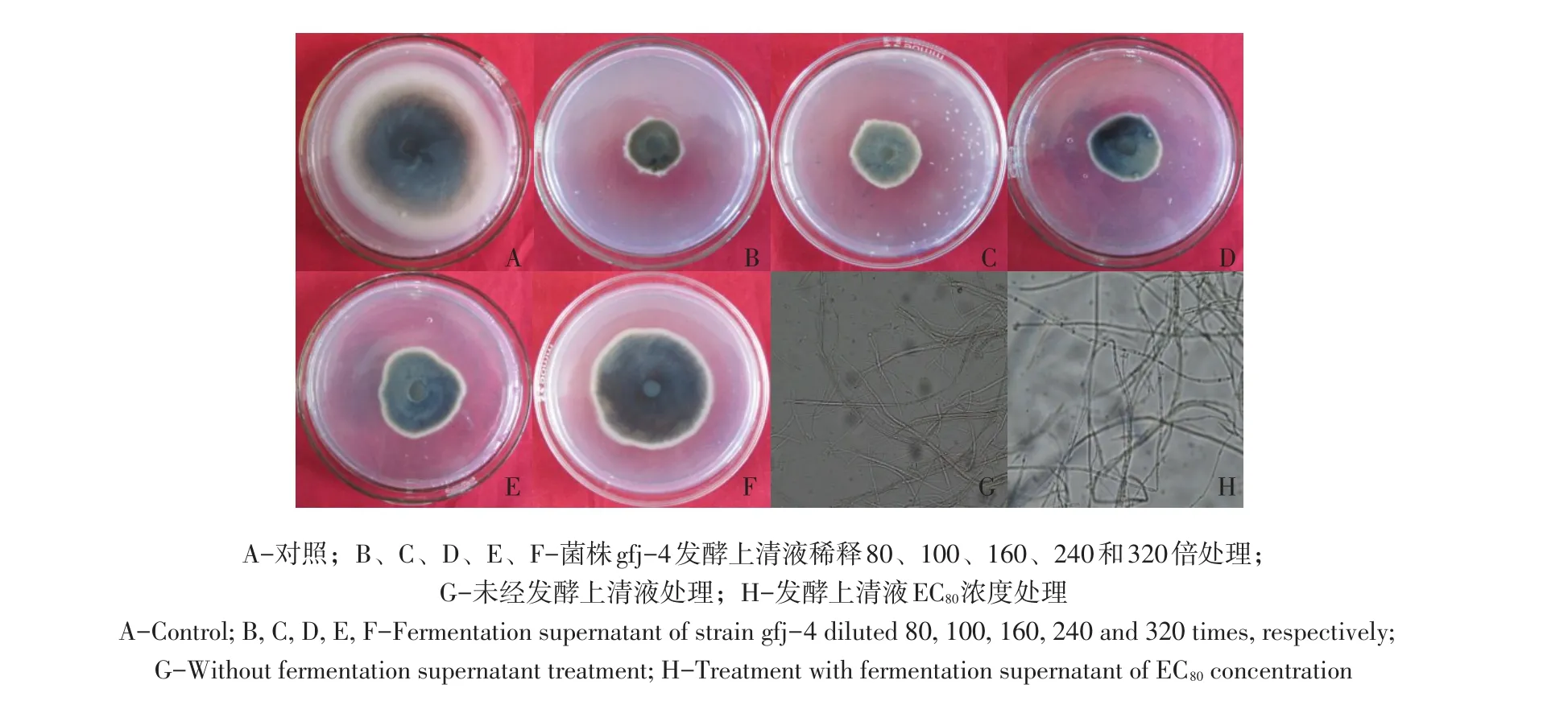
图4 不同稀释倍数发酵上清液对番茄早疫病菌抑制效果Fig.4 Inhibitory effect of different dilution times of B.amyloliquefaciens gfj-4 fermentation supernatant to A.solani
2.5 不同稀释倍数脂肽粗提物对番茄早疫病菌抑制活性的影响
由表3和图5可知,脂肽粗提物浓度由0.50 μL·mL-1增至2.5 μL·mL-1,接种番茄早疫病菌培养168 h对病菌抑制率由39.1%增至62.8%,经SPSS 13.0软件分析得脂肽粗提物对番茄早疫病菌EC50为0.943 μL·mL-1(R2=0.94)。与对照相比可知,经解淀粉芽孢杆菌gfj-4产脂肽粗提物处理番茄早疫病菌丝扩展缓慢,高浓度发酵脂肽粗提物处理使菌丝颜色转变为深褐色。脂肽粗提液EC80浓度处理菌丝与对照相比可知,对照菌丝光滑、生长点多,处理菌丝颜色加深,表面粗糙,呈串珠状肿胀,菌丝原生质浓缩,色素沉积较多,部分菌丝顶端和中部出现膨大囊泡。

表3 不同稀释倍数脂肽粗提物对番茄早疫病菌抑制率Table 3 Inhibition rate of different dilution times of lipopeptide crude extract to A.solani

图5 不同稀释倍数脂肽粗提液对番茄早疫病菌抑制效果Fig.5 Inhibitory effect of different dilution times of lipopeptide crude extract to A.solani
2.6 8种化学杀菌剂对番茄早疫病菌抑制活性测定
结果见表4。
由表4可知,番茄早疫病菌对咪鲜胺、苯醚甲环唑和丙环唑敏感性较高。其中,咪鲜胺对番茄早疫病菌抑制活性最高,EC50达0.095 μg·mL-1;其次为吡唑醚菌酯和腈菌唑对病菌EC50分别为2.910和3.230 μg·mL-1。番茄早疫病菌对戊唑醇为中度敏感水平,EC50为11.762 μg·mL-1。三唑酮和嘧菌酯对病菌抑制活性较差,EC50分别为42.833和112.403 μg·mL-1。
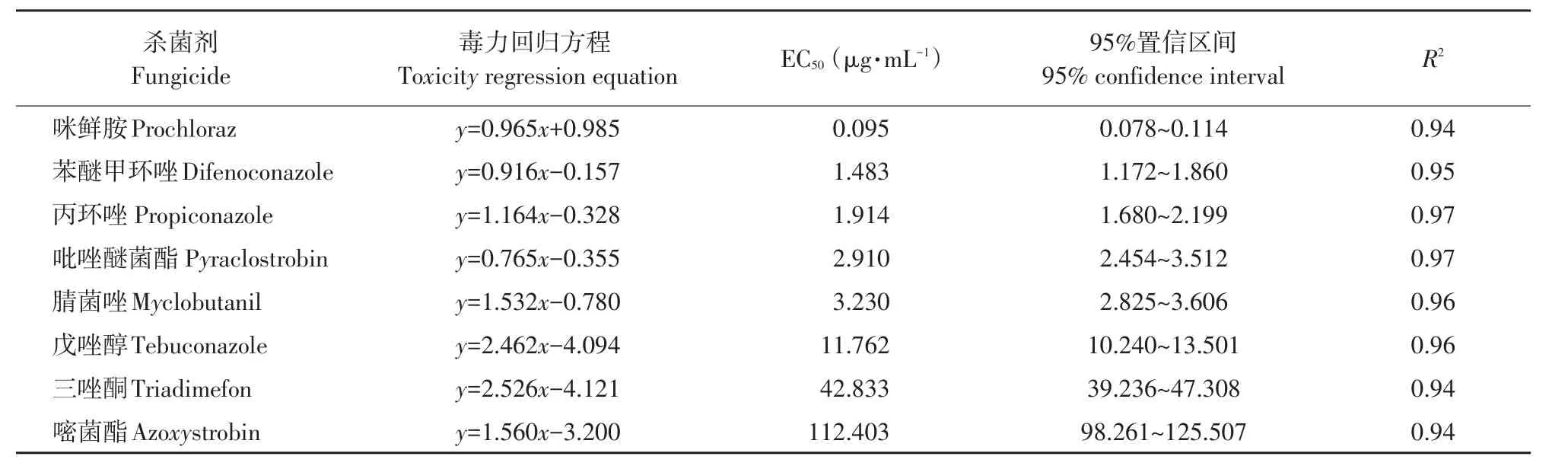
表4 8种化学杀菌剂对番茄早疫病菌毒力测定Table 4 Toxicity levels of eight chemical fungicides to A.solani
2.7 解淀粉芽孢杆菌gfj-4发酵上清液与化学杀菌剂复配组合毒性比测定
由表5~8可知,解淀粉芽孢杆菌gfj-4发酵上清液和4种麦角甾醇生物合成抑制剂咪鲜胺、苯醚甲环唑、丙环唑和腈菌唑以一定比例复配对番茄早疫病菌抑制活性主要表现为拮抗作用。

表5 解淀粉芽孢杆菌发酵上清液与咪鲜胺复配对番茄早疫病菌毒性比Table 5 Toxicity ratio of B.amyloliquefaciens fermentation supernatant and prochloraz to A.solani

表6 解淀粉芽孢杆菌发酵上清液与苯醚甲环唑复配对番茄早疫病菌毒性比Table 6 Toxicity ratio of B.amyloliquefaciens fermentation supernatant and difenoconazole to A.solani

表7 解淀粉芽孢杆菌发酵上清液与丙环唑复配对番茄早疫病菌毒性比Table 7 Toxicity ratio of B.amyloliquefaciens fermentation supernatant and propiconazole to A.solani
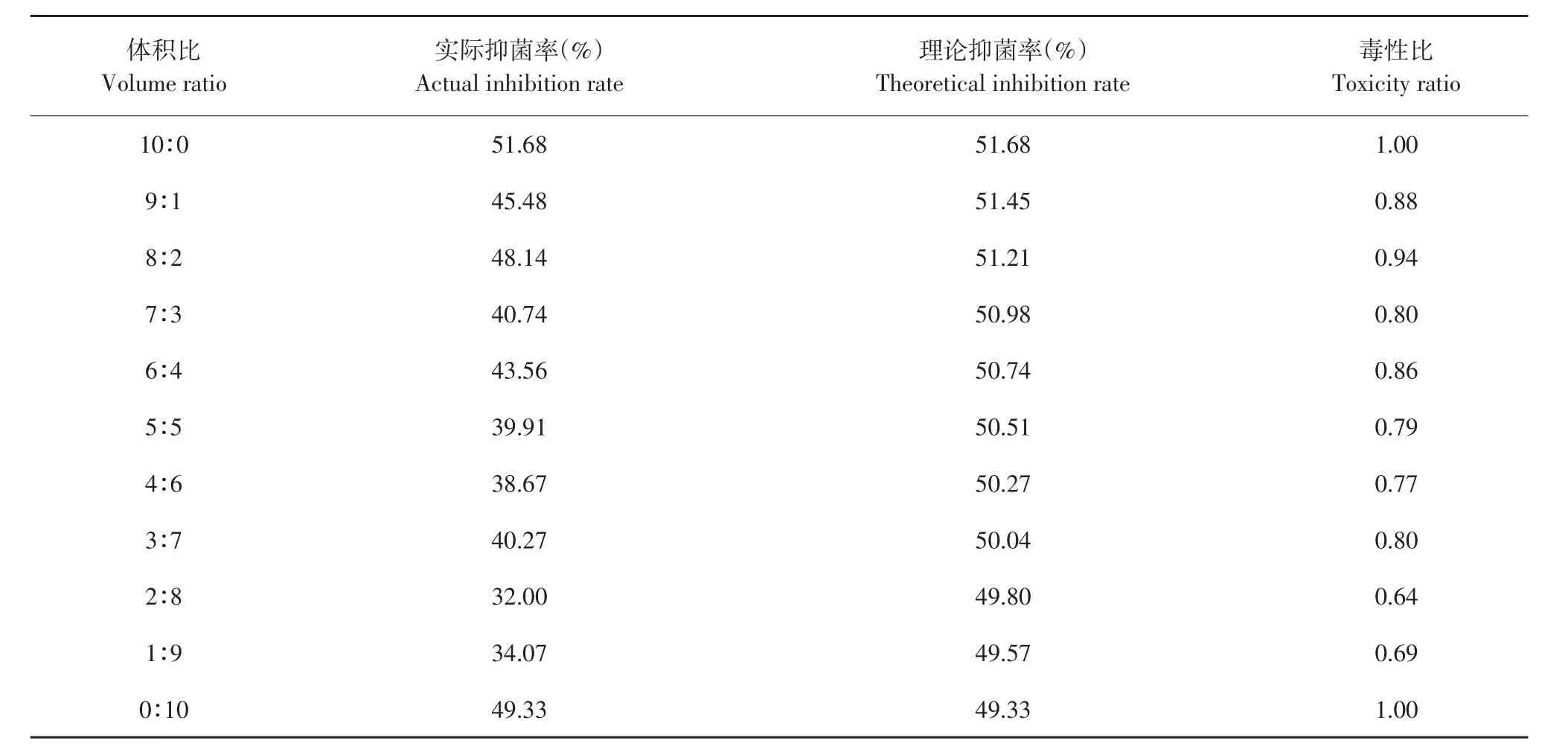
表8 解淀粉芽孢杆菌发酵上清液与腈菌唑复配对番茄早疫病菌毒性比Table 8 Toxicity ratio of B.amyloliquefaciens fermentation supernatant and myclobutanil to A.solani
由表9可知,发酵上清液和戊唑醇混配主要表现为相加作用,其中以1:9比例混配毒性比最高为1.15。
由表10可知,发酵上清液和三唑酮混配在发酵上清液含量较高时主要表现为相加作用,而发酵上清液含量较低时主要表现为拮抗作用,其中以6:4比例混配毒性比最高为1.15。
由表11可知,发酵上清液和吡唑醚菌酯混配时主要表现为相加和增效作用,毒性比率均>1,其中以8:2比例混配毒性比最高,达1.26。
由表12可知,发酵上清液占比较高时和嘧菌酯混配主要表现为增效和相加作用,其中以9:1比例混配毒性比最高,达1.26;而发酵上清液含量较低时(2∶8和1∶9)混配毒性比<1,表现为拮抗作用。

表9 解淀粉芽孢杆菌发酵上清液与戊唑醇复配对番茄早疫病菌毒性比Table 9 Toxicity ratio of B.amyloliquefaciens fermentation supernatant and tebuconazole to A.solani
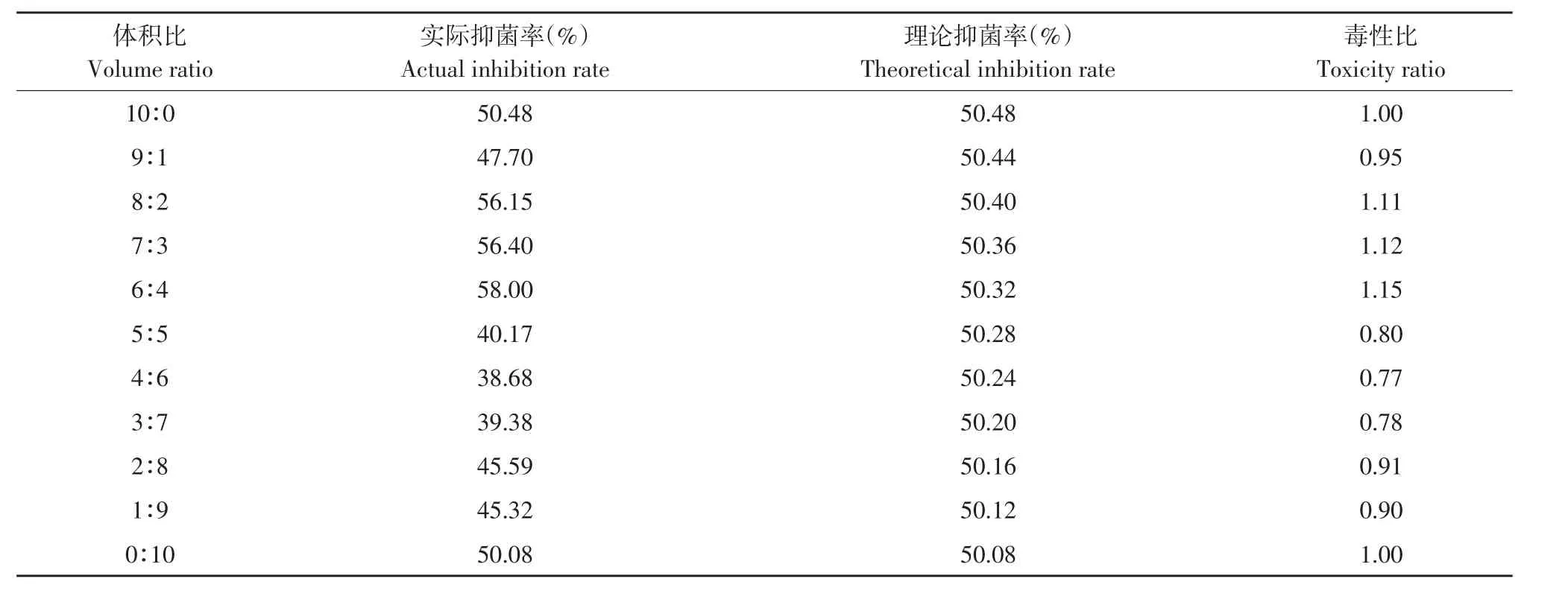
表10 解淀粉芽孢杆菌发酵上清液与三唑酮复配对番茄早疫病菌毒性比Table 10 Toxicity ratio of B.amyloliquefaciens fermentation supernatant and triadimefon to A.solani

表11 解淀粉芽孢杆菌发酵上清液与吡唑嘧菌酯复配对番茄早疫病菌毒性比Table 11 Toxicity ratio of B.amyloliquefaciens fermentation supernatant and pyraclostrobin to A.solani
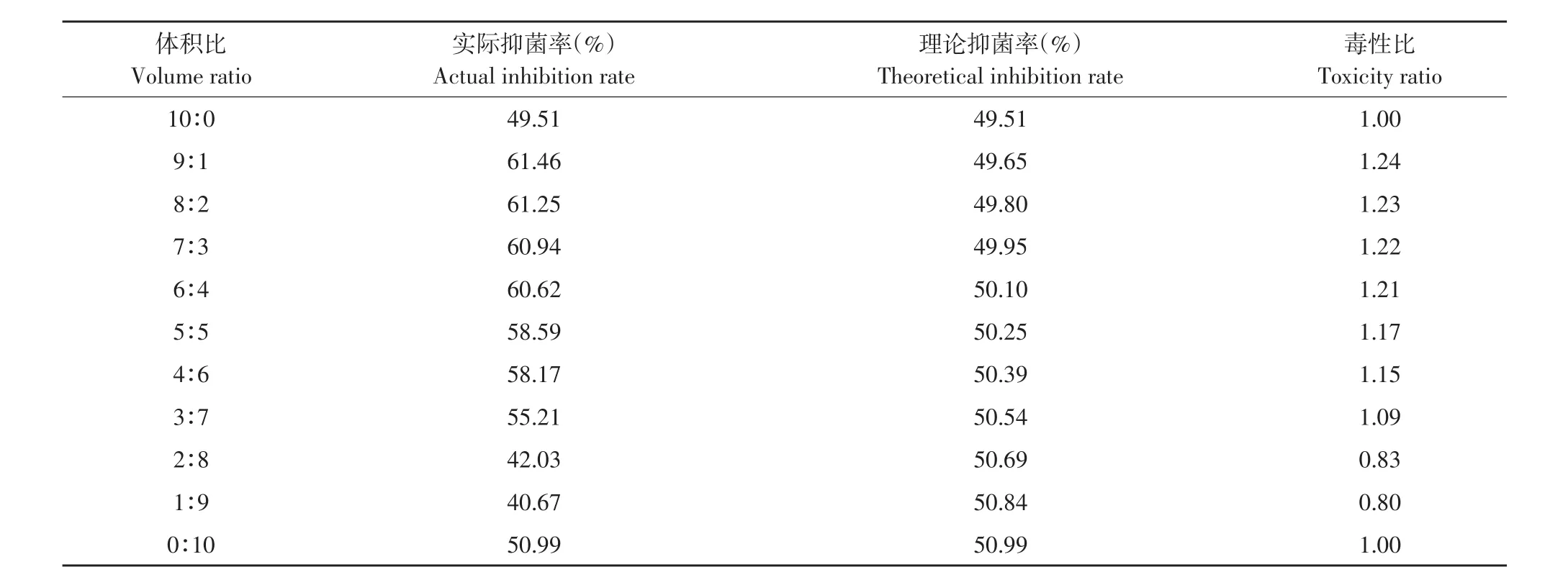
表12 解淀粉芽孢杆菌发酵上清液与嘧菌酯复配对番茄早疫病菌毒性比Table 12 Toxicity ratio of B.amyloliquefaciens fermentation supernatant and azoxystrobin to A.solani
3 讨论与结论
茄链格孢菌(A.solani)可侵染番茄叶、果实和茎秆等,严重时引起落叶和果实腐烂,且产生链格孢毒素,危害人体健康[15]。传统化控方法增强病原菌抗性,降低番茄品质和产量,污染环境[16]。因此,开展番茄早疫病生物防治和新型混配剂研究十分必要[17-18]。
何建清等分离到一株腐生链霉菌(Streptomyces saprophyticus),其发酵液5倍稀释液在活体植株上对番茄早疫病有生防作用,防效为70.9%[19]。高伟等研究表明,海洋芽胞杆菌(Bacillus marinus)B-9987活菌液对茄链格孢菌最低抑菌浓度均为4 μL·mL-1[20]。任璐等测定植物内生细菌yc8发酵液对番茄早疫病孢子萌发有较强抑制作用,EC50为4.22%,对菌丝生长亦有一定抑制作用,yc8发酵液处理的孢子与芽管交接处呈不正常肿大,发酵液处理后可致病原菌胞内物质外泄和细胞壁崩溃[21]。张晓琴等从西洋参种植土壤中分离获得一株枯草芽孢杆菌(Bacillus subtilis),采用杯碟法测定其对番茄早疫病抑制率达82.2%,培养滤液可导致番茄早疫病菌丝畸变、枯萎或者断裂,阻碍菌丝生长[22]。
研究发现解淀粉芽孢杆菌gfj-4制得发酵上清液对番茄早疫病菌EC50为3.774 μL·mL-1,抑菌效果更强,从生防菌发酵上清液中提取的脂肽类物质对病菌抑制活性进一步提升,EC50达0.943 μL·mL-1。脂肽类物质诱导细胞质膜成孔和离子通道形成,破坏膜完整性、扰乱膜渗透性而起抑菌作用,对植物病原真菌拮抗活性良好,利用价值较高,作为“绿色农药”在植物保护中已引起关注[23]。微生物源杀菌剂虽然低毒、无污染,但同时存在防治效果不稳定、防治谱较窄等缺点,将拮抗微生物次级代谢产物与化学杀菌剂相结合筛选增效组合,对拓宽微生物源杀菌剂使用范围具有重要意义[24-25]。
研究筛选的解淀粉芽孢杆菌gfj-4发酵上清液和嘧菌酯、吡唑醚菌酯混配组合对番茄早疫病菌表现较强增效作用,可能是发酵液中含抑菌活性物质与甲氧丙烯酸酯类杀菌剂抑菌机制不同导致[26]。发酵活性物质和上述两种化学杀菌剂混配组合开发,有待后续深入研究。

