新生树鼩多巴胺神经元的体外培养
李 娟,曾晓锋,杨根梦,仝品芬,代解杰*
(1.中国医学科学院/北京协和医学院医学生物学研究所,云南省重大传染病疫苗研发重点实验室,昆明 650118; 2.昆明医科大学法医学院,昆明 650500)
树鼩(Tupaiabelangeri)是生活在热带和亚热带地区的一种哺乳动物,在分类上它比啮齿类动物更接近于灵长类,且其体积小、易繁殖,因此是一种很有前途的动物模型[1]。目前,树鼩主要用于病毒感染如丙肝、甲型流感H1N1、肠道病毒EV71等[2],神经疾病障碍[3-5],癌症[6]及代谢疾病[7]等方面的研究。有研究发现帕金森疾病(Parkinson’s disease,PD)的发生与α-synuclein蛋白(一种广泛存在的突触前蛋白)密切相关,而树鼩的基因组测序结果显示,其α-synuclein蛋白序列与人类的序列同源性为97.1%,因此推测树鼩是研究PD的合适动物模型[4]。多巴胺作为一种单胺类神经递质,在哺乳动物中枢神经系统中起着非常重要的生理功能,包括情感认识、思维认知、记忆力以及运动等,多巴胺神经元不仅在帕金森病的发病过程中起着关键作用,还与很多精神性疾病,如多动症和药物性神经毒性如甲基苯丙胺的大脑损害等高度相关[8-9]。因此寻找一种高效、高纯度且简单易行的树鼩多巴胺神经元原代培养方法,是研究PD及其他多巴胺神经功能异常疾病的基础。
1 材料和方法
1.1 实验动物
新生3 d内中缅树鼩4只,普通级,雌雄各半,体重9.4 ~ 17.5 g,平均(13.2±3.7) g,由中国医学科学院/北京协和医学院医学生物学研究所树鼩种质资源中心提供[SCXK (滇) K2013-0001],实验在中国医学科学院医学生物学研究所开展[SYXK (滇) K2013-0001]。实验过程中做到实验动物使用的3R原则,实验程序遵循福利伦理要求(福利伦理审查号:DWSP2017053)。
1.2 主要试剂与仪器
DMEM/F12、胎牛血清、双抗、0.25%胰酶消化液、PBS以及D-Hank’s液购自Hyclone公司;Neurobasal-A培养基、无血清培养添加剂B27、Glutamax购自Gibco公司;鼠抗酪氨酸羟化酶(TH)购自Scata公司;鼠抗β-tublin-Ⅲ、兔抗nestin以及Goat Anti-Mouse IgG H&L(Alexa Fluor 488)购自Abcam公司,Alexa Fluor 555标记山羊抗兔荧光IgG购自ThermoFisher Scientific公司。Ti荧光显微镜购自Nikon公司;SP5共聚焦荧光显微镜购自Leica公司;PDL包被的细胞瓶、6孔板及共聚焦专用培养皿购自Nest公司。
1.3 实验方法
1.3.1 原代细胞培养
根据廖慧丹等[10]实验方法进行改良,取新生3 d内树鼩,皮下注射戊巴比妥钠麻醉,取离体头部放入75%酒精的培养皿浸泡5 min;将头部取出放入干净培养皿中,在无菌超净台内,用无菌手术剪及镊子取出脑,放入4℃预冷的含2%双抗的D-Hank’s液中,去除软膜血管,剥离出中脑组织;用D-Hank’s液清洗后,将组织剪碎至1 mm大小,转入50 mL离心管,2000 r/min离心5 min,弃上清,按照体积1∶3比例加入0.25%胰酶消化液(即离心管中剩余物与0.25%胰酶消化液的体积比为1∶3),反复吹打后放入37℃、5% CO2温箱消化10 ~ 15 min;消化结束后,向离心管中加入含5%胎牛血清的细胞培养液(DMEM/F12,1%双抗,5% FBS)终止消化,反复吹打消化后的细胞直至无肉眼可见的组织块,之后采用70目细胞筛过滤,滤液2000 r/min离心10 min;弃上清,用上述培养基重悬细胞,调整细胞密度为1 × 106/mL,并转入PDL包被的细胞瓶上培养,培养3 d后换液,更换为神经元专用培养基(Neurobasal-A培养基含2% B27,1% Glutamax,1%双抗),以后每3 d换一次液。
1.3.2 免疫荧光染色
接种在共聚焦显微镜专用培养皿的细胞,培养14 d时,吸出培养液,PBS洗2遍,每次5 min;加入4℃预冷的4%多聚甲醛,覆盖即可,放入4℃冰箱固定30 min;室温下,吸出4%多聚甲醛,PBS洗3遍,每次5 min;加入0.1% TritonTMX-100(PBS配制),覆盖即可,20 min后吸出,然后PBS洗3遍,每次5 min;用体积浓度为5%山羊血清(PBS配制)封闭1 h。PBS清洗3次,每次5 min;加入一抗稀释液稀释的nestin(1∶100)、TH(1∶100)、β-tublin-Ⅲ(1∶100),覆盖即可,放入4℃冰箱孵育过夜;在室温下,吸取上述液体,PBS洗3遍,每次5 min;加入PBS稀释的二抗,稀释比例为1∶200,37℃孵育1 h;PBS清洗3次,每次5 min;吸出二抗,PBS洗3遍,每次5 min。加入核染色剂DAPI(1∶500),室温染色3 min,PBS洗3遍,每次5 min,然后用荧光倒置显微镜观察结果后用激光共聚焦显微镜拍照。
1.4 统计学方法

2 结果
2.1 树鼩原代多巴胺神经元体外形态学观察
原代分离的单个细胞多呈圆形且具有折光性,细胞计数台盼蓝染色显示,细胞存活率为90% ~ 95%。培养3 d后部分细胞贴壁,呈圆状凸起,周围边界清晰(图1A);培养7 d时贴壁的神经元逐渐长出轴突(图1B),随着时间增长细胞的轴突突起之间发生联系并交织成网状(图1C)。
2.2 树鼩原代多巴胺神经元体外分化能力的鉴定
分别在细胞培养7 d和14 d时进行anti-nestin和anti-β-tublin-Ⅲ双免疫荧光鉴定(图2)。当细胞培养7 d时,红色荧光的nestin的数量明显多于绿色荧光的β-tublin-Ⅲ(图2A),随着时间增长,细胞逐渐分化当培养至第14天时,绿色荧光的β-tublin-Ⅲ开始增多,与红色荧光的nestin的数量相当(图2B)。
2.3 树鼩原代多巴胺神经元鉴定
当细胞培养至14 d时,进行anti-TH和anti-nestin双免疫荧光鉴定(图3)。在高倍视野下随机选取5个视野,以DAPI进行细胞核染色代表细胞总数,TH染色阳性代表阳性多巴胺神经元,计算TH阳性率,结果显示TH阳性占细胞总数的(88.49±2.4)%(表1)。
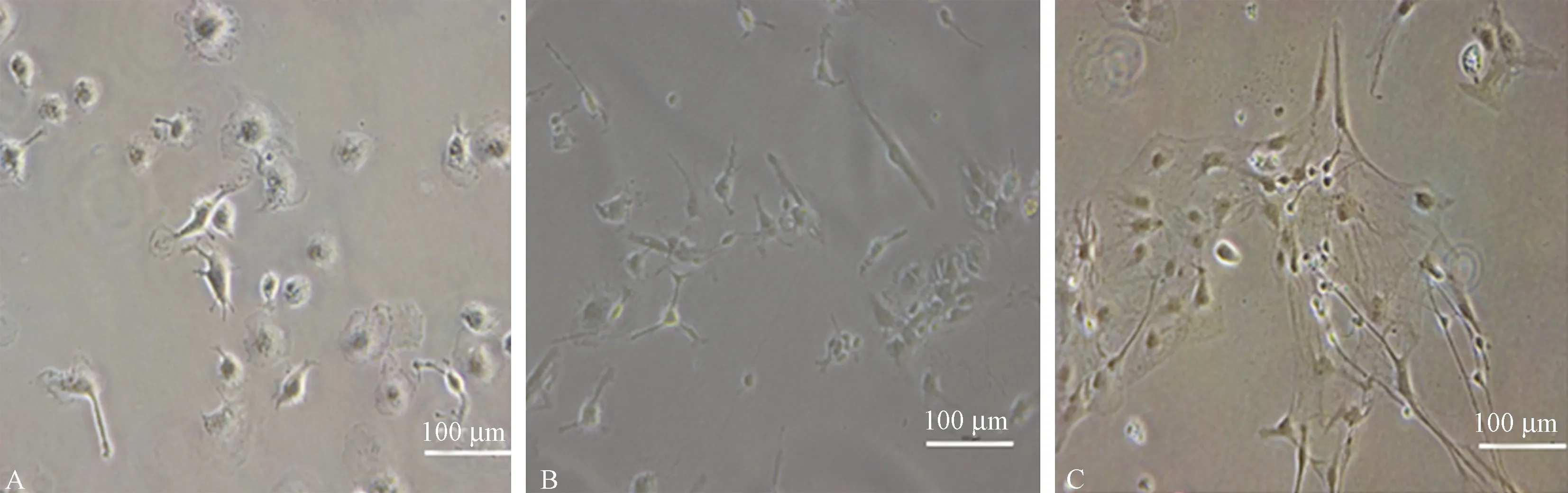
注:A:细胞培养3 d,神经元贴壁,呈圆状凸起,周围边界清晰;B:细胞培养7 d神经元逐渐长出轴突;C:细胞培养14 d时,神经元的轴突突起之间发生联系并交织成网状。图1 树鼩原代神经元不同培养时间的形态(× 200)Note. A: On day 3 of cell culture, neurons adhered to the culture vessel, which were rounded with a clear surrounding boundary. B: Neurons had gradually grown axons by day 7. C: At day 14, the axons of neurons were connected and interwoven into a network.Figure 1 Morphology of primary neurons of the tree shrew
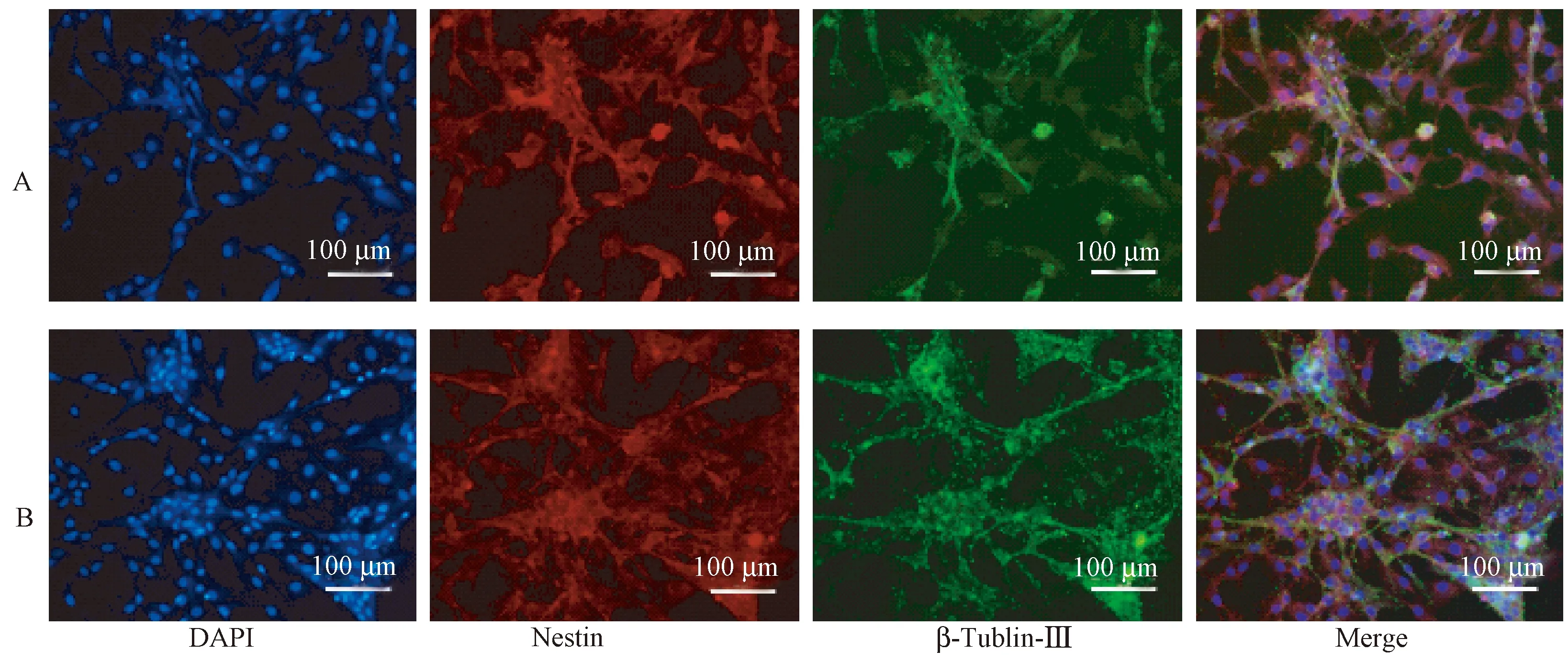
注:A:细胞培养7 d;B:细胞培养14 d。蓝色荧光为DAPI染细胞核;红色荧光为神经元特异标记蛋白nestin抗体;绿色荧光为β-tublin-Ⅲ抗体。图2 树鼩原代神经元不同培养时间的免疫荧光鉴定(× 200)Note. A: Cells cultured for 7 days; B: Cells cultured for 14 days. Blue fluorescence indicates nuclei; Red fluorescence indicates nestin; Green fluorescence indicates β-tubulin-Ⅲ.Figure 2 Morphology of primary neurons of the tree shrew

注:蓝色荧光为DAPI染细胞核;红色荧光为神经元特异标记蛋白nestin抗体;绿色荧光为多巴胺神经元特异标记蛋白酪氨酸羟化酶(tyrosine hydroxylase,TH)抗体。图3 树鼩原代多巴胺神经元免疫学鉴定Note. Blue fluorescence indicates nuclei; Red fluorescence indicates nestin; Green fluorescence indicates tyrosine hydroxylase (TH).Figure 3 Immunofluorescence of primary dopaminergic neurons from the tree shrew

视野Views细胞总数Total number of cellsTH阳性细胞数Number of TH-positive cells比例(%)Percentage1706491.42862887888.636431159986.087041039390.2913514312386.0140平均值Mean103.891.488.4915
3 讨论
神经干细胞是一种具有自我更新和分化潜能的细胞,可以分化为神经元和神经细胞如星形胶质细胞及少突胶质细胞等,而神经元对机体的神经发育以及修复受损的神经组织起到重要作用。神经干细胞的原代培养受到各种因素影响如培养细胞的质量,包括取样时间、位置、细胞密度、培养时间、细胞因子和血清浓度等[11-12]。Xiong等[12]在神经干细胞的原代培养中加入神经生长因子(nerve growth factor,NGF)可以显著促进神经干细胞的成活率,但是NGF价格昂贵,在现代节约型社会中寻找另外一种廉价高效、经济实惠的培养方法显得更为重要,因此本实验旨在寻找一种更加经济实惠的多巴胺神经元培养方法,为研究多巴胺神经元相关的功能障碍疾病提供细胞模型。
巢氏蛋白(nestin)是一种中间丝蛋白,在中枢神经系统发育过程中,巢氏蛋白最先在神经前体细胞中表达,当神经前体细胞朝向终末方向分化时便停止表达,因此巢氏蛋白是神经干细胞早期的标志[13]。微管蛋白是构成细胞骨架的一种蛋白,而β-微管蛋白-Ⅲ(β-tublin-Ⅲ)则表达在分化的轴突和触突上,是神经元特有的标志物[14]。在本试验中培养7 d后细胞表达多以nestin蛋白为主,而14 d之后则多以β-tublin-Ⅲ蛋白为主,显示了神经干细胞逐渐向多巴胺神经元分化的时间发育过程。
目前诱导神经干细胞向神经元分化的方法较多,如添加生长因子bEGF、EGF、GDNF等,中药诱导如三七总皂苷[15],或者用骨髓间充质干细胞分化为神经元样细胞[16],但这些方法诱导神经干细胞分化成神经元的比例却不高。陈梅玲等[17]用GDNF诱导神经干细胞向多巴胺神经元分化,其TH阳性率仅为6.6%,而韩姝等[18]使用重组腺病毒加抗坏血酸共同诱导神经干细胞向多巴胺神经元分化,TH阳性率达到74%。本试验对神经干细胞使用低浓度血清进行贴壁培养,然后使用无血清培养基即神经元专用培养基以抑制胶质细胞生长。神经元专用培养基(Neurobasal-A)本身含有神经元生长所需的生长因子,非常有利于神经元的生长、增殖,且价格适中,培养14 d之后TH阳性率达到88.49%。
多巴胺神经元是一类具有分泌并释放多巴胺作为神经递质的神经元,在维持正常脑功能中起着重要作用。而多巴胺神经元功能异常则会引起帕金森综合征或一些精神类疾病的发生,因此多巴胺神经元的体外培养是研究这些疾病的基础。本文培养多巴胺神经元的方法具有简单经济,容易操作,通过本方法能够得到较高纯度的多巴胺神经元,对于研究相关疾病的发病、治疗等提供一个实验基础。

