紫丁香与羽叶丁香叶绿体DNA提取方法研究
张靖雯,姜在民,蔡 靖*
(1.西北农林科技大学 林学院,陕西 杨陵 712100;2.西北农林科技大学 生命科学学院,陕西 杨陵 712100)
叶绿体是植物进行光合作用的细胞器,具有自主遗传信息,是植物细胞遗传的重要单位。高等植物的叶绿体DNA(chloroplast DNA,cpDNA),一般长120~160 kb,多数为双链共价闭合环状分子,极少数为线状[1],叶绿体基因组结构由长单拷贝序列(long single copy sequence,LSC),短单拷贝序列(short single copy sequence,SSC)和2个反向重复序列(inverted repeat sequence A/B,IRA/IRB)组成,IRA和IRB编码相同,方向相反,被LSC和SSC隔开。被子植物叶绿体基因组序列高度保守,且属于母系遗传,具有分子量小、结构简单,进化速率低、多拷贝[2]等多方面优点。目前已在遗传结构分析[3]、分子标记[4]、起源进化[5]、核质互作和叶绿体基因工程[6]等方面展开了广泛研究,且叶绿体转化技术在遗传改良、生物制剂的生产等方面显示出巨大潜力[7],已成为植物转基因技术又一新的研究目标[8],而获得高质量的cpDNA是展开后续基因分子水平研究的必要条件。
相对于较成熟的基因组DNA提取方法而言,cpDNA的提取存在很大障碍,主要是由于物种之间差异性较大,核DNA的污染等。目前,关于叶绿体基因组的提取方法有很多,但是提取效率依然较低,不同植物提取叶绿体基因组的难易程度也各不相同。目前国内外对丁香属植物叶绿体基因组的研究较少,而提取出高质量的cpDNA是很多相关研究的关键所在。因此,本研究以现有的cpDNA提取方法为基础,建立适用于丁香属植物的cpDNA的提取方法体系,这对丁香属植物叶绿体基因组的进一步研究有重大意义。
丁香属(Syringa)植物为木犀科(Oleaceae)多年生灌木或小乔木,是本科著名的观花植物[9],由于生境多样、适应性广、观赏性状独特而深受世界人民的喜爱,现已有近千年的栽培历史[10]。本试验所选取的植物材料紫丁香(Syringaoblata)和羽叶丁香(Syringapinnatifolia)分别为丁香属的广布种和濒危物种。紫丁香作为中国三北地区的广布种,广泛地应用于园林绿化当中,具有较高的观赏价值。羽叶丁香是我国三级濒危保护种,且具有较高的药用及观赏价值,是丁香属中唯一具有羽状复叶性状的物种,对于研究丁香属的亲缘关系、系统发育、地理分布等,都具有重要的科学意义。研究丁香属植物cpDNA的提取方法,并利用现代分子生物学技术,探究丁香属植物间的遗传多样性、亲缘关系和起源进化,对今后科学利用丁香种质资源有重要指导意义。
1 材料与方法
1.1 试验材料及预处理
试验材料为紫丁香与羽叶丁香的成熟叶片,紫丁香叶片采自西北农林科技大学南校区丁香园,羽叶丁香叶片采自西北农林科技大学羽叶丁香种质资源圃。于2017年5月分别摘取2种植物新鲜叶片30~40 g,清水洗3遍,擦干,纱布包裹,置于4℃冰箱饥饿处理12~24 h。
1.2 方法
1.2.1 高盐-低pH法 参考C.Shi[11]等的方法。
1.2.2 改良的高盐-低pH法 参考K.Diekmann[12]、刘娟[13]、陈春梅[14]等的方法,并进行改进。
1.2.2.1 叶绿体分离 所有试验步骤均在冰上进行,玻璃器皿、离心管等提前预冷处理。
1) 匀浆:将叶片剪成1 cm长短,放入匀浆机(用小型榨汁机代替),倒入400 mL预冷的缓冲液A(20 mmol/L EDTA-Na2,50 mmol/L Tris,1.25 mol/L NaCl,0.25 mol/L 抗坏血酸,1 mmol/L DTT,0.1%BSA,pH=3.6;抗坏血酸,BSA,DTT现用现加),低速匀浆10 s,2次,高速匀浆10 s,3次。
2) 过滤:将匀浆液用4层无菌纱布过滤。
3) 去除细胞残骸:过滤后用50 mL离心管分装滤液,1 000 r/min,4℃,离心5 min,弃沉淀,重复1次。
4) 粗提:将上清4 000 r/min,4℃,离心10 min,弃上清。
5) 纯化:沉淀中加入25 mL预冷的缓冲液B(20 mmol/L EDTA-Na2,50 mmol/L Tris,1.25 mol/L NaCl,1 mmol/L DTT,0.1%BSA;BSA,DTT现用现加),用无菌软毛刷悬浮沉淀,4 000 r/min,4℃,离心10 min,弃上清,重复1次。
6) 再纯化:沉淀加入5 mL预冷的缓冲液C(40 mmol/L蔗糖,50 mmol/L Tris,0.1%BSA;BSA现用现加),用无菌软毛刷悬浮沉淀,4 000 r/min,4℃,离心10 min,弃上清。所得沉淀为纯化的叶绿体,用显微镜镜检叶绿体的完整性。
1.2.2.2 叶绿体裂解,cpDNA的分离纯化
1) 裂解:纯化叶绿体加入2 mL缓冲液D(50 mmol/L EDTA-Na2,100 mmol/L Tris,100 mmol/L NaCl,1 mmol/L DTT;DTT现用现加),0.5 mL 20% SDS,10 μL蛋白酶K,55℃水浴3 h,使叶绿体裂解,释放出cpDNA。裂解结束后加入0.5 mL 5 mol/L KAc,冰浴20 min。
2) 抽提:加入等体积酚/氯仿/异戊醇(25∶24∶1),轻柔颠倒混匀,12 000 r/min,4℃,离心10 min,离心后,小心吸取上清液,重复1次。
3) 再抽提:加入等体积氯仿,轻柔颠倒混匀,12 000 r/min,4℃,离心10 min,小心吸取上清液。
4) 沉淀DNA:上清液加入等体积的异丙醇,-20℃,沉淀3 h,12 000 r/min,4℃,离心15 min,收集沉淀,70%乙醇清洗2次,无水乙醇清洗1次,自然挥发乙醇。
5) 除RNA除蛋白:沉淀加入0.5 mL 1×TE缓冲液,加入2.5 μL RNase(10 mg/mL),37℃水浴1 h,再加入2.5 μL蛋白酶K(10 mg/mL),37℃水浴1 h。
6) 沉淀DNA:加入1/10体积NaAc(3 mol/L)和两倍体积的无水乙醇沉淀过夜,12 000 r/min,4℃,离心15 min,收集沉淀,70%乙醇清洗2次,无水乙醇清洗1次,自然挥发乙醇。
7) 溶解DNA:加入50 μL 1×TE缓冲液溶解DNA,得到cpDNA溶液,-20℃保存,长期保存需放入-80℃超低温冰箱。
1.3 叶绿体镜检
取2 mL缓冲液D悬浮叶绿体沉淀,制作临时装片,在Leica DM4000B荧光显微镜下观察叶绿体的完整性。
1.4 cpDNA检测
1.4.1 cpDNA质量检测 取1 μL cpDNA溶液,在Nano Drop 2000C超微量分光光度计上测量核酸含量,用1×TE作空白对照,记录OD260nm/OD280nm值、OD260nm/OD230nm值及质量浓度。质量高的DNA的OD260nm/OD280nm值在1.8~1.9,>1.9表明样品存在RNA污染,<1.7表明样品存在蛋白质、酚类污染;纯DNA的OD260nm/OD230nm值为2.5,<2.0表明样品存在糖类、盐类或有机溶剂污染,需纯化。
1.4.2 琼脂糖凝胶电泳检测 取4 μL cpDNA溶液,加0.8 μL DNA loading buffer混匀,使用bio-rad Power pac Universal电泳仪,在0.5%琼脂糖凝胶中电泳,上样量为4 μL,电泳缓冲液为1×TAE,电压为120 V,电泳30 min,在紫外凝胶成像系统下检测蛋白是否除干净、RNA是否除彻底、cpDNA的完整性。
2 结果与分析
2.1 丁香叶绿体完整性检测
采用高盐-低pH法(方法Ⅰ)和改良高盐-低pH法(方法Ⅱ),分别得到了紫丁香(Z)和羽叶丁香(Y)的叶绿体。对比图1可发现,方法Ⅱ所得的叶绿体沉淀更多;对比图2镜检结果可发现,方法Ⅱ分离的叶绿体浓度高、数量多、杂质少、背景清晰,说明改良高盐-低pH法更适合丁香叶绿体的分离。

注:Ⅰ、Ⅱ分别代表高盐-低pH法和改良高盐-低pH法,Z、Y分别代表紫丁香和羽叶丁香。下同。
2.2 丁香cpDNA质量检测
由表1的紫外分析结果可知,2种提取方法所得的cpDNA的各项质量指标差异显著,方法Ⅰ所提取的紫丁香与羽叶丁香的cpDNA质量浓度仅为64.1 ng/μL和171.6 ng/μL,OD260/OD280值分别为1.32和1.29,均<1.7,表明样品存在蛋白、酚的污染,OD260/OD230值分别为1.34和1.00,均<2.0,表明样品存在被糖类、盐类或有机溶剂污染,不能满足后续的测序要求以及叶绿体基因组的深入研究。方法Ⅱ所提取的紫丁香与羽叶丁香的cpDNA质量浓度分别为650.1 ng/μL和330.3 ng/μL,OD260/OD280值分别为1.86和1.88,在纯净的DNA比值1.8~1.9,OD260/OD230值分别为2.35和2.58,大于衡量DNA纯净比值2.0,表明方法Ⅱ所提取的DNA质量好,浓度和纯度高,不存在蛋白、酚类、盐以及有机溶剂等的污染。上述结果表明改良的高盐-低pH法适合丁香叶绿体cpDNA的提取,能够满足后续的测序要求以及叶绿体基因组的深入研究。
2.3 丁香cpDNA电泳检测
由图3的琼脂糖凝胶电泳结果可知,方法Ⅰ所提取的cpDNA无明显条带,而方法Ⅱ所提取的cpDNA条带清晰,明亮,整齐一致,无降解现象,无RNA、蛋白、盐等杂质的污染,所得cpDNA纯度较高,质量好。
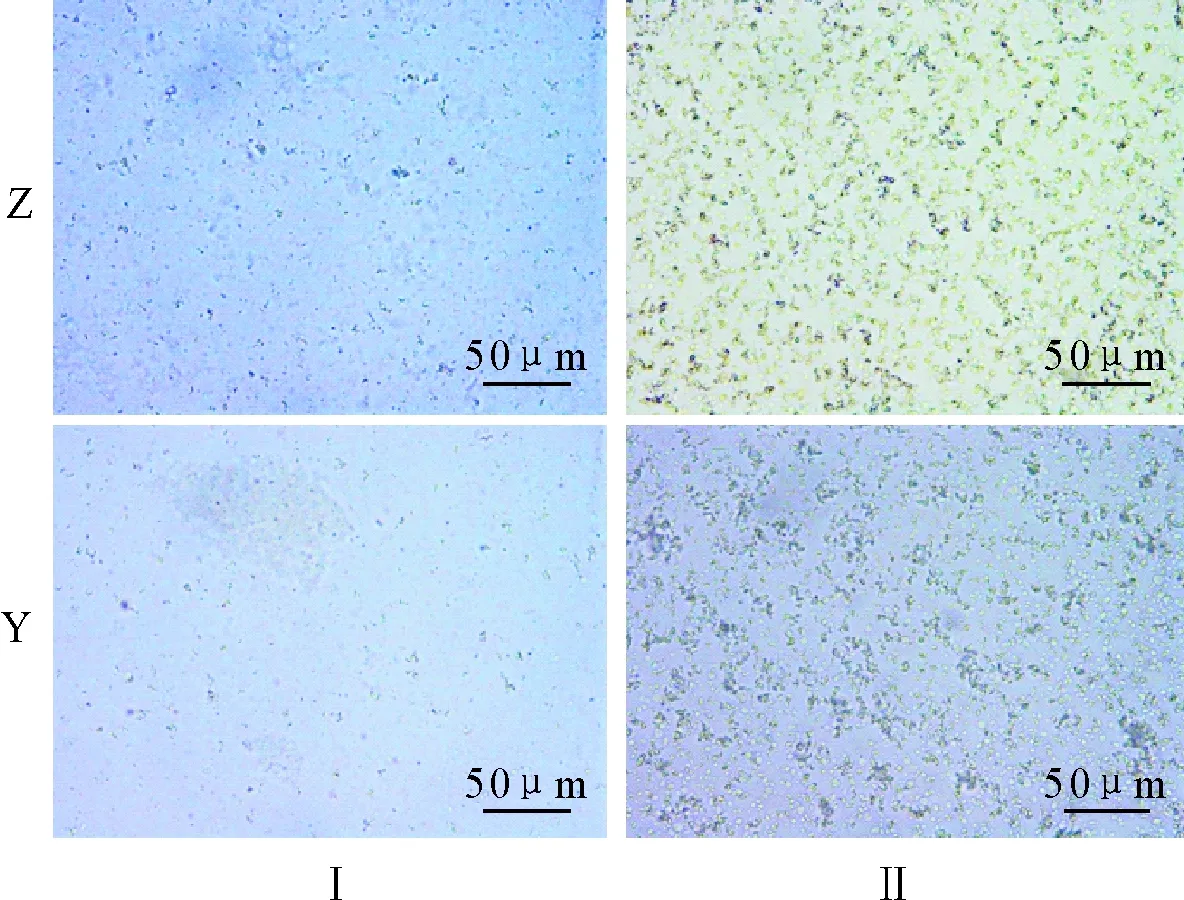
图2 高盐-低pH法(Ⅰ)和改良高盐-低pH法(Ⅱ)分离的叶绿体镜检比较Fig.2 Comparison of chloroplast microscopy seperated by the high-salt low-pH method (Ⅰ) and the modified high-salt low-pH method (Ⅱ)

表1 2种方法提取的cpDNA紫外分析结果Table 1 UV scanning results of cpDNA extracted by two methods

注:M代表5 000 DNA Ladder Marker。
3 结论与讨论
获得高质量、高纯度的cpDNA样品,是后续基因分子水平研究的前提条件。cpDNA提取的关键是去除叶绿体膜外的核DNA与线粒体DNA污染。高盐-低pH法分离叶绿体的原理是通过叶片在高速匀浆过程中,产生大量静电,核DNA被组蛋白包裹带正电,紧紧地被吸附在带负电的叶绿体膜上,而在高盐介质环境中由于电子屏蔽作用,这种静电作用被减弱,因此可以通过不同pH值的高盐缓冲液反复洗涤,以达到去除吸附的核DNA的目的[15],而由于线粒体与叶绿体差别较大,通过差速离心就可分离。其他关于cpDNA的提取方法主要有DNaseⅠ法[16]、蔗糖密度梯度离心法[17]、percoll密度梯度离心法[18]、氯化铯密度梯度离心法[19]等。DNaseⅠ法利用DNaseⅠ消化膜外的DNA,以达到消除核DNA以及线粒体DNA污染的目的,但经过匀浆和多次离心后,叶绿体膜难以保持完整,使得膜内的cpDNA也被消化掉,cpDNA得率低[15];蔗糖密度梯度离心法无法将完整的叶绿体与破碎的叶绿体分离,密度梯度液不易保持,对离心机等设备要求高,分离效果不理想;氯化铯密度梯度离心法主要用于草本植物cpDNA的提取,且其成本高、耗时长、得率低、对设备要求也较高,一般实验室难以采用[20];percoll密度梯度离心法虽可较简便地分离提取cpDNA,但所提取的cpDNA得率较低,且percoll分离液的价格偏高。因此,这几种方法均无法简便高效地提取植物cpDNA。
本研究采用了高盐-低pH法[11]和改良的高盐-低pH法[12-14],分别提取了紫丁香与羽叶丁香的cpDNA。C.Shi[11]的高盐-低pH法已成功提取了葡萄[21]、无患子[22]、三叶青[22]、枣[23]等植物的cpDNA,但此方法并不适合丁香cpDNA的提取,经紫外分光光度计检测,所提取的紫丁香与羽叶丁香cpDNA的OD260/OD280<1.7,OD260/OD230<2.0,且质量浓度较低,表明提取的cpDNA纯度低,含有蛋白、酚类、盐以及有机溶剂等的污染,琼脂糖凝胶电泳也发现并无条带,表明所提取的cpDNA含量小,浓度低,结果证明C.Shi[11]的高盐-低pH法并不适合丁香cpDNA的提取,分析可能是C.Shi[11]的高盐-低pH法在叶绿体分离过程中,离心时间过长,是本研究改进的高盐-低pH法分离叶绿体离心时间的两倍,因此导致叶绿体活性大幅降低;叶绿体裂解时间过长,导致基因组DNA片段断裂,使得最终提取结果cpDNA的质量、浓度都达不到要求。之后采取K.Diekmann[12]、刘娟[13]、陈春梅[14]等的方法进行组合,并根据丁香的特性加以改进,形成改良的高盐-低pH法,所提取的紫丁香与羽叶丁香的cpDNA的OD260/OD280值在1.8~1.9,OD260/OD230值接近2.5,且质量浓度分别高达650.1 ng/μL和330.3 ng/μL,表明提取的cpDNA质量好、纯度高,琼脂糖凝胶电泳显示条带清晰、明亮,无降解现象,结果证明改良后的高盐-低pH法适合紫丁香与羽叶丁香cpDNA的提取。本研究在高盐-低pH法的基础上,做了如下改进:提取前,将新鲜叶片放入4℃冰箱,将饥饿处理时间减少到12~24 h,去除叶片中的淀粉等糖类物质,减少糖类物质对后续提取工作的影响;由于叶绿体离体后活力会迅速下降,所以叶绿体分离过程要快,本试验开始采用研钵进行手工研磨,发现手工研磨会使叶片研磨不彻底,费时费力且导致叶绿体活性下降严重,因此采用匀浆机代替手工研磨匀浆,减少匀浆时间,避免叶绿体离体时间过长导致的活力下降,并采用短时多次的匀浆方法,避免匀浆机发热,破坏叶绿体被膜;用DTT(二硫苏糖醇)代替β-巯基乙醇作为还原剂,DTT具有比β-巯基乙醇更低的毒性和更小刺激性的气味,且其抗氧化性是β-巯基乙醇的7倍,能更有效组织酚类物质的氧化,并进一步提高叶绿体完整性;增加了氯仿抽提,是因为酚/氯仿/异戊醇(25∶24∶1)抽提后,会有酚污染残留,由于酚易溶于氯仿中,因此增加氯仿抽提,以达到进一步排除酚污染的目的;试验最后再次加入少量蛋白酶K,37℃水浴1 h,以达到进一步去除蛋白残留的目的;在使用RNase和蛋白酶K处理了cpDNA溶液后,再次进行酒精沉淀洗涤cpDNA,是为了减少所得cpDNA溶液中的其他杂质,提高所得cpDNA质量。
本研究改良的高盐-低pH法可较快速简单地提取丁香cpDNA,所提取的cpDNA可用于叶绿体基因组分子水平的后续研究。此提取方法对实验室仪器设备要求不高,操作简便、成本低,可为木本植物cpDNA的提取提供参考。

