黄酒发酵过程中微生物筛选及菌株产香分析
张 超,刘双平,,邹慧君,周志磊,3,韩 笑,3,4,姬中伟,3,王宗敏,3,毛 健,3,4,*
(1.江南大学,粮食发酵工艺与技术国家工程实验室,江苏无锡 214122;2.浙江古越龙山绍兴酒股份有限公司,浙江绍兴 312000;3.国家黄酒工程技术研究中心,浙江绍兴 312000;4. 江苏省产业技术研究院食品生物技术研究所,如皋江大食品生物技术研究所有限公司,江苏南通 226500)
黄酒作为中国古老的、特有的酒种,其起始可以追溯到五千年以前[1]。因为黄酒“低度、营养、保健”,因而被广大消费者赞誉为“液体蛋糕”,在中国的江浙沪区域黄酒在酒类消费当中始终排名前列[2]。黄酒由于其特殊的开放式以及浓醪发酵形式,使得参与发酵的微生物菌群具有多样性的特点,酵母、霉菌和细菌等均参与其中[3-4]。目前对于机械黄酒发酵过程中的菌株分离主要集中在细菌类,尤其是乳酸菌,而对于真菌的分离报道较少[5-7]。
黄酒中的挥发性风味物质是酒体评价的重要标志之一。众所周知,随着黄酒酒龄的增长,挥发性风味物质的变化而使得黄酒的风味变得愈加醇厚[8-9]。目前认为黄酒中的挥发性风味物质的主要来源是原料带入和微生物发酵产生。在黄酒发酵过程中,微生物代谢将发酵醪液中的糖、有机酸、氨基酸、风味前体物质转化为醇类、酸类、酯类、醛酮类、杂环类等挥发性风味物质,在发酵过程中产生的风味物质多种多样,对于黄酒的整体风味极具影响,因此微生物的发酵作用是造成黄酒风味成分复杂的重要原因之一[10-12]。
本研究取古越龙山的机械黄酒发酵第1、2、3、4、5、7、10、15、22 d醪液,利用传统微生物分离培养方法,分析黄酒发酵过程中细菌及真菌的组成;并分析菌株在黄酒模拟液中生长情况,研究其在黄酒模拟液中产挥发性风味物质的特性。从而全面的了解在发酵过程中微生物的组成,并更加实际的探讨了微生物在黄酒发酵过程中利用黄酒生产所用原料所产生的挥发性风味物质,为科学管理生产、提高黄酒风味品质奠定基础。
1 材料与方法
1.1 材料与仪器
发酵醪液 绍兴古越龙山黄酒厂,发酵第1、2、3、4、5、7、10、15、22 d,取样后于4 ℃冰箱暂存;麦曲、糯米、糖化酶、液化酶等 绍兴古越龙山酒厂;标准品:乙醛、异丁醛、乙酸乙酯、3-甲基丁醛、异丙醇、丁酸乙酯、3-甲基丁酸乙酯、异丁醇、乙酸异戊酯、戊酸乙酯、正丁醇、异戊醇、己酸、己酸乙酯、乳酸乙酯、正己醇、辛酸乙酯、正庚醇、糠醛、苯甲醛、2,4-二甲基苯甲醛、1-辛醇、γ-丁内酯、癸酸乙酯、苯甲酸乙酯、丁二酸二乙酯、苯乙酸乙酯、月桂酸乙酯、正己酸、β-苯乙醇、庚酸、苯酚、乙偶姻、γ-壬内酯、4-乙基愈创木酚、正辛酸、肉桂酸乙酯、γ-癸内酯、十五酸乙酯、丁香酚、壬酸、4-乙烯基愈创木酚、棕榈酸乙酯、癸酸、2,4-二叔丁基苯酚 纯度>99%,上海安普科学仪器有限公司。
Thermo Micro CL17型高速离心机 美国赛默飞世尔科技公司;紫外可见分光光度计 优尼柯(上海)仪器有限公司;CX31RTSF型显微镜 日本OLYMPUS公司;立式压力蒸汽灭菌锅 上海博迅实业有限公司医疗设备厂;恒温培养箱 上海森信实验仪器有限公司;恒温摇床 上海合恒仪器设备有限公司;低速大容量多管离心机 无锡瑞江分析仪器有限公司;Thermo Fisher Trace GC-MS 赛默飞世尔科技有限公司。
1.2 实验方法
1.2.1 微生物的分离与纯化 霉菌分离培养基:PDA 固体培养基。酵母分离培养基:YAP固体培养基:葡萄糖1%,蛋白胨1%,酵母膏1%,氨苄青霉素,1%丙酸钠,琼脂2%(注:氨苄青霉素钠为细菌抑制剂,用量为100 μg/mL不可高温加热)。细菌分离培养基:LB固体培养基:牛肉膏3‰,蛋白胨1%,氯化钠5‰,琼脂2%。MRS固体培养基:牛肉膏1%,蛋白胨1%,酵母膏5‰,葡萄糖2%,吐温80 0.1‰,醋酸钠 5‰,磷酸氢二钾2‰,柠檬酸二铵2‰,硫酸镁0.58‰,硫酸锰0.28‰,琼脂2%[13-14]。
以上培养基均自然pH,121 ℃灭菌20 min。黄酒发酵醪液样品稀释到合适的梯度,每梯度3个重复,涂布上述5种培养基平板,分别进行好氧培养与厌氧培养。每天观察菌落形态并挑选出形态不同的微生物进行划线纯化培养,最后经3次划线纯化得到纯培养物。比较各纯培养物形态,剔除形态一致的纯培养物。
1.2.2 分离微生物菌株鉴定
1.2.2.1 利用CTAB法提取菌株DNA 菌株培养液,每1 mL分装于2 mL EP管中,加入10 μL溶菌酶(50 mg/mL),37 ℃条件放置30 min;加入125 μL 10%的SDS溶液,立即加入5 μL蛋白酶K(20 mg/mL),混均后 65 ℃水浴2 h(每隔10 min上下颠倒混均样品);6000×g离心10 min,取上清液。之后加入700 μL CTAB提取缓冲液(2% CTAB,1.4 mol/L NaCl,1 mol/L Tris-HCl,0.5 mol/L EDTA),混均后65 ℃水浴1 h,每隔10 min上下颠倒混均样品[15]。300×g低速离心5 min,取清液而舍弃上面泡沫层及下面的杂质。300×g低速离心5 min,取清液而舍弃上面泡沫层及下面的杂质。之后用等体积的氯仿-异戊醇(体积比24∶1)混均后于4 ℃条件下,12000×g离心10 min,重复操作2~3 次,至基本无中间杂质层;用0.6倍体积的异丙醇沉淀DNA,轻轻混匀后于-20 ℃沉淀1 h后于冷冻离心机12000×g下4 ℃离心10 min,收集核酸沉淀;加入1 mL 70%的乙醇,于4 ℃条件下,12000×g离心10 min,洗涤沉淀2~3 次,倒扣,去除过量水分,于37 ℃干燥DNA。加50 μL dd水溶解沉淀,得到的DNA样品置于-20 ℃冰箱保存备用。
1.2.2.2 进行PCR扩增 细菌:通用引物,上游引物序列为27f:5′-AGAGTTTGATCCTGGCTCAC-3′,下游引物序列为1492r:5′-TACGGCTACCTTGTT ACGACTT-3′,扩增片段大小为1500 bp左右。细菌PCR反应体系参照文献[16]。
真菌:通用引物,上游引物序列为NS1:5′-GTAGTCATATGCTTGTCTC-3′,下游引物序列为NS8:5′-TCCGCAGGTTCACCTACGCGA-3′,扩增片段大小为1700 bp左右;真菌PCR反应体系参照文献[17]。
1.2.2.3 序列分析及系统发育树构建 PCR产物送至南京金斯瑞生物技术有限公司进行测序对微生物进行生物性鉴定。测序所得到序列在NCBI中GeneBank上进行BLAST比对,确定与已知序列的同源关系。采用MEGA6.1系统发育与进化分析。
1.2.3 黄酒模拟液及菌株发酵液制备 实验采用黄酒原料制作黄酒模拟液。取0.100 kg米粉,加入0.86 g麦曲及2 L清水,添加2 mL液化酶,90 ℃液化2 h;用乳酸调节pH至4.0,加入2 mL糖化酶,60 ℃糖化2 h作为黄酒模拟液。
1.2.3.1 酵母及细菌种子液及发酵液制备 一级种子液制备:从甘油保藏管中挑取一环于50 mL液体培养基上,酵母接种至液体YPD,30 ℃培养,好氧细菌接种至液体LB,37 ℃培养;厌氧细菌接种至液体MRS,37 ℃厌氧培养;菌株均培养24 h。上述培养菌株,再按照接种量5%转接一次,作为一级种子液。
二级种子制备:取一级种子液5 mL接种至50 mL黄酒模拟液中,30 ℃静置培养,分别在2、5、8、12、20、30、40、48、60 h摇匀取样,测定OD600值。绘制各菌在黄酒模拟液中的生长曲线,以各菌的生长稳定期初始时刻时菌液作为二级种子液。
发酵液制备:吸取培养各菌二级种子液5 mL接种至装有50 mL黄酒模拟液100 mL离心管中,30 ℃静置培养120 h。
1.2.3.2 霉菌发酵液制备 从甘油保藏管中挑取一环菌株划线于PDA标准固体培养平板上,30 ℃培养,待长出菌苔后划线至茄形瓶PDA标准固体培养基内,30 ℃培养48 h,用无菌水洗出孢子,得到孢子悬浮液,振荡混匀后于显微镜下进行血球板计数,调整孢子浓度为107个/mL,吸取10 mL孢子悬浮液接种至装有200 mL黄酒模拟液锥形瓶当中,同时锥形瓶当中加入10颗玻璃珠,30 ℃ 200 r/min摇床培养120 h,不定期用力振荡摇匀培养基以防霉菌结成球状。每隔12 h取5 mL发酵液,4 ℃,10000 r/min离心10 min,洗涤沉淀,相同条件下离心,沉淀部分105 ℃烘干至恒重,测菌丝重量。以培养时间为横坐标,菌丝干重为纵坐标,绘制菌株的生长曲线。同样方法得到霉菌孢子浓度为107个/mL,吸取5 mL孢子悬浮液接种至装有50 mL黄酒模拟液100 mL离心管中,30 ℃静置培养120 h。
1.2.4 挥发性风味物质测定 本次研究采用顶空固相微萃取结合气相色谱-质谱联用技术(HS-SPME/GC-MS)测定挥发性风味物质,具体操作参照相关文献并稍有改动[18]。
1.2.4.1 前处理 取发酵液6 mL于20 mL顶空瓶中,加入2.5 g氯化钠及20 μL内标溶液(2-辛醇,浓度为22 mg/L),插入三相萃取头,于50 ℃条件下吸附45 min,250 ℃解吸附7 min,用于GC-MS测定。
1.2.4.2 GC-MS条件 GC色谱柱,TG-WAXMS(30 m×0.25 μm×0.25 mm)。GC进样口温度,250 ℃。GC程序升温,40 ℃保持3 min;6 ℃/min升温至10 ℃。10 ℃/min升温至230 ℃,保持7 min。GC载气,高纯氦气(>99.999%),不分流,流速为1.0 mL/min。MS离子化方式,EI。MS发射电流,50 μA。MS电子能量,70 eV。MS离子源温度,230 ℃。MS传输线温度,250 ℃。MS扫描范围,33~400 amu。
1.2.4.3 定性及定量分析方法 定性:通过与NIST 2.0(Agilent Technologies Inc.)数据库比对,对物质定性。
定量:将各种风味物质标品混合并稀释,配成不同浓度的混合标准溶液,具体标品浓度范围配制参见文献[19],浓度均大于1 μg/L。相同条件下进样,绘制浓度-峰面积标准曲线,通过测定样品中挥发性风味物质峰面积与标样得到的标准曲线峰面积对样品中挥发性风味物质进行定量。对于风味物质含量未能在标曲范围内,以及其他未能购买标准品挥发性风味物质采用2-辛醇作为内标进行半定量计算。
其中:C为样品中被检测到的挥发性风味物质含量;Cis为内标物的含量;A1为样品中被检测到的挥发性风味物质的峰面积;A2为内标物的峰面积。
2 结果与分析
2.1 微生物的分离及生物鉴定结果
2.1.1 细菌分离结果 实验从黄酒发酵醪液中共分离出33株细菌,其中有5株最后鉴定为乳酸菌。由表1可知,发酵醪液中的细菌主要有芽孢杆菌属(Bacillus)、葡萄球菌属(Staphylococcus)、肠杆菌属(Enterobacter)、泛菌属(Pantoea)、魏斯菌属(Weissbacteria)、梭菌属(Clostridium)、乳酸杆菌属(Lactobacillus)等。张凤杰等[6]利用传统培养方法对麦曲、浸米水和黄酒发酵醪中的细菌进行分离和鉴定,共分离出41株细菌,主要为乳杆菌属、片球菌属、醋酸杆菌属和芽孢杆菌属等4个属,在发酵醪液中主要为芽孢杆菌属。胡志明等[7]在黄酒发酵醪液中筛出13种细菌,其中12株是芽孢杆菌属(Bacillus),1株是乳酸菌属(Lactobacillus);冯浩等[20]从黄酒发酵醪液中分离出3株乳酸菌,分别为1株植物乳杆菌(Lactobacillusplantarum)和2株希氏乳杆菌(Lactobacillusjohnsonii);吴春[21]在黄酒醪液中分离出13中原核微生物,均为芽孢杆菌属(Bacillus)。此次研究共从黄酒发酵醪液中筛选分离出17株芽孢杆菌属和5株乳酸菌属细菌,由此可以看出,黄酒发酵醪液中主要为芽孢杆菌属和乳酸菌属。此外,本次研究还筛选分离出肠杆菌属(Enterobacter)等其他菌属,这可能是由于麦曲等原料的制作方式和环境的不同,导致黄酒发酵醪液筛选分离结果的稍有不同。
此外,由表1可知,菌株L12和L26均为Bacillusaerius,L61和L291是同一种菌(Aeribacilluspallidus),L36、L52、L171及L172均鉴定为Bacillusaryabhattai,乳酸菌M9和M34均鉴定为Lactobacillusfermentum。剔除鉴定相似菌株,采用MEGA6.1对发酵醪液中分离培养的细菌测序结果构建系统进化树如图1所示。

图1 细菌系统发育树Fig.1 Phylogenetic relationships of 16S rDNA sequences of bacteria

图2 真菌系统发育树Fig.2 Phylogenetic relationships of 18S rDNA sequences of fungi

表1 细菌生物鉴定比对表Table 1 Sequencing results of the isolated bacterial strains

续表
2.1.2 真菌分离结果 由表2可得,实验从发酵醪液中分离出16株霉菌以及4株酵母,包括伞状毛霉菌,伞枝犁头霉,扩展青霉,娄地青霉,酿酒酵母等。发酵醪液中的霉菌主要是来自于麦曲中[4],目前对于从发酵醪液中分离真菌较为少见,常见是从麦曲中筛选分离出真菌,毛青钟[4]从传统发酵方式的发酵醪液中分离出55株酵母,而本次研究从醪液中筛选分离出4株酵母,由此可以看出传统发酵方式相对机械黄酒发酵方式的更复杂性;陈建尧等[22]从机械麦曲中分离出13个霉菌属,主要为犁头霉属(Absidiacorymbifera)、曲霉属(Aspergillusoryzae)、毛霉属(RhizomucorPusillus)、青霉属(Penicilliumaurantiogriseum)、毕赤酵母属(Pichiaburtonii)等。方华[23]采用传统的微生物分离方法对黄酒麦曲中的真菌进行了分离培养和鉴定,共分离出16株霉菌,其主要霉菌分别是伞枝犁头霉、米曲霉、微小毛霉、米根霉和烟曲霉。而本次研究从发酵醪液中同样筛选分离出犁头霉属(Absidiacorymbifera)毛霉属(RhizomucorPusillus)、青霉属(Penicilliumaurantiogriseum),由此可以推测,发酵醪液中霉菌的主要来源是原料中麦曲。采用MEGA6.1对发酵醪液中分离培养的真菌测序结果构建系统进化树如图1所示所示。

表2 真菌生物鉴定比对表Table 2 Sequencing results of the isolated fungal strains
2.2 黄酒模拟液中微生物的生长特性
2.2.1 黄酒模拟液理化指标 实验测黄酒模拟液基本理化指标如下表3,由表可知,除酒精度外,黄酒模拟液的基本理化指标与黄酒发酵第1 d类似[4]。由于微生物对酒精度的耐受性不同,故而本次实验均控制酒精度为0 °。

表3 黄酒模拟液基本理化指标表Table 3 Basic physical and chemical indexes of the special culture medium
2.2.2 菌株生长曲线 细菌、酵母菌株在黄酒模拟液下的生长曲线如图3~图4,霉菌生长曲线如图5所示。通过对分离微生物在黄酒模拟液中的生长情况监测,发现除乳酸菌外的细菌在24 h内生长均是处于延滞期,在此之后,菌株L211、L311、L31、L18在48 h时达到稳定期;在60 h时,菌株L12、L171、L272、L172、L172、L5、L1、L291、L14、L22、L61达到生长稳定期;72 h时,菌株L36、L341、L101、L72、L2、L35、L201、L3、L71、L26、L15、L212、L8、L14达到生长稳定期。乳酸菌在黄酒模拟液中生长适应较快,均在48 h时到达稳定期。分离纯化酵母菌在19 h均达到生长稳定期,霉菌除去菌株CO1和MY4在48 h达到稳定期,其余霉菌菌株在72 h达到稳定期;此外,除菌株CO1和MY4外,霉菌利用黄酒模拟液生长趋势很一致。

图3 细菌生长曲线图Fig.3 Growth curves of bacteria

图4 酵母菌生长曲线图Fig.4 The growth curves of yeast

图5 霉菌生长曲线图Fig.5 Growth curves of yeast mould
2.2.3 产挥发性风味物质分析 本研究利用顶空固相微萃取(HS-SPME)结合气质联用(GC-MS)菌株产挥发性风味情况,通过与NIST 2.0(Agilent Technologies Inc.)数据库比对,对物质定性,共检测出142种风味物质,通过外标定量和内标法结合分析,对物质进行定量分析。如图6所示,是筛选菌株产总挥发性风味物质含量图;测定未添加菌株的黄酒模拟液的风味,以排除在制作黄酒模拟液中由原料和麦曲带入的风味物质;由图6可知细菌中菌株L311产挥发性风味物质总含量最高,其次是菌株L15;真菌中,霉菌中菌株C01产挥发性风味物质最为突出。此外,比较黄酒模拟液中的风味物质总含量,细菌中菌株L52、L341以及霉菌中菌株C112、C121、C22、C14、C141、P181等未有增长,表明这些菌株产挥发性风味物质能力较弱。分离培养酵母中,Y7菌株产挥发性风味物质最高,达3456.57 μg/L,其他酵母Y3、Y4、Y9产挥发性风味物质总量分别为2985.93、3014.08、3003.18 μg/L。

图6 菌株产挥发性化合物总量Fig.6 Total volatile compounds produced by strains注:CK表示黄酒模拟液,未添任何菌株发酵培养;图中编号以L、M、X起始为细菌,C、MY、P为霉菌;以Y起始为酵母菌。
如表4所示,为菌株所产总挥发性风味物质含量大于480 μg/L的10株菌株,以及酵母菌株Y7。由结果可知,除酵母外,醇类物质中,菌株C01产出最高,总醇类物质含量达275.83 μg/L,而在菌株C01所产醇类物质中,产2,3-丁二醇最为突出,为231.23 μg/L。挥发性酸类物质中,菌株L311产挥发性酸类物质最多,达261.66 μg/L,己酸为菌株L311产出最高,为160.58 μg/L。除此之外,菌株L311在总脂类和总酮醛类化合物产出也最高,分别为28.05和610.92 μg/L。酮醛类物质当中,菌株产乙偶姻明显要高于其他风味物质。总芳香族类化合物含量中,菌株C122产出最高,达到33.96 μg/L。酵母菌株在产醇类物质尤为突出,产总醇类物质达1519.0 μg/L;此外,由于未对乙醇进行研究,所以未列出酵母产乙醇能力。
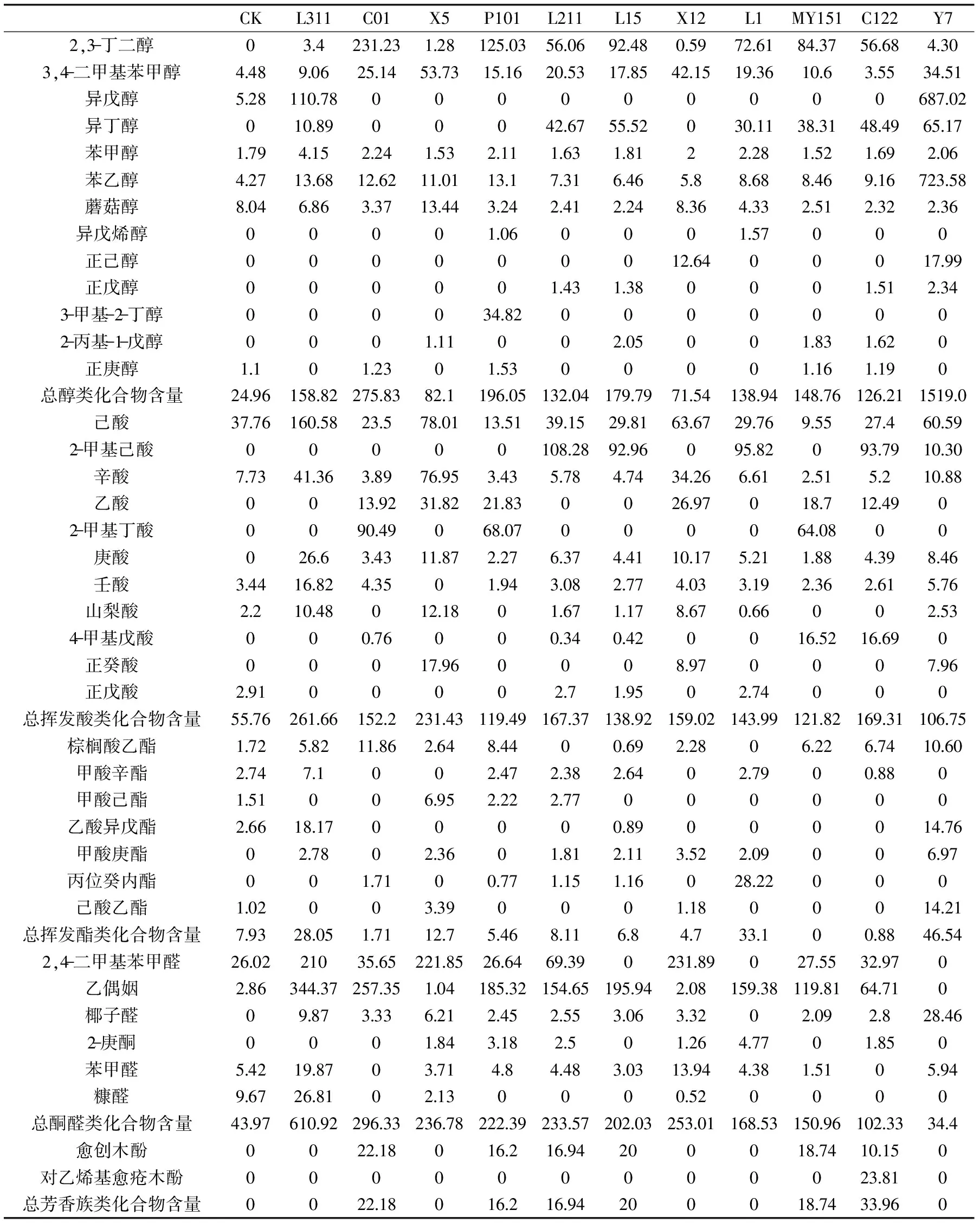
表4 10种菌株产风味表(μg/L)Table 4 Table of 10 strains producing flavor(μg/L)
3 结论与讨论
通过传统的分离培养,从发酵醪液中共筛选出53株菌株,其中有33株细菌、16株霉菌以及4株酵母,传统分离培养的方法可以从个体上探讨微生物菌株的生长特性,从而初步推断菌株在发酵体系当中所作出的贡献,能有效的对现在流行的测序手段进行补充。本次筛选分离出的细菌当中,分别有17株和5株隶属于芽孢杆菌属和乳酸菌属,由此可知,黄酒发酵醪液中可分离培养分离的细菌主要是芽孢杆菌属和乳酸菌属;霉菌中筛选分离出犁头霉属(Absidiacorymbifera)毛霉属(RhizomucorPusillus)、青霉属(Penicilliumaurantiogriseum)等,结合前人研究,可以推断发酵醪液中霉菌主要的来源是原料中的麦曲。本次研究发现,菌株L311(Clostridiumtyrobutyricum)在产风味物质的总含量要明显高于其他细菌,霉菌中菌株C01(Penicilliumexpansum)产挥发性香气物质要高于其他霉菌,而在黄酒模拟中,菌株L311和C01分别在48 h和60 h达到稳定期;酵母菌在利用黄酒模拟液产香气物质明显要高于其他菌株,这与其他研究及其类似[23-24]。
绍兴古越龙山机械化黄酒采用大罐发酵的形式,但是由于发酵罐中的微生物的生长情况多变且复杂,并且由于微生物之间的相互关系的影响以及微生物自身不可培养的特性,醪液当中的微生物不能够完全利用传统的分离培养方法分离得到。因此,对于发酵过程中的微生物的组成情况还不能仅仅依靠传统的分离培养方法,对于不能分离的微生物还需借助现今分子测序手段进行分析。分离培养的微生物菌株利用黄酒模拟液产香气物质可初步分析出微生物的产香气物质的能力和种类,但是对于菌株在真正的发酵体系当中,筛选菌株所能提供的香气成分有待进一步展开分析探讨。

