磷脂酶D缺失对小鼠抗烟曲霉感染过程的影响研究
刘晓宇 张常建 胡颖嵩 陈芳艳 韩黎
(1.军事科学院军事医学研究院,北京 100039;2.解放军疾病预防控制所 医院感染监控中心,北京 100071)
烟曲霉 (Aspergillusfumigatus)是一种腐生性条件致病真菌,可产生大量的孢子,漂浮于空气中,一般情况下对正常人不致病,但容易感染免疫力低下群体,如接受器官移植的患者、化疗放疗的癌症患者、HIV患者、中性粒细胞减少症患者及长期使用激素的患者等,感染后会发展为曲霉肿、支气管肺曲霉病及侵袭性肺曲霉病 (invasive pulmonary aspergillus,IPA)等多种肺部疾病[1]。侵袭性肺曲霉病是一种严重危及生命的肺部感染疾病,病死率极高,未治疗患者可达90%以上、经治疗患者有50%~70%,研究烟曲霉的致病机制及机体对烟曲霉的清除过程非常重要[2]。
磷脂酶D (Phospholipase D,PLD)是一种普遍存在的磷脂酶类,主要作用是水解磷脂酰胆碱 (Phosphatidylcholine,PC)3位末端的酯键产生胆碱和一种重要的第二信使分子-磷脂酸 (Phosphatidic acid,PA)。在哺乳动物中发挥主要作用的PLD有两种亚型,PLD1和PLD2[3]。近期很多研究发现,由PLD催化产生的PA参与多种细胞过程,如细胞骨架重排、膜泡运输、胞吞胞吐作用、细胞自噬等[4],而且癌症、炎症性疾病及微生物感染等疾病患者细胞中都能发现PLD的异常表达及活性改变[5]。磷脂酶D对巨噬细胞的吞噬能力非常重要,此领域已有很多研究[6-9],如文献报道,由于PLD缺陷的巨噬细胞肌动蛋白骨架重排受阻,引起该细胞对假结核病耶尔森菌和IgG包裹颗粒的吞噬能力都显著下降[6]。至于杀菌作用,有文献报道PLD通过参与第二信使二酰甘油的合成参与巨噬细胞对鼠伤寒沙门氏菌的清除,这是细胞通过异体自噬杀灭病原体的途径[10]。而在真菌感染领域宿主巨噬细胞PLD功能的研究却几乎没有。
我们课题组的既往研究发现,在烟曲霉感染人肺泡上皮细胞系A549时,细胞PLD的活性显著升高,PLD抑制剂可以显著抑制烟曲霉孢子内化侵入A549细胞[11],说明PLD在A549细胞应对烟曲霉感染过程中发挥重要作用。那么宿主在体内应对烟曲霉感染时,其PLD有什么重要作用?为阐明在机体免疫功能正常的情况下,PLD缺失对机体应对烟曲霉感染的影响,我们利用pld1基因和pld2基因同时敲除小鼠 (pld1-/-pld2-/-),在小鼠免疫功能正常的情况下,研究小鼠PLD在清除肺部烟曲霉孢子过程中所发挥的作用。因为在机体免疫功能正常的情况下,肺泡巨噬细胞在清除烟曲霉感染时发挥主要作用,所以我们选择巨噬细胞作为研究对象。
1 材料与方法
1.1 菌株
烟曲霉B5233菌株,生长于沙氏培养基 (SDA),37℃培养箱生长3~5 d后,用含0.1%吐温20的磷酸盐缓冲液 (PBST)收集孢子,40 μm滤器过滤去除菌丝,然后用PBST洗两遍后计数,4℃保存。
1.2 实验动物及细胞
pld敲除小鼠 (pld1-/-pld2-/-)由德国BernhardNieswandt教授研究组惠赠。C57BL/6J野生小鼠,雄性,体质量 (20±2) g,SPF级,购自军事科学院军事医学研究院丰台动物中心,两种小鼠均饲养于军事科学院军事医学研究院丰台实验动物饲养中心。实验动物福利伦理审查编号为IACUC-13-2016-002。小鼠BMDM细胞是分离的小鼠骨髓细胞经巨噬细胞集落刺激因子 (M-CSF)诱导分化的成熟巨噬细胞。
1.3 实验方法
小鼠肺部真菌负荷检测pld1-/-pld2-/-小鼠和野生小鼠各取30只,异氟烷麻醉,通过鼻滴方式感染,剂量为5×106CFU/只。感染后6 h、24 h、72 h及7 d分别取6只小鼠解剖,取整个肺组织,称重,加入适量PBS,用匀浆器匀浆,涂布于SDA培养基上,37℃培养箱孵育18~20 h后取出计数并计算真菌负荷。
小鼠支气管肺泡灌洗液 (BALF)收集及其细胞收集和迪夫快速染色 感染前和感染后6 h时pld1-/-pld2-/-小鼠和野生小鼠各取6只,腹腔注射150 μL 25%的乌来糖麻醉,将小鼠仰卧固定,75%酒精擦拭消毒颈部及胸部,剪开颈部皮肤及肌肉,暴露气管,抽取支气管肺泡灌洗液,每次缓慢注入1 mL无菌PBS,重复3次,抽回的液体各放在1个1.5 mL无菌EP管中,2 500 r/min离心10 min,收集上清,用于炎症因子检测;细胞沉淀用无菌PBS重悬,2 500 r/min离心10 min,去除上清,RPMI 1640培养基悬浮细胞,计数,用迪夫快速染色试剂盒 (Diff-Quik Stain)对细胞进行染色。
小鼠骨髓细胞分离和诱导分化pld1-/-pld2-/-小鼠和野生小鼠各取1只,麻醉后断颈法处死,浸入75%乙醇中1~2 min。在超净工作台中分离小鼠的股骨和胫骨,放入装有RPMI 1640培养基的小皿中,用1 mL注射器吸取培养基,将针头尖插入股骨和胫骨中,冲出骨髓细胞。用40 μm细胞筛网过滤,去除碎片。将过滤后的细胞悬液转移至50 mL离心管中,4℃,500 g,离心8 min,沉淀即是骨髓细胞。用RPMI 1640培养基洗涤细胞两次,3~4 mL培养基重悬细胞计数。
用含50 ng/mL M-CSF刺激因子和10% FBS的RPMI 1640培养基培养骨髓细胞,按照2×105个细胞每毫升铺于96孔板,每孔100 μL。在培养的第2天加入50 μL新鲜含刺激因子和血清的1640培养基,继续培养,第4天小心去除悬浮的细胞和培养基,重新加入含50 ng/mL M-CSF的新鲜10% FBS 1640培养基100 μL。在培养的6~8 d得到最大量的BMDM细胞。
制霉菌素法检测BMDM细胞吞噬率 按上述方法接种细胞,pld1-/-pld2-/-小鼠和野生小鼠各接种3组,每组3孔。实验前1天将BMDM细胞培养上清换成含1%FBS的1640培养基,撤走M-CSF,继续培养12 h后吸走培养基,换上新鲜的不含血清的1640培养基,按感染比10∶1加入烟曲霉B5233休眠孢子,第1组感染30 min、第2组感染60 min、第3组感染120 min,吸走上清,PBS洗2~3遍,加入含25 μg/mL制霉菌素的1640培养基,培养4 h,杀死未被吞噬的烟曲霉孢子,弃上清,PBS洗2~3遍,加入100 μL 0.25%的TritonX-100裂解细胞15 min,用枪头将细胞刮下,吹打混匀后取40 μL加入360 μL PBS中混匀,再稀释10倍,取90 μL涂布再SDA平板上,37℃培养箱孵育24 h后取出计数并计算吞噬率,计算方法[(每个板的菌落数÷0.9)×稀释倍数]÷加入孢子数×100。
小鼠BMDM细胞杀菌能力检测 按上述方法接种细胞,pld1-/-pld2-/-小鼠和野生小鼠各接种4组,每组3孔。实验前操作同上,然后按感染比10∶1加入烟曲霉B5233休眠孢子,均感染1 h,弃上清,用PBS洗涤2次,第1组直接裂解细胞涂板,方法同上,其余各组均加上新鲜的1640培养基,第2组继续培养4 h后裂解涂板,第3组继续培养6 h后裂解涂板,第四组继续培养8 h后裂解涂板。37℃培养箱孵育24 h后计数计算杀菌效率,计算方法 (第1组菌落数-第2组、第3组或第4组的菌落数)÷第1组菌落数。
小鼠肺泡灌洗液炎症因子含量检测 采用eBioscience公司的多因子检测试剂盒对BALF中的炎症因子进行检测。
统计分析 每个实验重复3次,所有计数资料以均数±标准差表示,两组间均数比较采用t检验,多组计量资料间的比较采用one-way ANOVA分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 pld1-/-pld2-/-小鼠清除肺组织中烟曲霉孢子的能力下降
免疫功能正常的情况下,感染相同剂量的烟曲霉孢子,随着感染后时间的延长,两种小鼠肺组织中烟曲霉负荷都逐渐下降,但pld1-/-pld2-/-小鼠肺组织真菌负荷始终高于野生小鼠;尽管两种小鼠都能在感染后1周内完全清除肺组织的烟曲霉孢子,但是野生小鼠在感染后第3天肺组织中烟曲霉负荷几乎下降到0,而pld1-/-pld2-/-小鼠需要更长的时间来清除 (见图1a),说明pld1-/-pld2-/-小鼠清除烟曲霉感染的能力较弱。另外,迪夫快速染色结果显示,感染前和感染后6 h,支气管肺泡灌洗液中基本都是巨噬细胞,而感染后6 h,pld1-/-pld2-/-小鼠支气管肺泡灌洗液中可见大量的游离的及被巨噬细胞吞噬的烟曲霉孢子,孢子量显著高于野生小鼠组 (见图1b~c),说明pld1-/-pld2-/-小鼠肺泡灌洗液中巨噬细胞的杀菌能力可能减弱。
2.2 pld1-/-pld2-/-小鼠BMDM细胞吞噬和杀灭烟曲霉孢子的能力降低
为了进一步证明pld1-/-pld2-/-小鼠巨噬细胞的杀菌能力降低,我们分离了小鼠骨髓细胞,将其诱导分化为成熟的巨噬细胞 (BMDM)进行体外巨噬细胞吞噬实验和杀菌实验检测,发现,随着感染时间的延长,两种巨噬细胞吞噬烟曲霉孢子的量均逐渐显著升高,但是pld1-/-pld2-/-小鼠BMDM细胞吞噬孢子的数量始终低于野生小鼠BMDM细胞组 (见图2a);随着杀菌时间的延长,两种巨噬细胞杀灭孢子的数量也逐渐增加,但是当杀菌时间≥6 h时,pld1-/-pld2-/-小鼠BMDM细胞杀灭孢子的数量显著低于野生小鼠BMDM组 (见图2b)。结果表明,pld1-/-pld2-/-小鼠BMDM细胞的吞噬能力和杀菌能力均显著低于野生小鼠 (*P<0.05,**P<0.01,***P<0.001)。
2.3 pld1-/-pld2-/-小鼠应对烟曲霉孢子刺激过程中分泌更多的炎症因子
为了评估感染烟曲霉孢子后pld1-/-pld2-/-小鼠支气管肺泡灌洗液 (BALF)中的炎症因子分泌情况,我们分别在感染前和感染后6、24、72 h和7 d获取BALF进行多种炎症因子检测,结果显示随着感染后时间的延长,炎症因子IL-6、GRO-α及TNF-α含量的变化趋势均为先升高后下降,感染后第7天时都已经恢复至正常水平;检测的几个时间点内,6 h炎症因子含量最高;值得注意的时,感染后6 hpld1-/-pld2-/-小鼠BALF中这些炎症因子的含量均显著高于野生小鼠 (*P<0.05,见图3)。说明pld1-/-pld2-/-小鼠应对烟曲霉孢子刺激过程中可能需要分泌更多的炎症因子来参与杀灭孢子过程。
3 讨 论
烟曲霉是一种腐生真菌,其表面的病原相关分子模式和细菌表面的大为不同,感染所引起的细胞内反应也是不同的。肺泡巨噬细胞和支气管上皮细胞是抵抗烟曲霉感染的第1道防线,对机体及时清除烟曲霉孢子尤为重要[12]。正常情况下,机体肺泡中存在固有巨噬细胞,当孢子被吸入后,肺泡巨噬细胞可以吞噬并杀灭绝大多数的烟曲霉孢子。
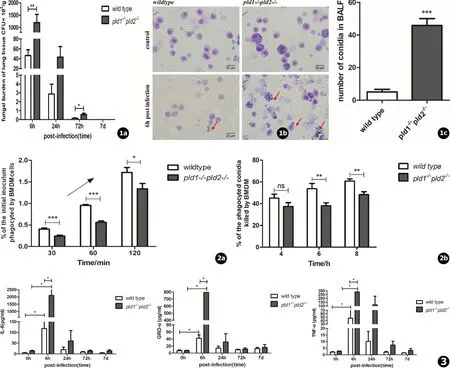
图1pld1-/-pld2-/-小鼠清除肺部烟曲霉孢子能力下降。a.小鼠肺组织烟曲霉负荷;b.小鼠感染烟曲霉6 h后,收集BALF中的细胞和孢子,迪夫试剂快速染色,镜下观察 (bar=25 μm),图中红色箭头指的是烟曲霉孢子;c.对b图视野中孢子数量进行统计 (每组统计20个视野),*P<0.05,**P<0.01,***P<0.001 图2pld1-/-pld2-/-小鼠BMDM细胞吞噬和杀灭烟曲霉孢子的能力下降。a.吞噬实验,图中箭头表示随着吞噬时间的延长,两种小鼠对烟曲霉孢子的吞噬率显著上升;b.杀菌实验 (烟曲霉孢子:BMDM=10∶1) 图3 感染后BALF中炎症因子浓度 (*P<0.05)
Fig.1 PulmonaryA.fumigatusspores eliminating inpld1-/-pld2-/-mice was lower than that in wild mice. a. Fungal burdens in mice lung tissue; b. Diff-Quik Stain results of spores in BALF of mice infected withAspergillusfumigatusfor 6 hours (the red arrow pointed); c. Spore counting of Fig.1b (20 fields were counted each group) Fig.2 BMDM cells ofpld1-/-pld2-/-mice showed decreased ability to phagocyte and killAspergillusfumigatusconidia. a. Phagocytosis: the phagocytosis rate ofAspergillusfumigatusin the BMDM cells increased significantly with the prolongation of the phagocytosis time; b. Fungicidal experiment Fig.3 Expression of cytokines in BALF of mice
近几年已有研究报道,巨噬细胞杀灭烟曲霉的机制不同于经典的吞噬作用和异体自噬作用,而是一种非典型的自噬通路-LC3相关的吞噬作用 (LC3-associated phagocytosis,LAP)[13-14]。我们发现,pld1-/-pld2-/-小鼠巨噬细胞吞噬和杀灭烟曲霉孢子的能力均减弱,说明PLD可能参与LAP过程,也是我们今后的研究方向,研究清楚PLD如何参与LAP杀菌过程,对正确理解巨噬细胞杀灭烟曲霉的机制非常重要。
免疫功能正常的宿主在吸入烟曲霉孢子后会引起轻度而短暂的炎症反应以清除孢子,而我们发现,pld1基因和pld2基因同时缺失后,由于巨噬细胞吞噬杀菌能力以及其他免疫功能的下降,小鼠支气管BALF中的孢子量和整个肺组织中的烟曲霉真菌负荷远大于野生组。在这种情况下,机体可通过分泌更多的炎症因子以募集其他的免疫细胞来清除感染,通过多因子检测,我们发现感染后6 h,pld1-/-pld2-/-小鼠BALF中促炎细胞因子GRO-α、TNF-α和IL-6的含量显著高于野生小鼠。GRO-α是一种趋化因子,可以募集中性粒细胞至肺组织感染部位[15]。TNF-α可以提高中性粒细胞的吞噬能力,而IL-6能刺激参与免疫反应的细胞增值和分化并提高其功能,这都有助于增强机体的免疫力。但是众所周知,过度的炎症反应对机体是不利的,TNF-α和IL-6同时也是促炎因子,参与炎症反应的发生,在机体发生炎症损伤时总是含量较高,如果PLD缺陷的个体受到烟曲霉的持续感染,可能会引起机体急性炎症损伤[16-19]。
我们的研究说明PLD缺失后,肺泡巨噬细胞吞噬和杀灭烟曲霉孢子的能力的下降可能是影响机体抗烟曲霉感染进程的原因之一,同时,PLD缺失后高负荷的烟曲霉可能会引起肺部的炎症损伤。本课题还会进一步评估PLD缺陷对其他免疫细胞募集的影响以及对小鼠肺泡上皮屏障功能的影响,同时,也会展开PLD对免疫缺陷机体应对烟曲霉感染的影响研究。在体外我们会继续研究PLD如何参与巨噬细胞的杀菌能力,还会基于之前的发现研究PLD在上皮细胞应对烟曲霉感染中的作用,为烟曲霉的感染机制及机体的抗感染机制提供有力依据。

