小花棘豆与玉米混贮微生物特性及脱除苦马豆素乳酸菌的筛选
陶雅,李峰,孙启忠,柳茜,高润,徐春城
(1.中国农业科学院草原研究所,内蒙古 呼和浩特 010010;2.中国农业大学工学院,北京 100083;3.凉山彝族自治州畜牧兽医研究所,四川 西昌 615042)
小花棘豆(Oxytropisglabra) 是豆科棘豆属多年生草本植物,根系发达,多生长在典型草原、荒漠草原以及荒漠低湿地区,是轻度耐盐碱植物[1-3]。就目前的资料报道来看, 全国棘豆生长面积不下334万 hm2,据测算, 产草量约1050 kg·hm-2(按中等情况)[4]。小花棘豆在整个生长期均有毒,在干旱年份,其他牧草生长稀疏,而小花棘豆由于根系发达生长茂盛,放牧牲畜常常由于饥饿而被迫采食,最终造成中毒,给牧民造成严重的经济损失。然而许多有毒植物是重要的经济作物,或具有潜在的重要经济价值,属于应用植物范畴。小花棘豆营养丰富,蛋白质含量高,富含多种矿物质,是具有丰富营养价值的饲料资源[5],如能作为饲料利用,可产生巨大的经济效益。
青贮是牧草最常利用的贮藏方式之一,由于小花棘豆可溶性碳水化合物含量低,蛋白质含量和缓冲能高,单独青贮不易成功,与玉米(Zeamays)混贮是提高豆科等高蛋白含量牧草青贮成功率的手段之一[6-7]。成功的青贮还可以降低有毒植物中生物碱等有毒化合物的含量[8-9],减少动物采食后中毒风险[10],经青贮饲喂试验发现,青贮后的小花棘豆不仅不引起山羊中毒,而且还有较好的育肥效果[11]。青贮过程是各种微生物共同作用的结果[12-14],目前单一青贮中微生物活动特性研究较多[15-17],而混合青贮对发酵体系内微生物的影响报道较少,不同比例混贮如何通过改变微生物特性,提高青贮成功率尚不明晰。
部分研究发现恶臭假单胞菌(Pseudomonasputida)、嗜麦芽寡养单胞菌(Stenotrophomonasmaltophilia)、缺陷短波单胞菌(Brevundimonasdiminuta)等具有降解苦马豆素的活性[18-20]。在青贮过程中乳酸菌起主导作用,促进发酵,是一种有益微生物,其是否能降低苦马豆素活性尚不明确,此外小花棘豆青贮体系中的乳酸菌对苦马豆素有很强的适应性,因此从其中挑选具有降低苦马豆素活性的乳酸菌成功率较高。本试验旨在研究小花棘豆与全株玉米按不同比例混贮微生物特性及乳酸菌多样性差异,挖掘具有脱除苦马豆素活性的乳酸菌,为小花棘豆青贮饲料的开发利用提供理论参考。
1 材料与方法
1.1 试验材料
青贮原料收获于2015年8月12日,小花棘豆采自内蒙古鄂尔多斯市乌审旗天然草地(N 38.38°、E 109.03°),于盛花期刈割,全株玉米于蜡熟期采自附近农户田间。
1.2 试验设计
试验采用完全随机设计,共设8个处理,每个处理3个重复,详见表1。

表1 试验设计Table 1 Experimental design
1.3 青贮调制
分别将收获后的小花棘豆和全株玉米切短至2~3 cm,按不同处理比例充分混合均匀,以四分法选取适量的样品装入聚乙烯袋内,每袋约200 g,用真空包装机抽成真空并封口,室温条件下放置60 d 后开封取样分析。
1.4 试验方法
1.4.1微生物计数 采用稀释平板涂布法对不同比例混合的小花棘豆与玉米原料以及青贮材料中微生物菌群进行计数。称取5 g待测样品,放入装有45 mL 无菌水的三角瓶内,震荡均匀,并用无菌水进行10倍梯度稀释,分别吸取稀释10、103和105倍的菌悬液20 μL,均匀涂于MRS、BLB、NA和PDA平板培养基(广东环凯微生物科技有限公司)上,涂菌后的MRS平板于37 ℃下厌氧培养48 h,计测生长出的乳酸菌菌落数,BLB、NA和PDA平板则直接置于37 ℃恒温培养箱内,48 h后分别计测肠细菌、好氧细菌、酵母菌和霉菌的菌落数量。
1.4.2乳酸菌的分离与纯化 挑取MRS培养基上生长的典型单菌落,在MRS平板上反复划线分离,直到获得该菌的纯培养。分别对分离出的菌株进行革兰氏染色[21]和过氧化氢酶试验[22]。并认定呈革兰氏阳性、过氧化氢酶阴性的菌株为疑似乳酸菌,-80 ℃下保存备用。
1.4.3乳酸菌生理生化特性 乳酸菌发酵葡萄糖产气试验参照凌代文等[22]方法进行。将待测菌株的24 h培养物接种到不同温度(10、15、40、45 ℃)、pH(3.0、3.5、4.0、4.5、5.0、7.5、8.0)和NaCl 浓度(3.0%和6.5%)的MRS液体培养基中,观测生长情况[23]。利用API 50CH试剂条检测乳酸菌对49种碳源发酵特性。
1.4.4乳酸菌菌株的16S rDNA序列分析及系统进化树的构建 利用天根细菌全基因组DNA 提取试剂盒提取待测乳酸菌的全基因组DNA,并以该DNA为模板,应用27f(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492r(5′-AAGTCGTAACAAGGTAACC-3′)引物序列对乳酸菌16S rDNA 进行PCR扩增,PCR反应体系(50 μL)为:引物27f和1492r(10 μmol·L-1)各2 μL,模板5 μL,2×Taq PCR MasterMix 25 μL,加ddH2O补充至50 μL。PCR扩增程序为:94 ℃,预变性5 min;94 ℃,变性50 s;55 ℃,退火50 s;72 ℃,延伸2 min,30个循环后,72 ℃延伸10 min,4 ℃保存。利用1.5%琼脂糖凝胶电泳检测PCR扩增产物,并送上海桑尼生物科技有限公司进行一代测序。
本系统集多生命体征采集传感技术、无线传感技术、MCU、数字信号处理技术、远程Web 监护平台开发、包括生理数据的采集与传输、服务器搭建、数据库的建立以及基于机器学习的数据建模与数据分析可视化的效果展示等组成,其中系统组成图如图4 所示。
1.5 乳酸菌对苦马豆素脱除率的测定
称取1 kg全株小花棘豆和1000 mL 去离子水置于破壁机内打碎成浆,用6层纱布过滤,制成小花棘豆汁液,121 ℃ 灭菌15 min。将活化后的乳酸菌用无菌水调节菌体浓度至1.0×109cfu·mL-1,将其分为两组,Ⅰ组菌悬液不做任何处理,Ⅱ组菌悬液在100 ℃加热15 min 灭活,分别取Ⅰ、Ⅱ组菌悬液3 mL 离心(6000 r·min-1,4 ℃,5 min)收集菌体,加入3 mL灭菌的小花棘豆汁液中,于37 ℃发酵48 h,离心(6000 r·min-1,4 ℃,5 min),过膜(0.22 μm 水溶膜)后待测,同时设无菌对照组,对照组苦马豆素含量为48 μg·mL-1。
采用气相色谱内标法测定小花棘豆发酵液中的苦马豆素含量,气相色谱仪:瓦里安(varian),3800GC型;色谱柱:AT.SE-54石英毛细管柱(30 m×0.25 mm×0.33 μm);检测器:FID;载气:氮气;进样口温度:260 ℃;柱温:210 ℃;FID:280 ℃;载气流速:2 mL·min-1;分流比:30。衍生化处理:衍生化试剂(BSTFA∶TMCS=99∶1),与待测液以1∶1 比例混合,衍生化3~5 h,用0.45 μm滤膜过滤,进样。

1.6 数据分析
采用SPSS 16.0软件进行统计分析,利用一般线性模型作两因素方差分析,并作Duncan多重比较。将测序获得的菌株序列信息利用Blast检索系统在GenBank数据库和EzTaxon 数据库中进行比对,选择适当数量与目的基因序列同源性较高的标准菌株16S rDNA序列,与待测菌株的16S rDNA序列共同用MEGA 6.0软件构建系统进化树。
2 结果与分析
2.1 小花棘豆与玉米混贮前后微生物菌群对比
小花棘豆与玉米按照不同比例混合原料中乳酸菌数量随着玉米混入量的增加逐渐升高,小花棘豆上附着的乳酸菌数量只有105cfu·g-1FM,当混合比例为T3时乳酸菌的数量达到了106cfu·g-1FM,原料中乳酸菌数量显著低于青贮饲料中的乳酸菌数量(P<0.05),青贮饲料各处理间乳酸菌数量无显著差异。原料中的肠细菌约为106cfu·g-1FM,各处理间无显著差异,经过青贮发酵后肠细菌均未检测到。好氧细菌数量在原料和青贮饲料中均随着玉米比例的增加逐渐减少,但并未因青贮发酵而显著降低。酵母菌数量在各处理间均无显著差异,青贮饲料中的酵母菌略低于原料,但是无显著差异。原料中的霉菌数量随着玉米混入比例增加逐渐增加,而青贮饲料中的霉菌数量均在检出线以下(表2)。
2.2 小花棘豆与玉米按不同比例混贮对乳酸菌多样性的影响
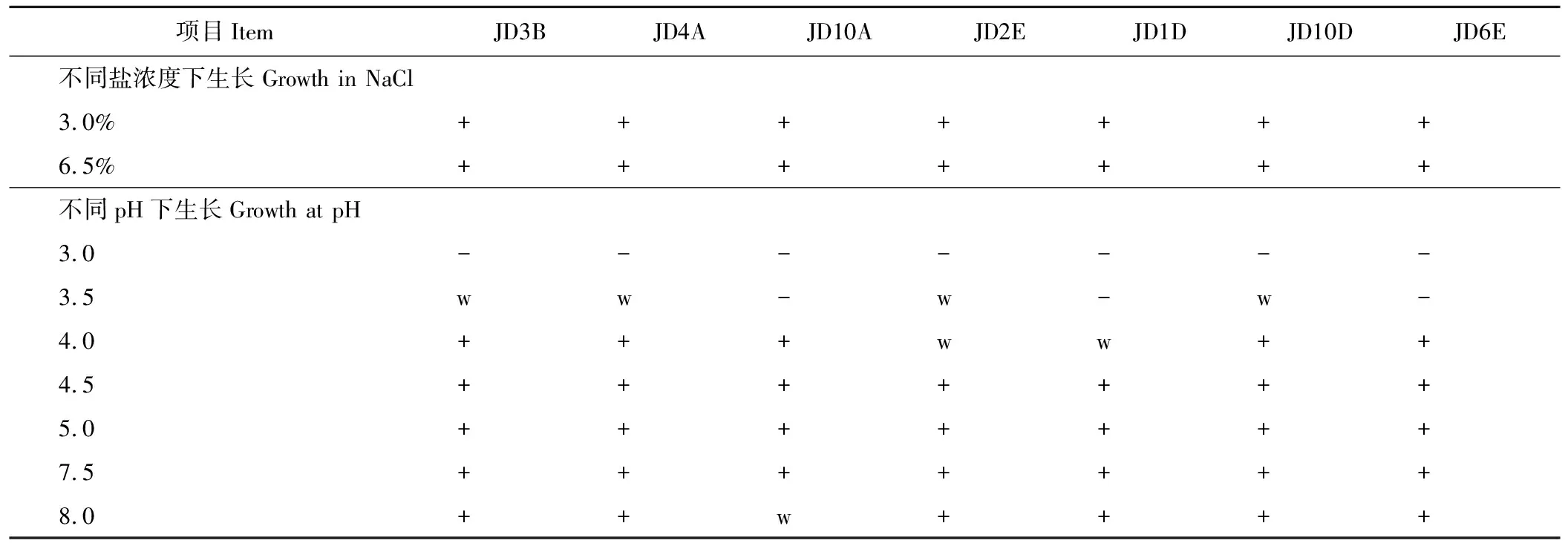
2.2.1乳酸菌的生理生化特性 从小花棘豆与玉米混贮试验分离出的乳酸菌生理生化特性见表3和4,利用生理生化特性和碳源发酵实验结果,将原料中分离出的4株乳酸菌菌株划分为3个组:Ⅰ组代表菌株JD3B,Ⅱ组代表菌株BJD4A,Ⅲ组代表菌株CJD10A,将从青贮饲料中分离出的9株乳酸菌菌株划分为4个组:Ⅳ组代表菌株JD2E,Ⅴ组代表菌株JD1D,Ⅵ组代表菌株JD10D和Ⅶ组代表菌株JD6E。所有菌株均表现为革兰氏阳性和过氧化氢酶阴性,除JD1D发酵葡萄糖产生气体,为异型发酵乳酸菌外,其余菌株均为同型发酵乳酸菌;菌株JD3B、JD4A和JD10A为乳酸杆菌,JD2E、JD1D、JD10D和JD6E为乳酸球菌;各菌株在5 ℃环境下不生长,但均可在40 ℃环境中生长,菌株JD2E和JD1D能够在10 ℃环境下生长,JD4A和JD10D可在45 ℃下生长;在含3.0%和6.5% NaCl 的环境中,各菌株均可正常生长;所有菌株不能在pH值为3.0的环境中生长,大部分菌株可在pH 值为4.0~8.0的范围内生长,只有JD2E、JD1D在pH 值4.0、JD10A在pH 值8.0环境下微弱生长。

表2 小花棘豆与玉米混贮微生物数量对比Table 2 Microbiological analysis of the O. glabra and corn mixed silage in different proportions (log cfu·g-1 FM)
SEM: 均值标准误差 Standard error of means; ND: 未检出 Not detected; NS: 无显著差异 Not significant; *:P<0.05; **:P<0.01;同列不同小写字母表示差异显著(P<0.05)。 The different lowercase in the same column indicate significant differences at theP<0.05 level.

表3 乳酸菌的生理生化特性Table 3 The physiological biochemical characteristics of lactic acid bacteria strains
续表3 Continued Table 3
+: 生长Positive; -: 不生长Negative; w: 微弱生长Weakly positive.

表4 乳酸菌API 50 CH 碳源发酵Table 4 API 50 CH fermentation patterns of lactic acid bacteria strains
+: 90%菌株为阳性90% or more of the strains are positive; -: 90% 菌株为阴性90% or more of the strains are negative; w: 弱阳性Weakly positive.
各代表菌株对49种碳源利用情况见表4,菌株JD3B可以利用21种碳源,JD4A可以利用19种碳源,JD10A可以利用25种碳源,JD2E可以利用30种碳源,JD1D可以利用13种碳源,JD10D可以利用27种碳源,它们的共同点是均可利用L-阿拉伯糖、核糖、葡萄糖、果糖、N-乙酰-葡糖胺、熊果苷、七叶灵、纤维二糖和麦芽糖这9种碳源,而菌株JD6E仅可以利用半乳糖、葡萄糖、果糖、七叶灵、纤维二糖、麦芽糖、蔗糖和淀粉8种碳源,该菌株可以很好地发酵淀粉, 其他菌株则表现为不能利用或弱阳性;所有菌株都不能利用赤廯醇、D-阿拉伯糖、L-木糖、阿东醇、β-甲基-D-木糖甙、山梨糖、卫矛醇、肌醇、菊糖、肝糖、木糖醇、D-来苏糖、D-塔格糖、D-岩糖、L-岩糖、L-阿拉伯糖醇;仅菌株JD2E能够利用鼠李糖和棉籽糖,较菌株JD3B,JD2E可以更好地利用鼠李糖、山梨醇、蜜二糖、松三糖、棉籽糖、D-松二糖和葡萄糖酸盐。JD10A可以利用其他菌株利用不了的α-甲基-D-葡萄糖苷,相对于其他2株球菌,该菌株能够更好地利用蜜二糖,但是却发酵不了蔗糖;7株乳酸菌中仅有JD10D 不能利用D-木糖,JD1D不能利用乳糖、半乳糖、甘露糖、柳醇、龙胆二糖和海藻糖。

表5 乳酸菌株 16S rDNA 序列Blast比对Table 5 Blast results of 16S rDNA sequences of lactic acid bacteria strains

图1 基于 16S rDNA 序列分析结果的系统发育树Fig.1 Phylogenetic tree based on the 16S rDNA sequences
由系统发育树(图1)可以看出,7组乳酸菌代表菌株隶属于Lactobacillus和Lactococcus2个属。Lactobacillus包括菌株JD2E、JD1D、JD10D和JD6E,其中JD1D与Lactobacillusbrevis构成同一分支,相似度达99.39%;菌株JD10D与Lactobacilluspentosus的系统进化位置最接近,相似度高达100.00%;菌株JD2E与Lactobacillusplantarumsubsp.plantarum处于同一进化分支上,相似度为99.89%;菌株JD6E与Lactobacillusamylovorus构成同一分支,相似度达99.58%。菌株JD3B、JD4A和JD10A隶属于Lactococcus,分属于3个种,其中JD10A和Lactococcustaiwanensis构成一个分支,序列相似度为99.86%;JD3B与Lactococcuslactissubsp.hordniae处于同一进化分支上,相似度可达99.93%;JD4A与Lactococcuslactissubsp.lactis的系统进化位置最接近,相似度为99.86%。
2.2.3小花棘豆与玉米按不同比例混贮对乳酸菌多样性的影响 小花棘豆与玉米按照不同比例混合原料与青贮饲料中存在的乳酸菌见表6,从各处理原料中分离出的乳酸菌均为乳酸球菌,包括Lac.lactissubsp.hordniae、Lac.taiwanensis和Lac.lactissubsp.lactis其中Lac.lactissubsp.hordniae为优势种类,存在于每个处理的原料中,Lac.taiwanensis仅存在于处理T6中,Lac.lactissubsp.lactis仅存在于玉米原料上,当玉米混入比例升高时,原料中乳酸菌多样性有所增加。经过青贮发酵后的青贮饲料中分离出的乳酸菌均为乳酸杆菌,包括L.brevis、L.pentosus、L.plantarumsubsp.plantarum和L.amylovorus, 其中L.plantarumsubsp.plantarum为优势种类,存在于每个混贮比例的青贮饲料中,其次是L.brevis,除了玉米、小花棘豆单贮以及处理T7中未分离到,存在于绝大部分混合比例的青贮饲料中,L.amylovorus只存在于小花棘豆含量高的青贮饲料中(T1和T2),而L.pentosus仅存在于处理T3的青贮饲料中,当玉米混入比例升高时,青贮饲料中乳酸菌多样性有所下降。

表6 乳酸菌多样性Table 6 Diversity of lactic acid bacteria
2.3 脱除苦马豆素乳酸菌的筛选
从原料和青贮饲料中分离出的乳酸菌株在小花棘豆汁液中发酵48 h后对苦马豆素脱除率见表7,不同乳酸菌菌株对苦马豆素的脱除率均高于85%,其中菌株JD6E、JD4D、JD10D 、JD2E和JD1F对苦马豆素的脱除率高达100.00%。经过热处理后,菌株JD10D和JD2E对苦马豆素的脱除率几乎没有变化,分别为100.00%和97.76%,而其他菌株对苦马豆素的脱除作用均显著减弱(P<0.01),脱除率下降31.76%~100.00%,其中菌株JD6D和JD1E经过热处理后对苦马豆素的脱除率分别下降到2.17%和0。
3 讨论

表7 不同菌株苦马豆素脱除率Table 7 Percentage of SW decrease rate by different strains fermentation
**,P<0.01热处理组与未处理组对比。
**,P<0.01 comparison between heat treatment and no treatment.
青贮是乳酸菌利用青贮原料中的糖类物质并将其转化成为乳酸,通过降低pH 控制不良微生物生长,从而减少营养物质损失的过程[24]。因此附生于植物表面的微生物,特别是附生的乳酸菌是开启青贮发酵过程的关键因素,并影响青贮发酵品质[25-26]。当青贮原料上附着的乳酸菌数量达105cfu·g-1FM时才能达到良好的发酵效果[27],新鲜牧草上附生的乳酸菌数量一般为104~105cfu·g-1FM,玉米上附生的乳酸菌数量高达106~107cfu·g-1FM,较其他牧草提高了30%[28-29],本研究中小花棘豆上附生的乳酸菌数量为105cfu·g-1FM,玉米上附着的乳酸菌数量为106cfu·g-1FM,将二者混合可提高青贮原料中的乳酸菌数量,当玉米混入比例达到20%时,原料中乳酸菌的数量可达到106cfu·g-1FM,可以更好地促进乳酸发酵。青贮60 d后,各混合处理乳酸菌数量均有所上升,但没有显著差异,均达到107cfu·g-1FM,即发酵时间充分时,各混合处理青贮前乳酸菌数量虽有异,却并不会影响最终乳酸菌的数量。这可能是由于青贮进入稳定期时,由于受到低pH和乳酸发酵产物的抑制,乳酸菌数量会从其峰值下降[30],虽然峰值及出现时间不同,但当发酵完成后pH等条件相似时乳酸菌数量也相差不多。有研究认为青贮发酵是否充分与青贮前原料中乳酸菌的种类和数量无关[31],但大量研究证实青贮前乳酸菌的种类和数量能够影响青贮发酵品质[32-33]。除乳酸菌外好氧细菌、肠细菌、酵母菌和霉菌是植物表面附着的主要微生物,数量分别为>107cfu·g-1FM,103~106cfu·g-1FM、103~105cfu·g-1FM和103~104cfu·g-1FM。本研究中小花棘豆与玉米按照不同比例混合原料中好氧细菌、肠细菌、酵母菌和霉菌的数量分别为106~107cfu·g-1FM、105~106cfu·g-1FM、105~107cfu·g-1FM和103cfu·g-1FM,基本与前人研究相符[30],只有酵母菌数量略高。经过青贮发酵,肠细菌和霉菌由于酸性及厌氧环境的产生基本消失[30],但好氧细菌和酵母菌变化不显著,酸性和厌氧环境只是抑制其生长和增殖,但并没有降低数量[34]。添加玉米虽然对各处理原料和青贮饲料中酵母菌数量影响较小,但是可以显著降低好氧细菌的数量,从一定程度上有助于提高青贮成功率。
Lin等[31]研究发现新鲜玉米植株表面附着的乳酸菌主要为Lactobacillusplantarum,Pediococcuspentosaceus,Enterococcusfaecium和Enterococcusfaecalis,Ruser[35]对大量切碎的玉米样品分析认为Lactobacillus和Leuconostoc是主要类群。Ennahar等[36]发现饲料稻青贮中同型发酵的Lactobacillus、Lactococcus和异型发酵的Leuconostoc的乳酸菌数量较多, Pang等[23]从玉米秸秆青贮中分离的乳酸菌中L.plantarum,L.pentosus和L.brevis占86%是优势种类。本研究从各处理原料中只分离出了乳球菌属的3个种,分别是Lac.lactissubsp.hordniae、Lac.taiwanensis和Lac.lactissubsp.lactis。从青贮饲料中分离出乳杆菌属的4个种,L.brevis、L.pentosus、L.plantarumsubsp.plantarum和L.amylovorus。可见在新鲜样品中乳酸球菌为优势种类,经过青贮发酵后,乳酸杆菌演替为优势菌群[34],有研究表明,青贮原料在收获制作成青贮饲料后,最先进行发酵的是Streptococcusfaecalis和Leuconostocmesenteroides,接着被更耐酸的菌株,如L.plantarum、L.brevis和Lactobacillusbuchneri等取代[37],本研究从原料中分离出的3株乳酸球菌在pH 4.0条件下均可生长良好,其耐酸性能并不亚于青贮饲料中分离出的乳酸杆菌,因此青贮过程中pH下降并不是导致乳酸球菌被乳酸杆菌取代的原因。L.plantarumsubsp.plantarum可利用的碳源种类最多,达30种,较青贮饲料中分离出的其他菌株能够更好地利用二糖、三糖等多糖,可使其在有限的碳源中更加迅速地生长与增殖,这也可能是该菌成为青贮饲料中优势种群的原因之一。随着玉米混入比例增加,原料中分离出的乳酸菌种类从1种增加到了2种,乳酸菌多样性增加可以更全面地促进发酵,提高初始发酵速度;而在青贮饲料中随玉米比例升高,分离得到的乳酸菌种类则从2~3种降低到了1种,乳酸菌多样性下降,这可能是由于混合原料中可溶性碳水化合物含量越高,乳酸菌可利用的发酵底物就会越充足,乳酸菌发酵形成的酸类物质增加,导致青贮发酵体系的pH 下降,可以生长的乳酸菌种类逐渐减少,使菌群趋于单一化。
微生物对有毒有害物质的脱除作用可分为吸附作用[38-39]和生理生化代谢作用[40-42],吸附作用通过减少动物肠道对有毒物质的吸收降低毒害作用,而生理生化代谢作用则是直接降解或转化有毒物质含量来降低毒害作用。本研究中乳酸菌对苦马豆素均有脱除作用,且经过热处理灭活后,部分菌株JD10D和JD2E对苦马豆素的脱除率几乎没有变化,说明该菌株对苦马豆素的脱除作用与菌体活性无关,是一种物理性质的吸附作用。Haskard等[43]认为乳酸菌可以通过一种较弱的非共价键吸附黄曲霉毒素B1,韩鹏飞等[44]指出微生物吸附真菌毒素与其复杂的细胞壁结构相关,通过不同的作用力形成微生物-毒素的复合体。除去JD10D和JD2E外供试的其他菌株经过热处理后对苦马豆素的脱除作用则显著减弱,苦马豆素含量下降与菌体活力密切相关,说明同时存在一种生理生化代谢作用引起的苦马豆素化学结构的改变,其中该作用最强的菌株为JD6D和JD1E,失去活性后的菌株对苦马豆素几乎没有脱除作用,因此该菌只能通过代谢作用改变苦马豆素化学结构而不能吸附苦马豆素。Takahashi-Ando等[45]研究发现螺旋聚孢属中的Clonostachysrosea可通过产生一种水解酶将玉米赤霉烯酮转化为另一种毒性较低的化合物。此外同一种乳酸菌不同菌株间的吸附能力和生理生化代谢作用也存在差异,菌株JD2E和JD1F均为L.plantarumsubsp.plantarum,对苦马豆素的脱除率高达100%,但是JD2E脱除方式以吸附作用为主,失活菌株吸附率高达97.76%,而JD1F则依靠活性菌体的生理生化代谢作用脱除苦马豆素,失活菌株吸附率仅为4.06%。可见乳酸菌脱除苦马豆素的方式和能力因菌株而异,具有菌株特异性[38]。
4 结论
小花棘豆与玉米混贮可以增加青贮原料中乳酸菌的数量及多样性,降低青贮饲料和原料中好氧细菌的数量,有助于提高青贮成功率;在小花棘豆与玉米混合各处理原料中Lactococcus是青贮发酵的启动菌,其中Lactococcuslactissubsp.hordniae为优势种类,经过青贮发酵到达稳定期后,Lactobacillus演替为优势菌群,其中Lactobacillusplantarumsubsp.plantarum为优势种类;乳酸菌对苦马豆素具有良好的脱除效果,菌株JD10D和JD2E对苦马豆素的吸附脱除作用最强,而菌株JD6D和JD1E对苦马豆素的生理生化降解作用最强,均可用作小花棘豆青贮脱除苦马豆素的发酵菌株。

