紫花苜蓿种带阪崎克罗诺杆菌的分离鉴定及其致病性初步研究
张振粉,苏静,杨成德,师尚礼,花立民,WALAA Mohamaden
(1.甘肃农业大学草业学院,甘肃 兰州 730070;2.草业生态系统教育部重点实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070;3.甘肃农业大学植物保护学院,甘肃 兰州 730070)
种带病原物可通过种子储存在时间上进行延续,可通过商业、生产和科技交流等活动在空间上进行传播[1]。而且种子携带并传播病菌既是众多地区的植物发生新病害的原因,也是导致动物疾病和人类食源性疾病的罪魁祸首[2]。国内外紫花苜蓿(Medicagosativa)种子贸易频繁,增加了种带病原细菌的侵入和传播的风险系数,既限制紫花苜蓿的优质高产[3-5],还是畜产品安全和人类健康的潜在威胁[2,6-7]。
克罗诺杆菌属(Cronobacterspp.)是一类重要的食源性致病菌,Iversen等[8]2008年在国际微生物系统分类杂志上提出创立隶属于肠杆菌科的一个新属,将阪崎肠杆菌(Enterobactersakazakii)归入克罗诺杆菌属,重新命名为阪崎克罗诺杆菌(Cronobactersakazakii)。该菌可引起新生儿急性脑膜炎等疾病,广泛存在于受污染的婴儿配方食品、奶粉、干酪食品、牛肉馅、香肠、蔬菜、谷物类、豆腐、草药和调味料等[9-13]。但是对于非动物及其相关产品来源的阪崎克罗诺杆菌的动物和植物的致病性尚无相关研究。
鉴于紫花苜蓿是肉、奶等动物源性畜产品安全生产的饲料基础,且直接关系到动物和人类的健康和食物安全。探明不同产地紫花苜蓿种带阪崎克罗诺杆菌的含量及其对动物与植物的致病性以及了解该菌株的生物学特性具有重要意义。现将紫花苜蓿种带阪崎克罗诺杆菌的相关研究报道如下,以期为防控其侵入与传播提供理论基础和开拓新思路。
1 材料与方法
1.1 供试紫花苜蓿品种、模式动物及细菌菌株
供试紫花苜蓿材料相关信息见表1。试验于2015-2017年进行。种子样于5 ℃恒温保藏。供试标准细菌菌株阴沟肠杆菌(Enterobacercloacae) ACCC 10523购自中国农业微生物菌种保藏管理中心(Agricultural Culture Collection of China, ACCC),菌株ACCC 10523 分离自人类的脊髓液[5]。
供试动物:洁净级昆明小白鼠[每只净重(20±2) g]由兰州大学动物实验中心提供。
1.2 培养基的制备
胰蛋白胨大豆琼脂/液体培养基(tryptose soya agar/broth, TSA/TSB):配方详见参考文献[14],主要用于紫花苜蓿种带阪崎克罗诺杆菌疑似分离物的分离培养和纯化。

表1 供试紫花苜蓿种子样本的来源及初始质量Table 1 Origin and initial quality of tested seed samples
1.3 紫花苜蓿种带细菌分离
采用常规稀释法分离培养,即分别称取紫花苜蓿种样1 g (约450粒),将种子先用75%的乙醇浸泡2 min,后转入1%的NaClO消毒5 min[15],用无菌水冲洗3~4次转至盛有10 mL无菌水的研钵中研磨后稀释涂板,涂抹无菌水为空白对照,转至30 ℃恒温箱中培养48 h后,挑取疑似分离物纯化直至得到纯培养物并编号备用。
1.4 分离物对紫花苜蓿的致病性测定
1.4.1前期准备 1)对培养皿和滤纸进行灭菌处理;2)选择健康饱满的阿尔冈金紫花苜蓿种子作为供试种样,对其进行表面消毒[15];3)制备菌悬液:在250 mL的三角瓶中制备100 mL的TSB,用接种环将已纯化的幼龄疑似分离物挑取一环接入培养液中,继之在摇床中培养大约12 h,取10 mL菌液在离心机5000 r·min-1下离心10 min后弃上清液,加无菌水清洗再离心,重复3次,然后加入10 mL无菌水振荡混匀后即为菌悬液;4)在灭菌的培养皿(直径90 mm)中铺好无菌滤纸;5)将紫花苜蓿种样用已制备的菌悬液浸泡30 min后备用。
1.4.2皿内发芽侵染 处理组每玻璃培养皿放50粒种子,用无菌水浸泡种样作为对照组;于(28±1) ℃恒温培养。5个重复,观察对照组和处理组种子在培养皿内的生长情况并记录数据。
1.4.3盆栽侵染 1)每个花盆种植10粒紫花苜蓿种子,温室条件下浇无菌水,使其健康生长;2)50 d后,进行接种侵染;3)伤口侵染处理组即为用接种针在种苗上人为造成轻微伤口后接种菌悬液,对照组接种无菌水,每个处理各5盆。
1.5 分离物对动物的致病性测定
将已纯化的所有菌株制备成菌悬液(≈109cfu·mL-1),继之用无菌医用注射器(1 mL)吸取菌悬液0.1 mL,采取腹腔注射法[16]将0.1 mL菌液注射到洁净级昆明小白鼠体内(雌雄各半,体重20~25 g),对照组腹腔注射等量无菌水;处理组与对照组各15只,每5只于笼中饲养。每隔4 h观察现象并记录活动情况。
小白鼠器官的取材及制片:于接种后的12 h时间段,在生物安全柜中将试验鼠断头处死,取其脑、心、肝、脾、肺和肾脏组织,并迅速于10%甲醛中固定保存[17],常温固定20 d后,脱水、包埋和切片,苏木精-伊红 (HE)染色后[18],于光学显微镜及配套图像拍摄系统(Leica,德国)拍照并分析病理特征。同时,取一定体积的血液,于TSA培养基上涂板分离和纯化疑似阪崎克罗诺杆菌分离物,采用生理生化特征和16S rDNA鉴定细菌分离物。
1.6 细菌分离物鉴定
1.6.1生理生化特征 参照文献[19-20], 对分离自紫花苜蓿的代表菌株1gF3和分离自小鼠血液的菌株TM2进行了革兰氏染色、需厌氧生长、硝酸盐还原和利用碳源产酸等生理生化特征测定。
1.6.216S rDNA基因序列分析 种带细菌16S rDNA基因序列扩增引物为通用引物27 F/1492 R, 由武汉金开瑞生物工程有限公司合成; 扩增和检测方法等具体参考文献[21],与NCBI数据库(http://www.ncbi.nlm.nih-gov/blast.cgi)中序列进行相似性比较, 并往GenBank上提交序列。
1.7 生物特性测定
参照文献[22],对菌株1gF3进行生长曲线、不同温度、干旱胁迫、耐盐性、不同酸碱度和光照条件下细菌生长量的测定。
1.8 数据统计
采用SPSS 13.0分析软件(SPSS Inc., Chicago, IL, USA)分析菌株1gF3的生长曲线、最适湿度、温度、pH、NaCl和光照条件的OD600值数据,并使用ANOVA进行显著性分析。
2 结果与分析
2.1 紫花苜蓿种带细菌分离
共从6份紫花苜蓿种子上分离得到44株细菌分离物,其中3株疑似阪崎克罗诺杆菌菌株(表2)。而空白对照则未见菌落生长。1aF3占1 g紫花苜蓿种子所含的可培养细菌菌落数量的0.17%,占可培养细菌多样性的15.90%;1cF3占1 g紫花苜蓿种子所含的可培养细菌菌落数量的0.06%,占可培养细菌多样性的18.18%;1gF3占1 g紫花苜蓿种子所含的可培养细菌菌落数量的0.80%,占可培养细菌多样性的11.36%。

表2 紫花苜蓿种带细菌种群及其数量Table 2 Seed-borne bacteria population and quantity of different varieties lucerne
“-”表示无。“-” indicates nothing.
2.2 紫花苜蓿种带细菌分离物1gF3的致病性
2.2.1对紫花苜蓿的致病性 紫花苜蓿种带细菌分离物1gF3的菌悬液浸种后皿内发芽及盆栽伤口接种菌悬液侵染试验结果表明,为期21 d的皿内发芽试验侵染组与对照组均表现正常生长未出现发病症状(图1A,B);为期90 d的菌悬液伤口侵染试验,侵染组与对照组均表现正常生长未出现发病症状(图1C,D)。
2.2.2对昆明系小白鼠的致病性 细菌分离物1gF3室内腹腔注射菌悬液接种后小鼠出现厌食、离群、发抖等症状,部分小鼠在接种24 h后死亡;而接种无菌水的对照组则健康生长,无异样。接种1gF3菌悬液12 h后各器官病理特征如下:小鼠脑组织中出现巨噬细胞,可引起化脓性脑炎(图2);小鼠心肌水肿扩张,部分心肌断裂,炎性细胞轻微浸润(图3);小鼠肝小叶边缘出现部分变性和坏死,静脉有淤血(图4);小鼠脾脏红髓细胞大量减少,局部红髓中出现大量铁血黄素巨噬细胞,是急性脾炎的表现(图5);小鼠肺脏水肿,肺间质增宽,炎性细胞浸润,气管大量出血,支气管上皮脱落,肺部有局灶性出血,属典型急性弥散性血管内凝血(disseminated intravascular coagulation,DIC)(图6);小鼠肾脏肾小球表现出了明显的病变,属于典型的肾脏急性DIC(图7)。腹腔注射无菌水后,小白鼠的心、肝、脾、肺和肾脏器无病变。通过发病小鼠血液涂板分离并纯化后得到疑似阪崎克罗诺杆菌菌株TM2,待鉴定。
2.3 紫花苜蓿种带疑似分离物的鉴定
2.3.1生理生化特征 细菌分离物1gF3、TM2和阴沟肠杆菌标准菌株ACCC 10523的主要生理生化特征详见表3。结果表明,菌株1gF3、TM2与阴沟肠杆菌标准菌株ACCC 10523表型特征接近,但在产黄色素,苯丙氨酸脱羧酶和精氨酸水解酶及水解尿素特性和利用丙二酸盐的生理生化指标上与阴沟肠杆菌标准菌株不同,根据表型特征,初步将它们确定为阪崎克罗诺杆菌。

图1 皿内发芽和盆栽试验接种细菌分离物1gF3 21 d后对紫花苜蓿的致病性Fig.1 The pathogenicity of bacterial isolate 1gF3 for lucerne after 21 d inoculation in petri dishes germination and pot culture A, C: 细菌分离物1gF3处理组Group treated by bacterial isolate 1gF3; B,D: 无菌水对照组Control.

图2 1gF3接种小鼠12 h后脑组织病理症状Fig.2 The pathological symptoms of brain tissue inoculated with isolate 1gF3 in mice after 12 h A: 方框内箭头所指为脑组织小胶质细胞团(脑中的巨噬细胞)(10×10 X) Microglia mass (macrophages in the brain) shown in the box with marked arrow (10×10 X); B: 方框内箭头所指为脑炎症,化脓性脑炎(10×10 X) Inflammation of the brain, suppurative encephalitis in the box with marked arrow (10×10 X); C: 无菌水注射组脑组织(10×10 X),左上方框为小脑,右下方框为大脑 The control group of brain tissue injected by sterile water, the upper left box was the cerebellum and the right lower box was the cerebrum (10×10 X).
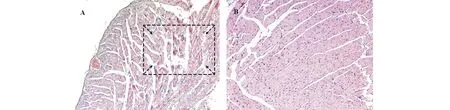
图3 1gF3接种小鼠12 h后心脏组织病理症状Fig.3 The pathological symptoms of heart tissue inoculated with isolate 1gF3 in mice after 12 h A: 心肌水肿扩张,心壁上血管静脉有淤血,心肌纤维间隙扩大,局部心肌纤维有断裂(10×10 X) The myocardial edema dilated, the vascular veins on the wall of the heart had blood stasis, the interventricular fibrosis was enlarged, and the local myocardial fibers were broken shown in the box with marked arrow (10×10 X); B: 注射无菌水组心脏组织(10×10 X) The control group of heart tissue injected by sterile water (10×10 X).
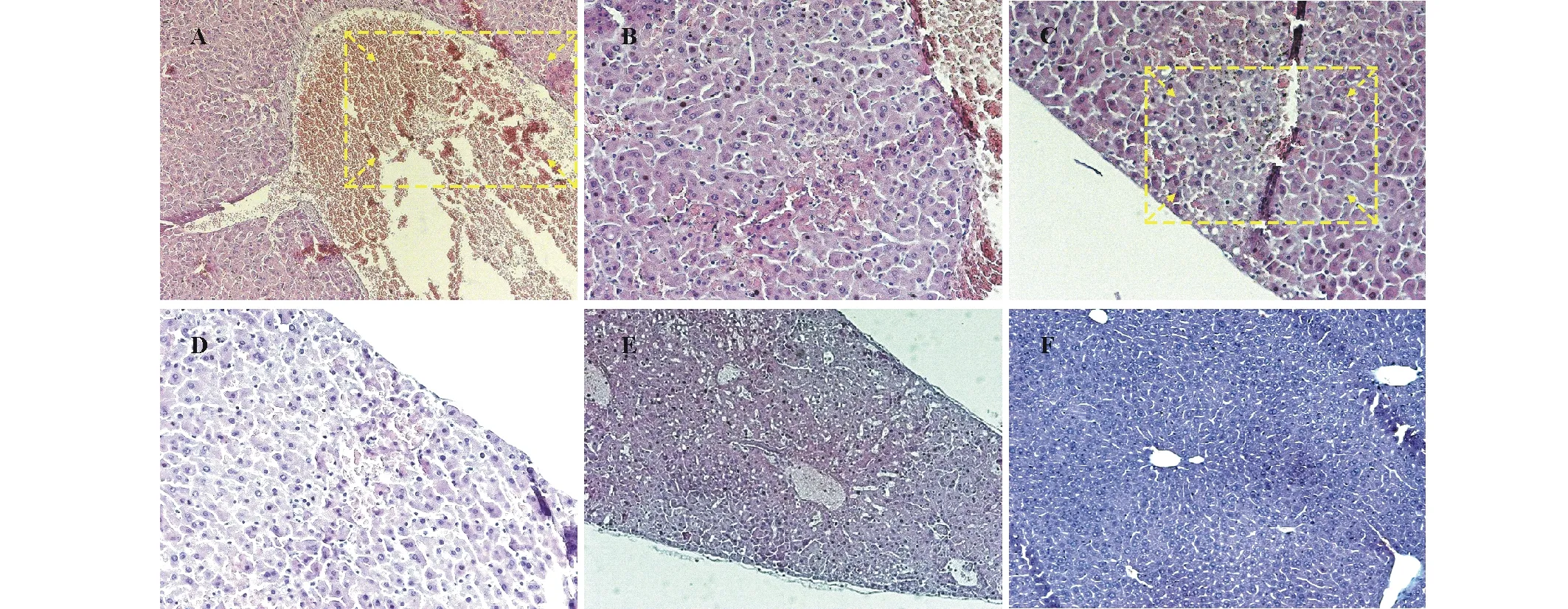
图4 1gF3接种小鼠12 h后肝脏组织病理症状Fig.4 The pathological symptoms of liver tissue inoculated with isolate 1gF3 in mice after 12 h A:中央静脉有严重淤血(方框内所示) (10×10 X) Severe congestion in the central vein shown in the box with marked arrow (10×10 X);B:肝窦隙扩张 (10×10 X) Dilatation of hepatic sinusoid (10×10 X);C:肝小叶局部发生脂肪变性,有坏死灶(方框内所示) (10×10 X) Fatty degeneration in the lobule of the liver, with necrotic foci (shown in the box with marked arrow) (10×10 X);D:肝小叶脂肪变性 (10×10 X) Fatty degeneration of hepatic lobule (10×10 X);E:肝脏病变 (10×10 X) Hepatic lesions (10×10 X);F:注射无菌水组肝脏组织 (10×10 X)The control group of liver tissue injected by sterile water (10×10 X).

图5 1gF3接种小鼠12 h后脾脏组织病理症状Fig.5 The pathological symptoms of spleen tissue inoculated with isolate 1gF3 in mice after 12 h A~C: 红髓中细胞大量减少(这是一种红髓的淋巴细胞大量崩解坏死症状),局部红髓中大量铁血黄素巨噬细胞(10×10 X) A large number of cells in the red pulp reduced (a large number of disintegration and necrosis of a red pulp lymphocyte), and a large number of hemoflavin macrophages in the local red pulp (10×10 X); D: 注射无菌水组脾脏组织(10×10 X) The control group of spleen tissue injected by sterile water (10×10 X).
2.3.216S rDNA鉴定 试验结果表明,菌株1gF3和TM2经PCR扩增16S rDNA,测定的基因大小分别为:1gF3 (1149 bp)和TM2 (1397 bp),100%相似于克罗诺杆菌属(Cronobactersp.),与阪崎克罗诺杆菌(C.sakazakii)相似性达99%,将其初步鉴定为阪崎克罗诺杆菌(C.sakazakii)(表4)。结合生理生化特性和16S rDNA鉴定方法,将细菌分离物1gF3和TM2确定为阪崎克罗诺杆菌。

图6 1gF3接种小鼠12 h后肺脏组织病理症状Fig.6 The pathological symptoms of lung tissue inoculated with isolate 1gF3 in mice after 12 h A: 肺间质增宽,有淤血(10×10 X) The pulmonary interstitium is broadened, with congestion (10×10 X); B: 肺气肿,肺泡扩张(10×10 X) Emphysema, alveolar dilatation (10×10 X); C: 注射无菌水组肺脏组织(10×10 X) The control group of lung tissue injected by sterile water (10×10 X).
2.4 1gF3的生物学特性
1gF3在0~24 h时处于缓慢生长期,24~36 h时,该菌的生长速度呈对数增长,进入对数生长期,而在36~48 h时,该菌生长速度缓慢下降,并慢慢进入衰亡期(图8A)。菌株1gF3的生长数量是随聚乙二醇-6000 (polyethylene glycol-6000, PEG-6000)干旱胁迫浓度的增加而呈线性相关的下降趋势,当PEG-6000的浓度提高到500 g·L-1时,也就是干旱胁迫最强时,菌株1gF3的生长数量接近0(图8B)。菌株1gF3能在较宽温度范围内生长,在4 ℃下该菌的生长量接近对照,即0;随着温度的升高,该菌生长量增加,当达到28 ℃时该菌的生长量达到最大值,也显著高于其他温度,该菌在41 ℃条件下生长量急剧下降,但保持了一定的生长量(图8C)。菌株1gF3能耐受较宽的pH范围,以pH 7为中轴点呈两端抛物线下降趋势,其pH值为7时,该菌的生长量最大,pH 3和11不利于该菌繁殖(图8D)。菌株1gF3在NaCl浓度为5时生长量最大,显著高于其他浓度,说明该菌不需盐生长,随着NaCl浓度上升该菌的生长量受到抑制(P<0.05)(图8E)。菌株1gF3在全黑暗生长条件下的生长量达到最高,显著高于全光照或光暗12 h交替(P<0.05)(图8F)。

表3 紫花苜蓿种带细菌分离物1gF3、TM2和购自ACCC的标准菌株的表型特征Table 3 Phenotypic characteristics of bacterial isolates 1gF3 from lucerne seeds, TM2 from the blood of diseased mice and type strain ACCC 10523
+:阳性Positive;-:阴性Negative.

表4 细菌分离物1gF3和TM2的16S rDNA鉴定Table 4 16S rDNA identification of bacterial isolates 1gF3 and TM2
3 讨论
3.1 阪崎克罗诺杆菌的环境适应能力
阪崎克罗诺杆菌能存活于极干燥的环境条件[9-10],对强酸碱、高温等极端环境具有较强的适应能力[23-25],所以它一旦进入环境,将很难得到清除。本研究发现阪崎克罗诺杆菌1gF3菌株的抗旱和耐盐能力突出,这可能得益于该菌细胞内含有大量的海藻糖酶,累积有大量的海藻糖,使得该菌比沙门菌和其他肠杆菌更耐受渗透压和干燥[24-25]。菌株1gF3在10~41 ℃下都能生长,其他研究发现阪崎克罗诺杆菌能耐受高温,最高可耐受72 ℃[25]。此外,阪崎克罗诺杆菌细胞壁的主要成分为脂多糖(lipopolysaccharides, LPS),当细菌崩裂时释放出来,具有一定的耐热性,在pH为6时活性最高,可在90 ℃时30 min内保持稳定[26-27]。1gF3菌株的pH生长范围很宽,能在pH 3~11下生长,研究报道显示阪崎克罗诺杆菌具有很强的抗酸能力,能在pH 0.9~2.0环境下存活[28],由于该菌具有形成生物膜的能力,且周生鞭毛容易扎堆生长,这都有助于阪崎克罗诺杆菌对抗强酸或其他不利的生长环境[27]。生物膜含有不同状态的细胞[29],平均而言,形成生物膜的细菌比裸露的同伴有一个更高的(高达1000倍)抗生素耐受性[30]。由于阪崎克罗诺杆菌含有LPS和产生生物膜等自身属性和特点,有利于该菌适应不同的环境条件,从而使其种群得以繁衍生息。

图8 阪崎克罗诺杆菌1gF3的生物学特性Fig.8 The biological characteristics of C. sakazakii strain 1gF3 误差棒(±SE),不同小写字母表示差异显著(P<0.05) Bars represent mean values (±SE), with differing letters denoting significant difference (P<0.05).
3.2 阪崎克罗诺杆菌的致病性
联合国粮农组织和世界卫生组织(FAO/WHO)把阪崎克罗诺杆菌列为婴儿配方奶粉中A 类致病菌,它能引起新生儿脑膜炎、致死性小肠结肠炎以及菌血症等,可引发严重的神经系统后遗症和发育障碍[31-32]。感染发病主要集中在3天至4岁的新生儿和婴幼儿,成人也可感染[23]。2004年2月FAO/WHO在日内瓦召开的婴儿配方奶粉中阪崎肠杆菌(C.sakazakii)专家研讨会上提出,婴儿配方奶粉中微量的阪崎肠杆菌[小于3 cfu·(100 g)-1]就可以导致感染的发生[12,33]。本试验证实植物源阪崎克罗诺杆菌,即紫花苜蓿种带阪崎克罗诺杆菌对小白鼠具有致病性。而且紫花苜蓿种带阪崎克罗诺杆菌1gF3菌株的含量达到>107cfu·(100 g)-1。研究发现大多数人类细菌性病害感染都与其形成生物膜直接相关[34-35],阪崎肠杆菌可产生生物膜助其免疫逃避,并且通过弥散性粘附或细胞表面局部定殖菌粘附或者两者混合型粘附的方式定殖脑微血管内皮细胞,然后侵入并诱导细胞凋亡[36]。此外,阪崎克罗诺杆菌还可以产生细菌内毒素即LPS[37],内毒素是动物产生急性弥散性血管内凝血等症状的主要致病因子。本研究通过腹腔注射阪崎克罗诺杆菌1gF3侵染小鼠并造成了心、肝、脾、肺、肾脏组织的弥散性血管凝血,肝脏局部坏死以及化脓性脑炎,其致病机理有待进一步验证。另外,本试验仅采用腹腔注射成年小鼠,并未对饲喂等其他入侵方式以及乳鼠等试验对象做进一步的研究,此为局限之处,特作说明。
2008年马诺阿夏威夷大学热带农业与人力资源学院的Keith等[38]报道了目前唯一一例由阪崎肠杆菌(Enterobactersakazakii) (现阪崎克罗诺杆菌)引起的番木瓜果实非典型中心黄化病。本试验未发现阪崎克罗诺杆菌对紫花苜蓿具有致病性。
3.3 阪崎克罗诺杆菌在土草畜系统中的生活周期
植物是连接土壤与动物的重要载体之一[2]。植物从土壤中吸收必要的营养,动物取食植物体,又通过尸体或分泌物和排泄物返回土壤,在这物质流通过程中,微生物尤其是细菌贯穿始终[2]。阪崎克罗诺杆菌呈世界分布,可以从很多食品和外环境中分离获得[39]。近年来许多流行病调查表明阪崎克罗诺杆菌感染和婴幼儿配方奶粉密切相关[39]。由于阪崎克罗诺杆菌并不是动物和人的正常菌群,因此土壤、水和蔬菜可能是奶粉中的阪崎克罗诺杆菌的最初来源[12]。研究发现细菌可通过土壤、水源和种子等携带随种子萌发进入植物各个组织,最后再回到种子得以保藏及延续[16]。阪崎克罗诺杆菌由于出色的抗逆能力,一旦经土壤和水源等外部环境进入紫花苜蓿种子,将定殖种子内部并受到种皮保护,从而躲避农业生产中的农药拌种等消毒手段而进入生态系统中。紫花苜蓿常被加工成干草[40]、青贮[41-42]以及草颗粒[43]等产品,是奶牛最优质的牧草饲料之一。奶牛在采食苜蓿饲料的同时,也将阪崎克罗诺杆菌带入了体内,并寄生于其肠道。世界各地常有紫花苜蓿食源性细菌性疾病发生,如食用带有肠道沙门氏菌不同血清型:新港沙门氏菌(SalmonellaentericaSerovar Newport)和疯牛沙门氏菌(S.entericaSerovar Bovismorbificans),以及大肠埃希氏菌O157:H7(EscbericbiacoliO157:H7)等病原细菌的苜蓿芽而引致的食源性疾病疫情层出不穷[2,7,44]。但是阪崎克罗诺杆菌多感染婴幼儿,而成年的动物或人类寄生了该菌不发病常不易引起警觉,直至新生儿或婴幼儿食用污染的奶粉发病后才引起重视。
综上所述,阪崎克罗诺杆菌可存活于紫花苜蓿种子长达十多年,且对小鼠具有致病性,但对紫花苜蓿不致病。这种可以引起动物致病却长久寄生于植物材料而躲避动物检疫的病原细菌更应引起相关部门的高度重视。

