生姜转录因子基因ZoNAC17的克隆与表达分析
陈美伶,姜玉松
(重庆文理学院特色植物研究院,重庆 402160)
NAC转录因子是植物特有的一类转录因子家族,可以与靶基因启动子的顺式作用元件相结合,增强或抑制下游基因的表达,以调控其转录效率,在植物生长发育、激素调控、生物与非生物逆境胁迫应答过程中扮演了极其重要的角色[1-2]。1996 年 Souer等[3]从矮牵牛中成功克隆出第一个NAC转录因子,之后相继发现了矮牵牛的NAM基因、拟南芥的ATAF 1/2和CUC2基因[4],并取其首字母命名为NAC。NAC类转录因子具有一个相同的结构特征,即其N端为高度保守区,含约150个氨基酸残基组成的NAC结构域,该结构域是由A、B、C、D、E五个亚结构域构成[5],C端为高度变异的转录调控区,部分具有跨膜螺旋结构[6]。不同NAC转录因子在植物生长发育过程中的功能也不尽相同。研究表明,大豆GmNAC20可以调控生长素信号相关基因的表达,影响植物侧根发育[7];拟南芥ANAC092能诱导与植株衰老相关的基因上调表达,从而加速叶片衰老的进程[8]。此外,NAC转录因子还参与了植物激素调控、抗逆境胁迫应答的过程。水稻SNAC2基因的超表达能显著提升植株对脱落酸(ABA)的敏感度[9];拟南芥ATAF1、ANAC019和ANAC072/RD26等能诱导植株抗旱、抗盐、抗枯萎病基因的表达,其超表达能显著提高植株抗非生物与生物逆境胁迫应答的能力[10-12];Hu等成功克隆了水稻抗旱耐盐基因SNAC1,同时利用转基因技术使转基因植株具有强抗旱性[13]。目前,NAC转录因子的结构与功能在拟南芥、水稻、大豆、玉米等模式植物中的研究已较为深入,然而关于生姜NAC转录因子的研究还较为少见。
生姜(Zingiber officinale Roscoe)又名地辛、百辣云,是姜科多年生草本植物姜的新鲜根茎[14],具有药食两用的特点,是我国重要的经济作物之一。本研究基于生姜转录组数据库,以西南竹根姜(Z.officinale Roscoe cv.Southwest)为材料,利用RT-PCR法克隆ZoNAC17,同时采用数字表达谱分析ZoNAC17在生姜不同组织的表达模式,旨在为进一步探索ZoNAC17转录因子调节生姜生长发育、抗逆性应答过程的机理,以及通过基因工程改良作物品质提供支撑。
1 材料与方法
1.1 试验材料
供试材料为西南竹根姜,于2017年5月播种于重庆文理学院特色植物研究院温室大棚(土壤湿度25%、温度25℃、光照强度3 500 Lx、光照12 h)培养。约2个月后,主茎第一次长出侧枝时,取其侧枝基部,即发育初期的根茎;约3个月后,第一侧枝又长出侧枝时,取第一侧枝的基部,即发育期的根茎;约4个月后,生姜第二侧枝又长出侧枝时,取第一侧枝的基部,即成熟根茎;同时取生姜主茎从下往上第三片叶子,即成熟叶片;取生姜主茎第三片叶子对应的茎部,即成熟地上茎。将上述收集的所有生姜组织置于-80℃冰箱中保存备用。
1.2 试验方法
1.2.1 总RNA的提取及第一链cDNA的合成 采用Trizol(Invitrogen,美国)进行生姜根茎总RNA的提取,RNA的完整性经过1%琼脂糖凝胶电泳进行检测后,置于-70℃冰箱中保存。以上述提取的生姜根茎总RNA为模板,利用Transcriptor First Strand cDNA Synthesis Kit试剂盒(Roche,瑞士)合成生姜第一链cDNA,于-20℃保存备用。
1.2.2 生姜ZoNAC17基因的克隆 基于生姜转录组数据库,利用DNAMAN软件中的Premier设计引物(F:5′-GACCTCGATCAACGGTTGA C-3′;R:5′-AATTCAGCGTGCAACTTTTACTG-3′),并交由苏州金唯智生物科技有限公司合成引物。以生姜根茎cDNA为模板进行PCR扩增,PCR 反应体系为 25 μL:Taq mix(Biomed,北京)12.5 μL,Primer-F 0.75 μL,Primer-R 0.75 μL,模板 cDNA 0.1 μL,ddH2O 11 μL。扩增条件为:94℃预变性5 min,94℃变性30 s,52℃退火30 s,72℃延伸3 min,共进行30个循环,最后72℃再延伸5 min。PCR产物经1%琼脂糖凝胶,调节电压至3~5 V/cm(约100 V)进行电泳检测,观察结果。
在紫外灯下用刀片切下含目的条带的琼脂糖凝胶片,转移至1.5 mL EP管中,再用Gel Extraction Kit试剂盒(Omega,美国)进行PCR产物回收。将回收的PCR产物纯化后,连接pMD18-T载体并转化大肠杆菌感受态细胞,涂布于含Amp抗生素的平板筛选阳性克隆,提取质粒经酶切鉴定成功后,选取阳性克隆送往苏州金唯智生物科技有限公司进行测序。
1.2.3 ZoNAC17基因的生物信息学分析 利用DNAMAN 5.0分析ZoNAC17的氨基酸序列,利用ExPASy的ProtParam功能(https://web.expasy.org/protparam/)预测其分子量、等电点等理化属性,利用BaCelLo(http://gpcr.biocomp.unibo.it/bacello/pred.htm)进行亚细胞定位预测,利用SignalP 4.1服务器(http://www.cbs.dtu.dk/services/SignalP/)、SMART(http://smart.emblheidelberg.de/)分别对ZoNAC17的信号肽序列和功能结构域进行在线预测。从NCBI(https://www.ncbi.nlm.nih.gov/)中下载同源性较近的其他物种来源的NAC17序列,同时运用MEGA 5.0软件进行序列比对,采取邻接法(Neighbor-Joining,NJ)进行1 000次Bootstrap计算构建系统进化树,分析生姜NAC17基因和其他物种NAC17基因的亲缘关系。
1.2.4 ZoNAC17基因的表达分析 分别提取生姜的根茎(发育初期、发育期、成熟期)、地上茎(成熟期)、叶片(成熟期)的总RNA,根据Illumina公司的流程构建不同组织的RNA-Seq数据库,以Bowtie 2.0软件(http://bowtie-bio.sourceforge.net/bowtie2/index.shtml)将每个RNASeq数据库中的Reads与ZoNAC17序列映射,映射到ZoNAC17序列的Reads数目可粗略反映不同组织样本的表达水平,采用FPKM(Reads Per Kilobase of exon model per Million mapped reads)算法对Reads数目进行标准化处理[15],得到ZoNAC17在发育初期根茎、发育期根茎、成熟根茎、成熟地上茎、成熟叶片5个处理样本中的表达图谱,每个处理均包含3个重复。
2 结果与分析
2.1 ZoNAC17基因克隆及基本理化属性分析
利用设计合成的特异性引物进行PCR扩增,扩增产物经1%琼脂糖凝胶电泳检测在约2 000 bp处有一条带,切胶回收纯化该片段,TA克隆后进行测序,测序结果显示其大小为2 014 bp(图1)。利用DNAMAN 5.0对测得序列进行分析,结果显示ZoNAC17基因全长2 014 bp,包括 57 bp 5′-UTR(非编码区)、142 bp 3′-UTR和1 815 bp ORF(开放阅读框),编码604个氨基酸残基(图2)。利用ProtParam预测生姜ZoNAC17分子量为67.52 kD,等电点为4.59,蛋白质不稳定系数为47.21,脂肪系数为70.40,其总平均疏水性为-0.478,为不稳定的亲水蛋白。采用BaCelLo进行亚细胞定位分析,推测ZoNAC17定位于细胞核。
图1 生姜ZoNAC17 PCR扩增产物电泳

图2 生姜ZoNAC17完整ORF及编码氨基酸序列
2.2 ZoNAC17转录因子的结构特征分析
通过在线服务器SignalP 4.1对ZoNAC17氨基酸序列进行信号肽预测分析,结果显示生姜ZoNAC17不含信号肽(图3,封二)。用SMART预测其功能结构域,结果显示该蛋白含有1个低度复杂区LCR(Low complexity region,第1~13位),1个NAM功能结构域(第30~156位),1个跨膜螺旋区(Transmembrane region,第569~591位,图4,封二)。

图3 生姜ZoNAC17转录因子的信号肽分析

图4 生姜ZoNAC17的结构域
2.3 ZoNAC17基因的同源性分析
在NCBI中查找并下载同源性较高的其他物种NAC17序列,采用MEGA 5.0软件将生姜NAC17序列与核桃(Juglans regia)、葡萄(Vitis vinifera)、苹果(Malus domestica)、西葫芦(Cucurbita pepo)、大豆(Glycine max)、牵牛(Ipomoea nil)、烟草(Nicotiana tomentosiformis)、小果野蕉(Musa acuminata)、菠萝(Ananas comosus)、油棕(Elaeis guineensis)、海枣(Phoenix dactylifera)的NAC17序列进行比对,构建系统进化树。结果(图5)显示,生姜NAC17基因与来源于单子叶植物小果野蕉、菠萝、海枣和油棕的NAC17基因聚成一类,与双子叶植物核桃、葡萄、苹果、西葫芦、大豆、牵牛、烟草的NAC17基因分属两个明显不同的亚族。其中,生姜ZoNAC17和小果野蕉MaNAC17同源性最高,在进化上属于同一个分支,分子进化最近,亲缘关系最为密切。
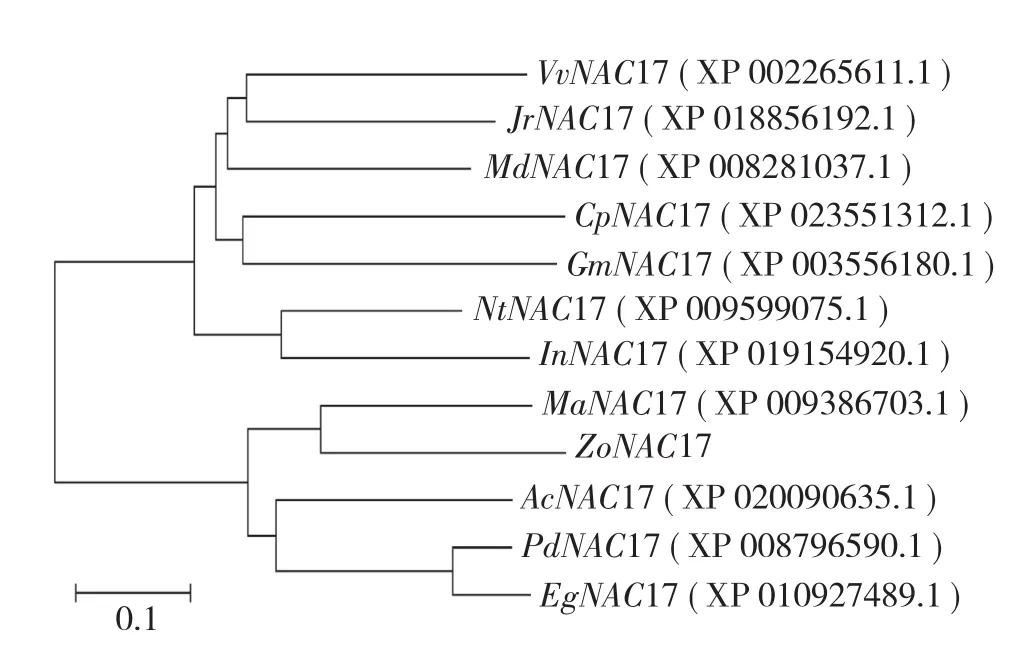
图5 生姜ZoNAC17的进化树分析
2.4 ZoNAC17基因的表达图谱
利用数字表达谱法分析ZoNAC17基因在生姜不同组织的表达图谱,结果(图6)表明ZoNAC17在生姜根茎、地上茎、叶片中均有较强表达,且在成熟组织中表现为地上茎>叶片>根茎;在生姜根茎的生长发育过程中,ZoNAC17表达量表现为发育期>成熟期>发育初期。

图6 生姜不同组织ZoNAC17基因的表达图谱
3 结论与讨论
NAC转录因子家族广泛分布于植物基因组中,植物细胞通过多种信号途径将外界信号传递给相关应答的NAC转录因子,转录因子通过与应答基因启动子区的顺式作用元件结合,激活应答基因表达以调节植物生长发育过程激素调控、胁迫应答以及诱导寄主对病原菌侵染产生抗性等各种生理活动[16]。本研究成功克隆了一个生姜的ZoNAC17基因,发现其N-末端具有一个典型的高度保守的NAM结构域。生姜ZoNAC17的N-末端不具有信号肽,但C端有一个跨膜螺旋区,说明生姜ZoNAC17不是分泌蛋白,而是一个跨膜蛋白,位于细胞和外界的交界处,能够影响细胞与外界间的信号传导、营养物质交换等生理过程[17]。相关研究也已证实,跨膜NAC转录因子由于具有膜结合的特征,能够使其对突如其来的外界环境变化迅速作出反应,对植株生长发育、激素调控及逆境应答等相关过程具有重大意义[18]。
NAC17转录因子可以明显分为单子叶植物来源与双子叶植物来源两类,同为单子叶植物的生姜属于姜科而小果野蕉属于芭蕉科,从分类学角度看二者亲缘关系较远。但本研究结果显示生姜ZoNAC17与小果野蕉MaNAC17的亲缘关系最近,说明Nr数据库中关于姜科NAC转录因子的研究较为少见,本研究克隆到的ZoNAC17的序列丰富了生姜甚至姜科植物的基因库。NAC基因的表达具有组织特异性,陆地棉GhNAC7[19]在花、子叶和真叶中有较高表达,茎、根、花药中表达较少。ZoNAC17在生姜不同组织均有较强表达,且在不同成熟组织中的表达量也有所差异,地上茎中表达量最高,叶片次之,根茎最少。在生姜发育过程中,ZoNAC17表达量先增加后逐渐减少,且在发育期表达量最高,这一结果与玉米ZmNACx[20]、拟南芥AtNAC2[21]在各个发育时期与发育器官的表达规律相一致。
综上所述,本研究成功克隆了ZoNAC17基因,其为亲水性较强的跨膜蛋白,亚细胞定位于细胞核,与小果野蕉亲缘关系最近,且在生姜不同组织和不同发育时期的表达丰度均存在着显著差异。本试验结果为今后进一步探索ZoNAC17在调控生姜生长发育、抗逆境胁迫应答等过程中的功能以及作为候选基因用于改良生姜抗逆性的研究奠定了基础。

