副猪嗜血杆菌荧光定量PCR方法的建立及初步应用
崔 沛,王东方,闫若潜,王淑娟,冉晓龙,班付国
(河南省动物疫病预防控制中心,河南郑州 450008)
副猪嗜血杆菌(Haemophilus parasuis,HPS)是猪上呼吸道中常在的一种机会致病菌,在特定条件下能够侵入机体,引发以纤维素性多发性关节炎、脑膜炎和浆膜炎为主要特征的全身性疫病[1],是目前影响养猪业最严重的病原之一。HPS在环境中普遍存在,只感染猪[2],可影响2周龄至4月龄的青年猪,主要在断奶后和保育阶段发病,通常见于5~8周龄猪群,发病率一般在10%~15%之间,严重时死亡率可达50%[3]。HPS还常由猪繁殖与呼吸综合征病毒、圆环病病毒和猪呼吸道冠状病毒等引起继发感染[4]。
近几年,HPS感染使许多大规模猪场的经济效益受到较大冲击[5]。因此,建立一种快速、敏感、特异的HPS检测诊断方法尤为重要。根据临床症状、剖检病变进行细菌分离鉴定是HPS的经典诊断方法。然而该菌培养条件苛刻,很难从患病动物中分离到,尤其是经抗生素治疗后,其分离更加困难复杂[6]。目前,用于检测HPS抗体的方法有补体结合试验、间接血凝试验和酶联免疫吸附试验。但血清学检测存在操作麻烦、检测周期长、敏感性和特异性低等不足。随着分子生物学研究的不断深入,PCR诊断技术已广泛用于各个领域。张盼锋等[7]、万世平等[8]建立了HPS PCR检测方法,但常规PCR方法只能定性,并且敏感性有待提高。随着荧光定量PCR技术的快速发展,该技术开始被广泛用于动物疫病检测。该技术灵敏度比普通PCR提高了100倍,并能减少假阳性概率,而且由于不用电泳,减少了污染,节省了时间,使检测结果更为直观[6]。于江等[9]根据infB基因序列建立了SYBR Green I荧光定量 PCR检测方法。SYBR GreenⅠ实时荧光定量RT-PCR方法虽然敏感性高,但特异性较差,容易出现假阳性。罗宝正等[10]根据转录起始因子infB基因序列,建立了TaqMan探针荧光PCR技术。但该方法的探针只是基于传统的TaqMan探针,在敏感性、特异性方面仍有提高的空间。本研究以HPS的16S rRNA基因作为检测目标,建立了TaqMan-MGB荧光定量PCR检测方法。
1 材料与方法
1.1 材料
1.1.1 质粒、菌毒株及检测样品 重组质粒pGEM-T/HPS:河南省动物疫病预防控制中心实验室保存;HPS菌株(血清1—15型):河南农科院惠赠;猪链球菌、沙门氏菌、金黄色葡萄球菌和大肠杆菌O157:河南省动物疫病防控制中心实验室提供;临床疑似HPS感染样品(病死猪组织、心包积液、关节液):采自河南省部分猪场。
1.1.2 主要仪器与试剂 KingFisher全自动核酸提取仪:美国Thermo Fisher公司产品;分光光度计(UV-2450):日本岛冿公司产品;荧光定量PCR仪(ABI 7500):美国ABI公司产品;梯度PCR仪:德国Biometra公司产品;凝胶成像分析系统:美国AlphaInnotech公司产品。Ex Taq DNA聚合酶、Rnase Inhibitor、DL2000DNA Marker、DNA 回 收试剂盒、质粒DNA小量纯化试剂盒等:均购自宝生物工程(大连)有限公司;pGEM-T easy载体:购自Promega公司;DNA/RNA磁珠提取试剂盒:购自Abmion公司。
1.2 方法
1.2.1 引物与探针设计与合成 根据GenBank中HPS 16S rRNA基因序列(登陆号CP005384.1),利用Primer Premier 6.0分析软件,设计1对特异引物P1/P2(P1:5'-AGCAGCCGCGGTAATACG-3';P2:5'-CCTTTACGCCCAGTCATTCC-3')和探针Probe-P3(FAM-5'- AGGGTGCGAGCGT-3'-MGB)。引物和探针由Invitrogen公司合成。
1.2.2 DNA提取 利用Kingfisher全自动核酸提取仪,参照磁珠法核酸提取试剂盒说明书,提取HPS、猪链球菌、沙门氏菌、金黄色葡萄球菌、大肠杆菌O157及疑似HPS感染样品的DNA。
1.2.3 标准模板建立 复壮pGEM-T/HPS 重组质粒的工程菌,利用DNA小量纯化试剂盒提取重组质粒,用分光光度计测定OD260、OD280及OD260/OD280值,共重复5 次;参考Kim等[11]介绍的方法计算其浓度,定量并稀释至1.0×1010拷贝/μL,于-20 ℃保存备用。
1.2.4 荧光定量PCR反应条件优化 用矩阵法对FQ-PCR循环参数、引物和探针浓度,以及所选引物与探针的组合等进行筛选优化,得到最佳的荧光定量PCR反应条件。
1.2.5 标准曲线建立 用含1.0×1010拷贝/μL pGEM-T/HPS重组质粒作标准品,10倍系列稀释成 1.0×101~1.0×109拷贝 /μL,共 9 个稀释度,以不同浓度的重组质粒为模板进行FQ-PCR检测。以起始模板数的对数为X轴,以FQ-PCR循环次数Ct值为Y轴作回归曲线,建立HPSFQ-PCR方法的标准曲线。
1.2.6 特异性试验 按照1.2.4中确定的最佳反应体系和条件,以1.2.2中提取的HPS、猪链球菌、沙门氏菌、金黄色葡萄球菌、大肠杆菌O157的DNA为模板进行FQ-PCR检测,并设空白对照,以检验本方法的特异性。
1.2.7 敏感性试验 利用本研究建立的HPS FQPCR方法对101~106拷贝/μL的HPS重组质粒进行敏感性扩增试验,同时与HPS常规PCR方法进行比较。
1.2.8 重复性及稳定性试验 利用本研究建立的HPS FQ-PCR方法,对3个不同浓度(1.0×106~1.0×108拷贝 /μL)的 pGEM-T/HPS 重组质粒,分别设3个重复,分3个批次进行试验,以检验该方法的重复性和稳定性。
1.2.9 与常规PCR检测灵敏度的比较 以pGEM-T/HPS重组质粒为标准品,10倍系列稀释成 1.0×100~1.0×106拷贝 /μL,以其为模板进 FQPCR,同时利用河南省动物疫病预防控制中心建立的常规PCR检测方法进行对照检测,比较两种方法的检测灵敏度。
1.2.10 临床应用试验 利用建立的HPS FQ-PCR方法,对1.2.2中提取的疑似HPS感染样品DNA进行检测,并以pGEM-T/HPS为阳性对照、无菌双蒸水为阴性对照,同时进行常规 PCR检测,验证二者的符合率。
2 结果
2.1 反应条件优化及结果判定
采用矩阵法优选引物和探针最佳浓度的结果表明,采用终浓度为0.5 μmol/L的引物和0.8 μmol/L的探针,对质粒标准品进行检测,可获得较小的反应循环数(Ct值)和较大的荧光信号(△Rn)。FQPCR循环条件优化结果表明,双温循环及60 ℃的退火温度为最佳循环条件。反应程序为:95 ℃预变性3 min;然后95 ℃变性15 s,60 ℃退火延伸40 s,共进行40个循环。在每个循环延伸结束时进行荧光信号检测,荧光模式设为FAM/NONE标记模式,Passive reference设为NONE。阴性对照的检测结果应无特定的扩增曲线,且Ct值>38.0或无,阳性对照Ct值≤25.0,且出现特定的扩增曲线,判定检测结果成立。在检测结果成立的前提下,若样品检测结果Ct值≤36.0,且出现特定的扩增曲线,判定为阳性;Ct值>38.0或无,且无特定的扩增曲线,判定为阴性;38.0≥Ct值>36.0且有特定扩增曲线,样品判定为可疑,需重复验证。
2.2 标准曲线建立
以10倍系列稀释的标准pGEM-T/HPS重组质粒(1.0×101~1.0×106拷贝 /μL)为模板进行 FQPCR检测,根据检测结果所计算出标准曲线(图1)。标准曲线的相关系数为0.998,斜率为-3.62,截距为38.88,从而可以得出拷贝数(X)与Ct值之间的线性关系表达式为:Ct= -3.62×logX+38.88。将由仪器读取的Ct值代入上述表达式,即可算出初始拷贝数。
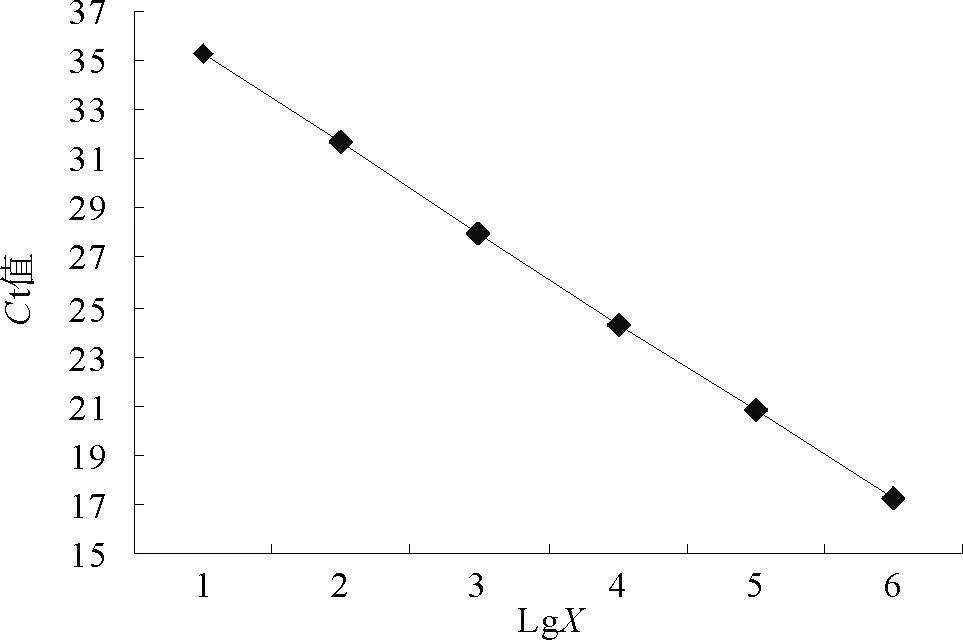
图1 HPS荧光定量PCR标准曲线
2.3 特异性试验
特异性试验结果显示,以pGEM-T/HPS重组质粒为阳性对照,有荧光信号,而猪链球菌、沙门氏菌、金黄色葡萄球菌、大肠杆菌O157等对照病原体、阴性对照无荧光响应(图2),说明所建立的HPS FQ-PCR检测方法具有好的特异性。
2.4 稳定性和重复性
以 3 个浓度(1.0×106~1.0×108拷贝 /μL)的pGEM-T/HPS重组质粒为标准品进行3次重复测定。结果显示,批内试验和批间试验的Ct值差异极小,变异系数均小于0.1(图3、表1),表明该方法具有良好的稳定性和重复性。
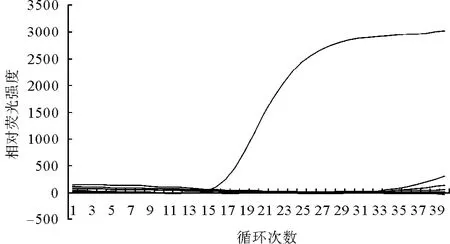
图2 HPS 荧光定量PCR特异性试验
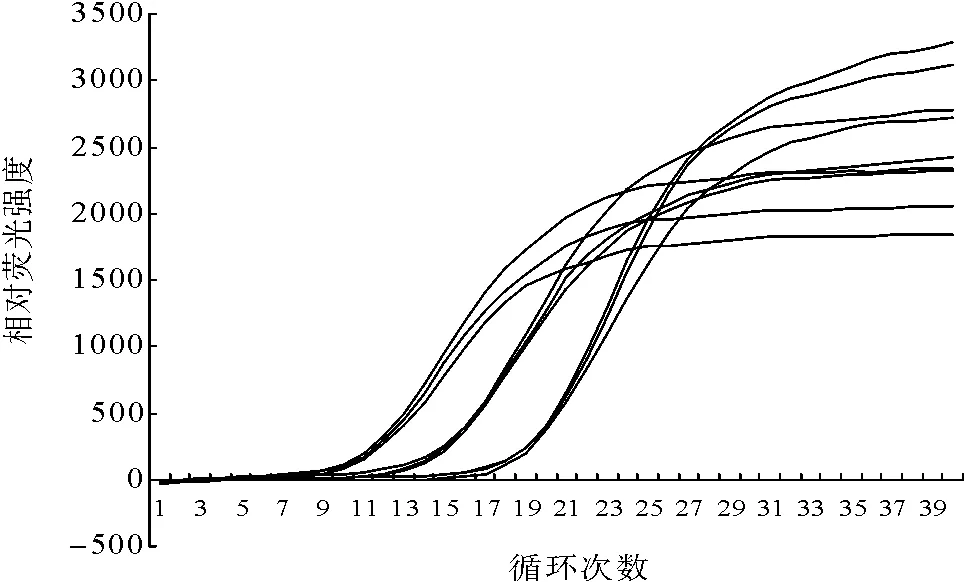
图3 HPS荧光定量PCR重复性试验
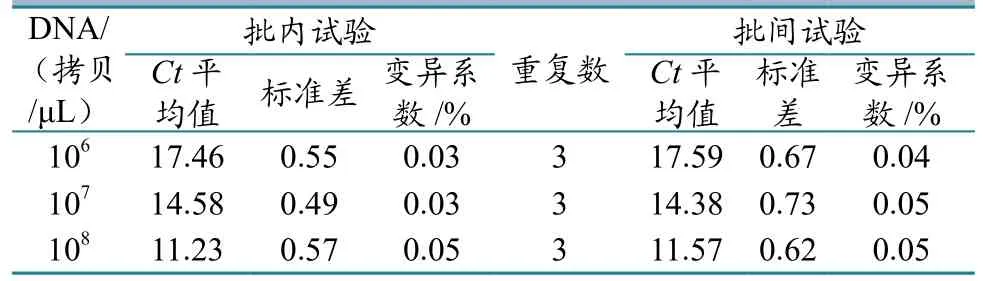
表1 重复性试验结果
2.6 与常规PCR检测灵敏度比较
以10倍系列稀释的标准pGEM-T/HPS重组质粒(1.0×100~1.0×106拷贝/μL)为模板进行FQ-PCR检测,当重组质粒浓度稀释为1.0×101拷贝/μL时,能够出现特异性扩增曲线,但质粒浓度稀释为1.0×100拷贝/μL时,未出现特异性扩增曲线,表明该方法的灵敏度为1.0×101拷贝/μL(图4)。采用常规PCR方法检测,当模板重组质粒浓度稀释为1.0×102时能扩增出条带,但稀释到1.0×101时不能扩增出条带,说明常规PCR方法检测的极限灵敏度为1.0×102拷贝/μL(图5),表明FQ-PCR方法的检测灵敏度是常规PCR检测方法的10倍。
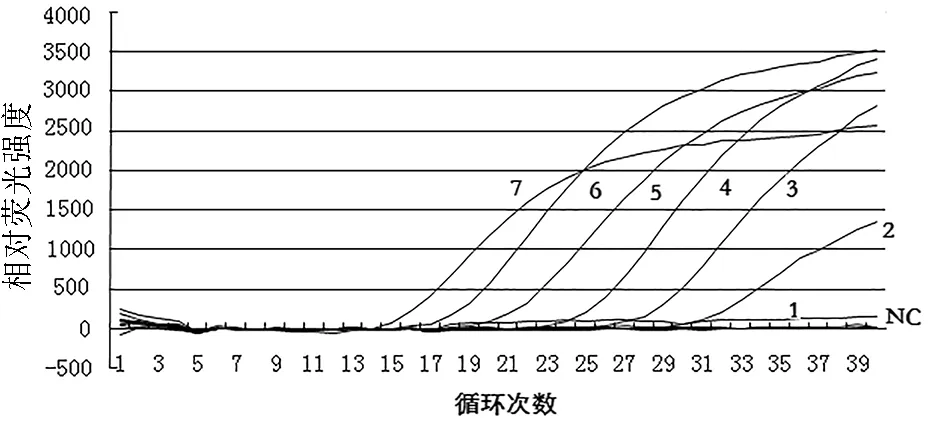
图4 HPS 荧光定量PCR敏感性试验
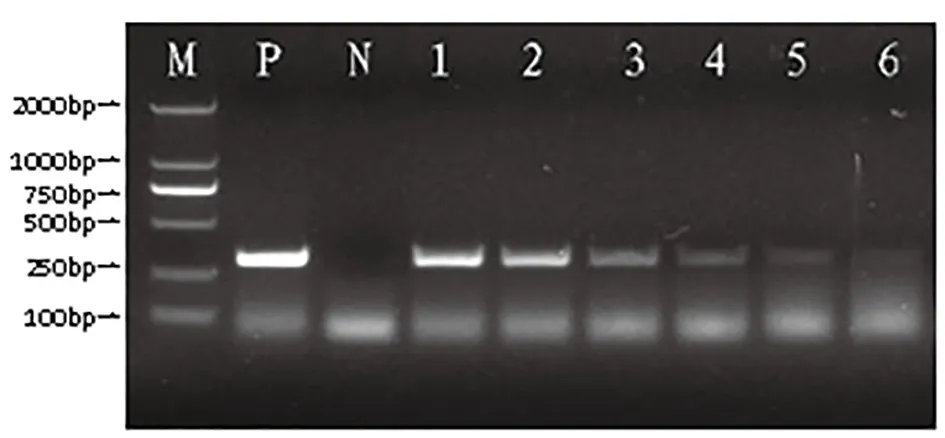
图5 HPS PCR敏感性试验
2.7 与商品化试剂盒及常规 PCR方法比较
利用所建立的HPS FQ-PCR方法对疑似HPS感染的30份组织样品进行检测,并与常规PCR进行比较分析。结果显示,HPS FQ-PCR检出19份阳性,而商品化的 HPS FQ-PCR检测试剂盒和HPS 常规 PCR均检出17份阳性。对HPS FQ-PCR阳性产物进行克隆测序,序列比对结果证明19份阳性产物均为HPS基因片段,表明本研究建立的HPS FQ-PCR方法可用于临床样品检测,并且敏感性高于商品化的 HPS FQ-PCR检测试剂盒及常规PCR检测方法。
3 讨论
HPS是现阶段造成我国哺乳和保育阶段仔猪死亡的重要原发或继发病原,特别是在饲养管理条件不好的猪场能够造成猪只大量死亡,给猪场带来较大经济损失[12]。由于HPS各血清型之间存在交叉反应,血清学方法的准确性得不到保证。而HPS的实验室分离培养又比较困难,所以很有必要建立一种快速、敏感,特异性强、稳定性好的HPS检测方法。吴静波等[13]建立的HPS PCR方法的灵敏度为100 拷贝/μL;苗立中等[14]建立的HPS SYBR Green I FQ-PCR检测方法,特异性良好、敏感性高。FQ-PCR技术具有敏感性高、特异性好、操作简单快捷等优点,给检测工作带来很大便利。FQ-PCR技术分为染料法和探针法两种。Jamnikar等[15]对染料法和探针法进行了比较,认为探针法用于定量比SYBR Green I 染料法更准确。与传统TaqMan探针比较,探针3端加上MGB,使探针长度缩短,可使探针的Tm值提高10 ℃左右,提高配对与非配对模板间的Tm值差异;由于探针3端的Quencher基团为不发光的荧光基团,并且与Report基团的空间位置更接近,从而可以使试验结果更精确,敏感性更高,而且试验条件优化后,步骤简单,重复性大大提高[16]。
4 结论
本研究以HPS 16S rRNA序列为模板设计1对特异性引物和1条TaqMan-MGB探针,通过对FQ-PCR反应体系和条件的优化,可从pGEM-T/HPS重组质粒中检测出阳性,而其他4种病原对照均未出现特异性扩增,对质粒模板最低检出浓度为10 拷贝/μL,与常规PCR 检测结果相比,敏感性高约10倍,表明该方法具有较好的特异性和敏感性。批内试验和批间试验的Ct值差异极小,变异系数均小于0.1,表明稳定性和重复性良好。在30份临床疑似HPS感染的组织样品中检出了阳性样品,比常规 PCR的阳性检出率高,表明本研究所建立的方法适用于临床样品的快速检测。本方法的建立对于HPS的快速诊断、综合防控及净化等具有重要意义。
——一道江苏高考题的奥秘解读和拓展

