烟草提取液对大鼠II型肺泡上皮细胞TGF-1β/smad2信号通路表达的影响及机制研究
,
(无锡市第三人民医院呼吸内科,江苏 无锡 214000)
香烟烟雾(Cigarette smoke ,CS)是导致慢性阻塞性肺疾病(Chronic obstructive pulmonary disease,COPD)的主要危险因素,目前尚无有效的治疗方法来抑制这种疾病的进展,研究发现CS中含有大量自由基,这些自由基进入人体后会引发氧化应激反应[1]。也有研究[2]表明吸烟能够引起肺纤维化,在肺纤维化进程中肺泡上皮细胞的损伤、内质网应激、凋亡情况均出现增加[3]。肺泡II型上皮细胞细胞(Alveolar type II epithelial cell cells,ATII)既可分化为I型也可通过优势分裂产生子代II型,当ATII凋亡严重时,会影响肺损伤修复。转化生长因子-β1(transforming growth factor-β1, TGF-1β)是启动肺成纤维细胞激活的关键因素,调节其增殖、迁移、转分化,TGF-β1激活的跨膜受体信号细胞核主要通过Smad家族的转录因子[4]。已有报道[5]证明在特发性纤维化中,TGF-1β会引起肺泡上皮细胞的凋亡,并且有研究[6]发现在smad2沉默模型中,阻断了TGF-1β对上皮细胞转化的进程。故本研究通过对ATII细胞进行烟草提取物(Cigarette smoke Extra,CSE)处理,观察烟草对其影响,并推测该过程受TGF-1β/smad2信号通路调节,进而诱导细胞凋亡。
1 材料与方法
1.1动物选择6~7周龄的SD大鼠(购自成都达硕生物技术有限公司,scxk(川)2016-030)。
1.2主要试剂使用Dispase(BD Biosciences,Bedford,MA,USA),PBS和低熔点(LMP)琼脂糖(International Biotechnologies Inc.,New Haven,CT,USA)进行ATII细胞分离;CD45 MicroBeads(Miltenyi Biotec Inc., Auburn,CA,USA),生物素化的抗大鼠上皮细胞粘附分子(Ep-CAM; e-Bioscience,San Diego,CA,USA),用于选择ATII。链霉亲和素MicroBeads,抗生物素-PEG和FITC缀合的CD45抗体购自Miltenyi Biotec Inc.(Auburn,CA,USA). DNase I购买自 Sigma(St.Louis,MO,USA);兔抗鼠TGF-β1多克隆抗体(Santa Cruz);兔抗鼠smad2多克隆抗体(Santa Cruz);兔抗鼠GAPDH多克隆抗体(Santa Cruz);兔抗鼠磷酸化smad2单克隆抗体(Cell signaling technology);云烟(云南红塔集团)。
1.3主要仪器流式细胞仪(德国Beckman Coulter公司),紫外分光光度计(Perkin Elmer),Western blot全能转印系统(bio-rad),低温高速离心机(Hermel),倒置显微镜(蔡司)。
1.4方法
1.4.1 ATII细胞原代培养[7]取右下肺部组织,放入含有1mL分散酶的离心管内37℃孵育6min。将分散液放入GentleMACS C管中,加入5 mL DMEM,100 U/mL青霉素G,100 μg/mL链霉素,10 μg/mL庆大霉素,2 mM/L谷氨酰胺,2.5μg·/mL两性霉素B,20mM HEPES(pH7.4)和120 U/mL DNA酶I匀浆。离心10 min,弃去上清液。将ATII细胞在含有5%RS及20mMHEPES的DMEM中接种1天,在含有20%EHS的DMEM中培养4天,并加入 1%CS剥离的FBS以及10ng /mL KGF。
1.4.2 提取CSE 取一支去滤嘴的云烟,将其插在进气口上,点燃后使用抽气装置在排气口匀速抽气,使烟雾均匀通过10 mL无血清DMEM培养基,每支香烟燃烧15 min,共燃烧10支,调节pH值至7.4,使用0.22 μm的滤菌网除去杂质及细菌,测定320 nm处OD值为1.36±0.12,即为100%CSE,使用时将其稀释至4%浓度待用[8]。
1.4.3 CSE处理细胞 将4%CSE溶液用达鼠ATII细胞培养24 h。
1.4.4 TUNEL assay 将ATII细胞固定在含有4%多聚甲醛(Electron Microscopy Sciences,Hatfield,PA,USA)的PBS中,并用0.2%triton X-100(Sigma Chemicals Inc。)透化,然后在潮湿室中37℃孵育1h。用Superblock Blocking Buffer(Pierce,Rockford,IL,USA)和3%正常驴血清的1:1混合物封闭细胞,并与抗proSP-C(Abcam,Cambridge,MA,USA,Ab-3786 )1h。将抗兔二抗Alexa-Fluor 594(Invitrogen Corp.,Carlsband,CA,USA)加入载玻片中并孵育30min。用含有DAPI(Vector Laboratories,Burlingame,CA,USA)的Vectashield培养基装载细胞,并通过荧光显微镜(Zeiss Axioskop 2,Thornwood,NY,USA)进行分析。每10个高倍视野计算荧光素(荧光素-dUTP标记的DNA)标记的TUNEL阳性细胞凋亡ATII细胞的百分比(10~40倍)。
1.4.5 Western blot检测蛋白表达水平 从组织中提取蛋白质,使用BCA蛋白测定试剂盒(Pierce; Thermo Fisher Scientific,Inc)测定蛋白质浓度,将等量的蛋白质(20 μg/泳道)进行10~12%SDS-PAGE胶电泳分离目标蛋白,将分离好的蛋白并转移到聚偏二氟乙烯膜上(EMD Millipore,Billerica,MA,USA)。然后用5%的脱脂牛奶封闭膜2 h,用PBS洗涤,并在4 ℃下与以下一抗一起孵育过夜:TGF-β1抗体(目录号:sc-130348,1∶1000稀释),抗smad2抗体(目录号:sc-393312,1∶1000稀释)和抗p- smad2抗体(目录号8828s,1∶1000稀释)。使用抗GAPDH抗体(目录号:sc-32233; 1∶2000稀释)作为内参对照。随后,将膜与山羊抗兔辣根过氧化物酶缀合的二抗(cat.no.ab6721; 1∶2000稀释; Abcam)在室温下孵育2h,并通过增强化学发光系统(Pierce; Thermo Fisher Scientific,Inc.)检测目的蛋白表达情况。蛋白质印迹分析重复至少三次。
1.4.6 RT-PCR检测目的因子mRNA表达水平 使用RNeasy Mini试剂盒(Qiagen,Germantown,MD,USA)从ATII细胞中分离总RNA。测定TGF-β1、smad2探针购自Life Technologies。在逆转录之前,使用Nanodrop 1000分光光度计评估分离的RNA的量和质量,0.5 mg RNA以使用qScript cDNA Supermix(Quanta Biosciences,Gaithersburg,MD,USA)合成cDNA,总样品体积为30mL。RT-PCR的循环条件如下:25 ℃ 5 min,42 ℃ 30 min,85 ℃ 5 min。使用C1000 Thermocycler(Bio-Rad,Hercules,CA,USA),将基因表达水平计算为目标因子与参考基因GAPDH(Life Technologies)的表达比值。使用ΔΔCt方法分析数据。
1.5统计学分析本文数据分析采用SPSS19.0统计软件进行,计量资料用均数±标准差表示,多组间比较用单因素方差分析,组间两两差异用student’st检验进行统计检验,P<0.05为差异有统计学意义。
2 结 果
2.1 TUNEL assay检测细胞凋亡情况通过TUNEL assay检测发现,相同放大视野(100×)中,对照组细胞生长良好,结构清晰,细胞密度大,其相对凋亡量为(5.96±3.74)%;4%烟草提取物处理组的大鼠ATII结构模糊,数量减少,并在其中观察到了明显的凋亡小体,其凋亡量(17.43±7.42)%与对照组相比具有显著差异(P<0.05),详见图1。

图1 细胞凋亡情况a: 凋亡细胞百分数比较; b:荧光显微镜观察细胞凋亡情况(100×)A:Control group;B:4% CSE processing group,白色箭头所指为凋亡小体。与4% CSE processing group 比较,*P<0.05
2.2 Real-timePCR检测TGF-1βmRNA表达情况通过Real-time PCR检测发现,与对照组比较,TGF-1βmRNA的表达量在4%烟草提取物处理组中其表达量明显增多(0.11±0.049vs0.15±0.031)(见图2)(P<0.05);而Smad2的mRNA表达量各组未见显著改变(0.12±0.049vs0.11±0.036)(P>0.05),详见图3。

图2 不同处理组TGF-1β表达量与4% CSE processing group 比较,*P<0.05

图3 不同处理组smad2表达量
2.3 Western blot检测TGF-1β及Smad2蛋白表达情况通过Western blot检测发现,TGF-1β蛋白的表达量在不同处理组显示出了不同,其中4%烟草提取物处理组中其蛋白表达量明显增多,且与照组相比具有显著差异(图4)(P<0.05);Smad2的总蛋白表达量在各组未见显著改变,但其磷酸化形式出现了显著的变化,其中4%烟草提取物处理组中蛋白表达量明显增多,且与对照组相比具有显著差异(P<0.05),详见图5。
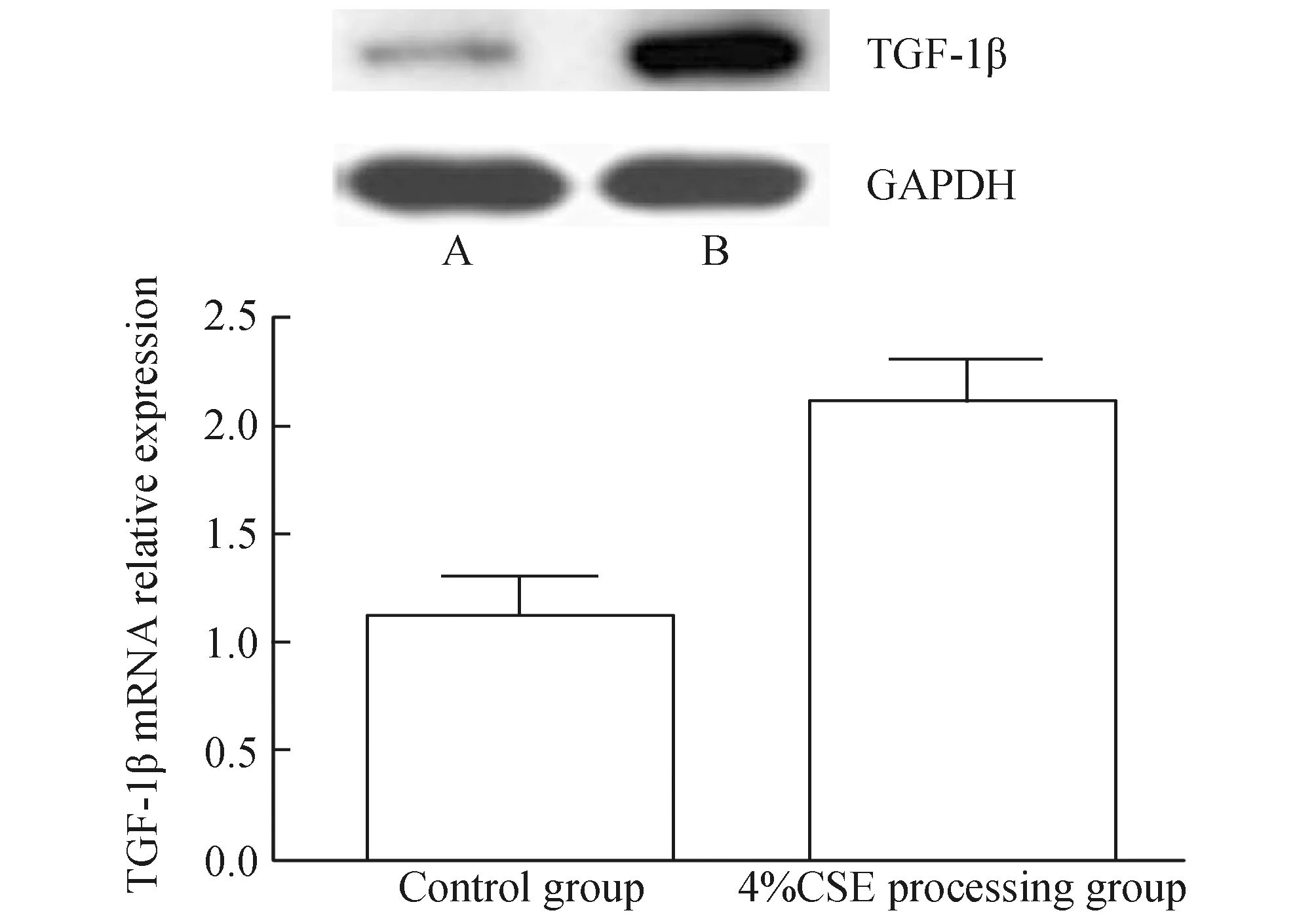
图4 TGF1-β蛋白相对表达量A:Control group;B:4% CSE processing group。

图5 p-amsd2 蛋白相对表达量A:Control group;B:4% CSE processing group;与4% CSE processing group 比较,*P<0.05
3 讨 论
凋亡是细胞程序性死亡的过程,在正常情况下,机体细胞凋亡与增殖维持着动态平衡,当机体应激状态时,体内外的理化因素会引起细胞的过度凋亡,从而打破机体平衡导致组织、器官功能障碍[9]。国内外的研究[10]表明,长期吸烟会引起肺组织细胞的凋亡,并且,长期吸烟的COPD患者肺组织细胞有大量凋亡细胞出现。本实验通过TUNEL assay发现了烟草提取物的确能增加ATII的凋亡。
TGF-β是一种多功能蛋白,最近的研究[11]表明,TGF-β1参与了细胞的凋亡过程,其活化能够影响细胞的生长、分化等功能。Smad家族蛋白是TGF-β信号转导的关键因子,当TGF-β被激活后,可使胞浆内的smads活化转位入核,从而调控靶基因的转录。研究发现[12],smad2的活性抑制后,可逆转非甾体类抗炎药诱导的胶质细胞的凋亡,即起到抗凋亡的作用。同时也有实验报道[13],前列腺上皮细胞的凋亡中,TGF-β1/smad2信号通路起到了重要作用。由此可见,TGF-β1/smad2信号通路在调控细胞凋亡进程起到了重要作用。本研究通过测定TGF-β1、smad2的表达量,发现该信号通路在CSE影响的ATII细胞凋亡中出现了明显的改变,明确了该通路在诱导凋亡中的作用。
烟草提取物引起的氧化应激在许多肺部疾病的发病机理中起着关键作用,其毒性作用主要归因于凋亡和坏死[14]。研究发现ATI样细胞对CSE的敏感性比ATII细胞更高[15]。细胞应对CSE产生的活性氧(active oxygen species,ROS)有两种方式。第一个通过激活红系衍生的核转录相关因子2(Nuclear factor(erythroid-derived2)-like protein,Nrf2)提供抗氧化清除系统能力[16]。第二,细胞在不可修复的DNA损伤的情况下,通过smad2介导的细胞凋亡对ROS诱导的DNA损伤作出响应。本研究将ATII细胞暴露于4% CSE中,发现 TGF-β1激活诱导暴露于CSE的ATII细胞凋亡。由于条件限制,本实验未从整体研究CSE对肺组织的影响及机制,也未进一步明确TGF-β1/smad2信号通路在CSE损伤的作用。但本研究是将为是下一步研究打下了坚实基础。
综上所述,CSE中的有害物质可能通过诱导ATII细胞凋亡引发肺组织损伤及功能障碍。其机制可能是CSE通过诱导TGF-β1/smad2信号通路激活,进而引起凋亡的发生。本研究通过研究TGF-β1/smad2在诱导ATII凋亡的作用,可为临床防治吸烟引起的肺损伤提供治疗依据。

