3种不同的HPV型别宫颈癌细胞株分泌蛋白非标记定量技术分析
郝 轶,袁建林,肖 悦,李 卉,郭 霞,*
(1. 南方医科大学深圳医院,广东 深圳518100;2. 新疆医科大学附属肿瘤医院,新疆乌鲁木齐 830011;3. 新疆医科大学地方病分子生物学实验室,新疆 乌鲁木齐 830011)
宫颈癌是常见的妇科恶性肿瘤之一,在世界范围内,每年约有52万新发病例[1]。虽然如今宫颈癌的筛查手段不断提高,但是在全世界女性中,宫颈癌仍是第二常见的恶性肿瘤。宫颈癌也是在发展中国家导致女性死亡的第三大癌症,严重威胁女性的健康和生命安全[1]。目前,高危型人乳头状瘤病毒(human papillomavirus,HPV)的持续感染已被确定为宫颈癌的一个重要致病因素,其中HPV16导致的宫颈癌占总体一半以上,病理类型通常为鳞状上皮细胞癌。因此本研究中,选取HPV16阳性的宫颈癌鳞状细胞株SiHa和人宫颈癌肠转移细胞Caski,以及HPV16阴性细胞C33作为研究对象,从3类细胞株的分泌蛋白为切入点,采取非标记(label-free)定量蛋白质组学技术,以寻找明确的分泌蛋白肿瘤标记物为目的,为宫颈鳞癌的早期诊断提供更多依据。
1.材料与方法
1.1 主要试剂
DEME基础培养基、胎牛血清、胰酶和100×青霉素-链霉素混合溶液(青霉素10 kU/mL,链霉素10 mg/mL),购于美国Gibco公司;BCA试剂盒、三羟甲基氨基甲烷、上样缓冲液、制胶试剂盒、考马斯亮蓝,购于美国Bio-Rad公司;二硫苏糖醇DTT、乙酸、尿素、碳酸氢铵、甲醇、乙腈,均购于美国Sigma公司。
1.2 主要仪器
垂直电泳仪(SE260,GE-Healthcare);Q-exacitve质谱仪和Easy-nLC 1000纳升级液相色谱(Thermo Finnigan);Trap column固相萃取柱、EASY column SC001 traps 150 μm× 20 mm(RP-C18) 和Analysis column,EASY column SC200 150 μm×100 mm (RP-C18)(均为Thermo);3 kD超滤(Millipore);Maxquant,1.3.0.5版本;Perseus软件,1.3.0.4版本。
1.3 宫颈癌细胞的培养和收集
SiHa、Caski以及C33细胞为液体培养状态,来自中国科学院上海生命科学研究所。先将3种细胞分别培养在直径100 mm的细胞培养皿中,加入10 mL左右含10%优质胎牛血清的DMEM培养基,在37 ℃、CO2体积分数为5%的培养箱条件下培养。根据报道[2],37 ℃无血清培养24 h、细胞汇合度60%~70%是研究分泌蛋白质组的最佳培养时间和培养条件[2]。在上述条件下将细胞培养至汇合度为60%~70%后,用无血清培养基洗4次,37 ℃孵育24 h。收集无血清培养基,0.22 μm孔径滤膜过滤去除死细胞和大的细胞碎片,加入cocktail蛋白酶抑制剂,并用3 kD超滤管Millipore(cut off:5 kD)超滤浓缩、离心,上清保存于-80 ℃备用。
1.4 蛋白质的SDS-PAGE和FASP酶解
BCA法进行蛋白质定量。通过蛋白质的SDSPAGE电泳实验验证每个样本的蛋白质质量,每组样品各取20 μg蛋白质样品5∶1(V/V)加入5×上样缓冲液,沸水浴5 min,14 000 g离心10 min取上清,进行12.5% SDS-PAGE电泳。电泳条件为恒流15 mA,电泳时间60 min。考马斯亮蓝染色。接着每份样品分别取100 μg,分别加入DTT至终浓度为100 mmol/L,之后和200 μL UA buffer (8 mol/L Urea,150 mmol/L Tris-HCl pH8.0) 混匀,转入30 kD超滤离心管,14 000 g离 心15 min。加入200 μL UA buffer离心14 000 g 15 min,弃滤液。加入100 μL IAA (50 mmol/L IAA in UA)14 000 g离心10 min重复2次。加入100 μL NH4H CO3buffer,离心14 000 g 10 min重复2次。加入40 μL Trypsin buffer(取2 μg胰酶溶于40 μL NH4H CO3缓冲液),600 r/min振荡1 min,37 ℃、16~18 h。换新收集管,14 000 g离心10 min,收集滤液,滤液C18-SD Extraction Disk Cartridge脱盐处理,紫外分光光度计测量样品在280 nm波长的吸光度。
1.5 酶解产物的LC-MS/MS分析
按照定量结果各取3 μg酶解后产物进行液相色谱-串联质谱(LC-MS/MS )分析[2-3],每个样品进行3次。采用纳升流速HPLC液相系统EASY-nLC1000进行分离。液相A液为0.1%甲酸乙腈水溶液(乙腈为2%),B液为0.1%甲酸乙腈水溶液(乙腈为84%)。色谱柱SC200 150 μm× 100 mm(RP-C18)以100%的A液平衡。样品由自动进样器上样到色谱柱SC001 traps 150 μm× 20 mm (RPC18)再经色谱柱分离,流速为300 nL/min。相关液梯度如下:第0~100 m in,B液线性梯度从0~45%;第100~108 min,B液线性梯度从45%~100%;第108~200 min,B液维持在100%。酶解产物经毛细管高效液相色谱分离后用Q-Exactive质谱仪进行质谱分析120 min。检测方式用正离子,母离子扫描范围是300~1800 m/z,多肽和多肽碎片的质量电荷比按照每次全扫描(full scan)后采集20个碎片图谱(MS2 scan,HCD)。MS1在M/Z 200时分辨率为70 000 PPI,MS2在M/Z 200 时分辨率为17 500 PPI。
1.6 Maxquant的非标记分析和Perseus的统计学和生物信息分析
9个LC-MS/MS原始文件导入Maxquant软件(版本号1.3.0.5)进行查库,进行LFQ非标定量分析[2-3]。数据库为uniprot human_151619_20160229.fasta(收录序列151 619条,下载于2016-02-29)。Maxquant所得的查库文件使用Perseus软件进行分析,Perseus软件版本号为1.3.0.4。Maxquant的非标记分析等步骤进行label free 定量技术分析[4-5],再比较C-33A、SiHa、Caski细胞培养上清中分泌蛋白的表达差异,用GO分析(主要为level2分析,二级分支CC、BP、MF)和KEGG进行生物信息分析。
2 结 果
2.1 蛋白质浓度测定
在各样品均取总量为200 μL的基础上,蛋白质浓度测定结果为Siha细胞株为1.2 μg/μL,Caski细胞株为3.9 μg/μL ,C33细胞株为3.8 μg/μL。
2.2 SDS-PAGE分析
由考马斯染色图谱(图1)来看,Marker条带均一,各样品条带分离清晰,蛋白提取效果良好。

2.3 肽段及蛋白质结果
肽段样品在波长280 nm处进行吸光度值测定,Siha浓度为0.72 μg/μL ,Caski浓度为0.76 μg/μL,C33为1.27 μg/μL。LC-MS/MS质谱鉴定结果显示,本实验共鉴定肽段数21 609个,蛋白数2 895个。蛋白质从属示意图如图2所示,其中特异性蛋白C33细胞有859种,Caski 细胞有143种,Siha细胞有128种;发现3种宫颈癌细胞株共性蛋白共729种,占29.2%。
对于729种共性蛋白进行分析,有以下4类较为集中的类型:①热休克蛋白类(heat shock,HSPs)。发现热休克蛋白及其相关蛋白共14种,分别为HSP13、HSP74、HSP76、HSP7C、HSPB1、HS90A、HS90B、HS105、 CDC37、 CH10、 CH60、 GRP75、 GRP78、Q59EJ3, 其 中 属 于 HSP70家 族 的 有 7种 (HSP13、HSP74、 HSP76、 HSP7C、 GRP75、 GRP78、Q59EJ3), HSP90有 3种 (HS90A、 HS90B、 CDC37),HSP60有1种(CH60)。②异质性核糖核蛋白类(heterogeneous nuclear ribonucleoprotein,HNRP)。发现异质性核糖核蛋白类共8种,分别为:ROA1、ROA2、ROA3、 HNRPU、 HNRPD、 G3V4C1、 Q53F64、Q6IBN1。③层黏连蛋白类(laminin,LN)。发现层 黏 连蛋白类共4种,分别为LAMA5、LAMB2、LAMC1、G3XAI2。④阿尔多酮还原酶(Aldo-keto reductase family 1,AKR1):发现阿尔多酮还原酶共2种,分别是ALDR和AK1BA。
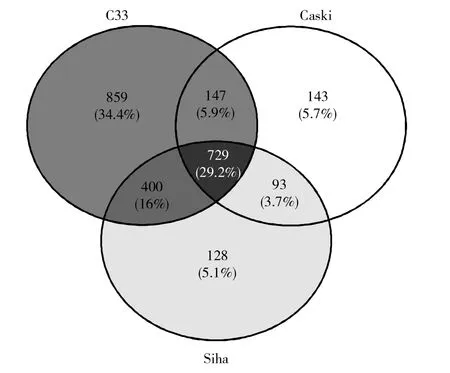
深灰圆圈代表C33细胞株分泌蛋白,白色圆圈代表Caski细胞株分泌蛋白,浅灰色圆圈代表Siha细胞株分泌蛋白;各个圈相交部分表示对应细胞株共同的分泌蛋白.
2.4 GO分析
将已鉴定的蛋白进行GO二级分类统计图(level 2,分为CC、BP、MF)分析。如下图3所示,按照细胞组分及元件(cellular component,CC)分类,主要包括组成细胞(cell,>80%)、细胞器(organelle,>80%)、细胞外区(extracellular region)和细胞膜(membrane);按照生物过程(biological process,BP)分类,主要包括参与细胞加工过程(cellular process,>80%)、单一的生物过程(single-organism process)、代谢过程(metabolic process)以及生物调节过程(biological regulation)的蛋白质;按照分子机制(molecular function,MF)分类,主要包括结合蛋白(binding,>80%)和具有催化活性(catalytic activity)的蛋白质。
2.5 KEGG pathway分析
如图4所示,在KEGG Pathway分析中3种类型细胞

3 GO level2
图 二级分类统计图( )分析图株内蛋白主要的代谢通路是溶酶体通路(lysosome,39种),其次为碳代谢(carbon metabolism,30种)、内吞作用(endocytosis,30种)等。
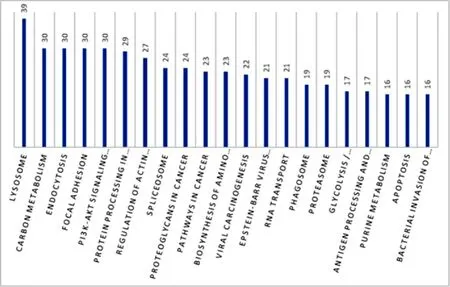
图中X轴代表蛋白可能参与的通路名称,Y轴代表参与该通路的蛋白数目,由图可得出参与溶酶体通路(lysosome)的蛋白数最多.图4 KEGG pathway分析
3 讨 论
宫颈癌作为最常见的妇科恶性肿瘤,当前仍然是严重威胁广大妇女身心健康的恶性疾病。有研究表明,高危型人体乳头瘤病毒(high risk HPV)的持续感染是公认的导致宫颈癌的首要因素[6]。迄今已确定基因组全序列的HPV基因型有170多种[7],已证明其中30种HPV基因型与生殖系统疾病相关,20余种与宫颈肿瘤相关。国际癌症研究机构(International Agency for Research on Cancer, IA RC)对已发表的85份研究中的10 058例子宫颈癌病例进行分析,发现超过2/3的子宫颈癌病例与HPVl6型(51.0%)或HPVl8型(16.2%)感染有关。HPV 感染与组织学类型相关:HPVl6型多见于宫颈鳞癌,HPVl8型以宫颈腺癌为主;流行病学上,HPV16 感染的盛行率高于HPV18感染,是导致宫颈癌最常见的类型[8]。因此临床上子宫颈癌以鳞状细胞癌表现为主,腺癌则相对少见。
定量蛋白质组学是蛋白质组研究的重要内容,通过对基因表达产物蛋白质的定量分析,以了解基因在不同的生理、病理和逆境条件下的表达情况。非标记定量蛋白质组学技术(label-free quantitative proteomics technology)的定量模型中,认为肽段在质谱中被捕获检测的频率与其在混合物中的丰度成正相关,因此蛋白质被质谱检测的计数反映了蛋白质的丰度,通过适当的数学公式可以将质谱检测计数与蛋白质的量联系起来,从而对蛋白质进行定量[9-10]。
目前,在蛋白质组学的基础上,有学者提出了分泌蛋白质组(secretome)的概念[9,11],血清分泌蛋白质组学是指血清中的全部分泌蛋白质,来源于各种组织或细胞的分泌或者泄漏,包括细胞因子、趋化因子、激素、消化酶、抗体、胞外蛋白酶和毒素等功能各异的蛋白,并与细胞的黏连、转移、分化、增殖和免疫应答等多种生物学进程有关[12]。随着血清分泌蛋白质组学在肿瘤中的发展,目前已经发现一批与肿瘤发生发展有关的新的血清蛋白质标志物[13-14]。
本研究通过Label Free方法 分 析宫颈癌细胞系分泌蛋白中共同分泌蛋白一共有729种,而特异性蛋白C33细胞有859种,Caski细胞有143种,Siha细胞有128种。对共同分泌蛋白以及特异性蛋白进行提取分析进行更深入研究,可为进一步寻找可能的HPV相关肿瘤分子标记物以及宫颈癌早期诊断提供实验基础和理论依据[9]。在共性蛋白中发现的4类较为集中的类型:①热休克蛋白类(heat shock,HSPs)是在从细菌到哺乳动物中广泛存在的一类热应激蛋白质,各种应激刺激可诱导其快速高表达,具有维持细胞蛋白稳定、对抗有害应激、保护细胞生存等功能。研究发现,HSP70以及HSP90在宫颈癌组织中过度表达[15-17],并且随着恶性程度升高而表达数量增多,被认为与宫颈癌的转化与增殖密切相关[18];②异质性核糖核蛋白类(heterogeneous nuclear ribonucleoprotein,HNRP)是RNA 结合蛋白,与细胞核中的前mRNA相关,并且影响mRNA前体的加工和其他方面的mRNA代谢和转运,具有不同的核酸结合特性。其中异质性核糖核蛋白C被证实与HPV16感染进程相关[19],异质性核糖核蛋白K被证实与鳞状细胞癌感染相关[20];③层黏连蛋白类(laminin,LN)是构成细胞间质的一种非胶原糖,在肝内主要由内皮细胞及贮脂细胞合成,与胶原一起构成基底膜的成分。其生物功能是细胞黏着于基质的介质,并与多种基底膜成分结合,调节细胞生长和分化。研究表明lamini gama-1会增加子宫恶性肿瘤的严重程度及加速肿瘤发展[21],是一种潜在的分子标记物;④阿尔多酮还原酶(Aldoketo reductase family 1,AKR1):将视网膜转化为视黄醇的还原酶。已经在多种类型的肿瘤中如非小细胞肺癌中观察到,并且几乎不出现在正常的组织中。而根据研究显示,其在宫颈癌手术后,含量和复发的可能性成正比,说明这种蛋白可能是宫颈癌术后复发的信号分子[22]。
同时,通过KEGG通路分析得到3种宫颈癌相关细胞蛋白是以溶酶体的代谢与内吞作用为主要信号通路。有研究表明,HPV16是通过与细胞表面受体结合和细胞外基质(ECM)发生作用后[23],实质上是通过巨胞饮作用利用一种潜在的新配体诱导的新型内吞途径[24],并且不依赖网格蛋白细胞膜穴样内陷途径进人细内的[23-25]。HPV16病毒进入细胞后,依赖于肌动蛋白动力学和酪氨酸激酶信号,携带到晚期内涵体或溶酶体中,进行缓慢的酸依赖性穿透,并通过暴露于低pH而活化[23]。这从侧面证实说明HPV16入胞与活化和溶酶体与内吞作用有关,溶酶体与其相关蛋白可以成为调节HPV16活化的关键。
本文通过运用蛋白质组学label free的方法,筛选分析了与HPV16相关的3类宫颈癌细胞系Siha、Caski、C33共性的分泌蛋白并联系蛋白通路,为进一步筛选宫颈癌血清蛋白标志物以及寻求肿瘤治疗方案奠定了基础。

