模拟氮沉降对杉木幼苗细根化学计量学特征的影响
郭润泉,熊德成,宋涛涛,蔡瑛莹,陈廷廷,陈望远,郑 欣,陈光水,*
1 福建师范大学地理科学学院,福州 350007 2 湿润亚热带山地生态国家重点实验室培育基地,福州 350007
近百年来,由于大量含氮(N)化肥的生产和使用、矿物燃料燃烧和农牧业的快速发展,人类活动向大气中排放的含N化合物日益增多[1],20世纪大气N沉降增加了3—5倍[2],预计到本世纪末全球N沉降速率还将增加2.5倍[3],这些含N化合物通过干湿沉降进入陆地生态系统并对其产生巨大影响[4]。在这一全球变化背景下,N沉降研究已成为国际上生态和环境研究的热点内容之一[5]。
植物根系是碳(C)及其他矿物质元素在陆地生态系统的重要储存库[6],是全球陆地生态系统C循环和养分循环的重要组成部分[7],细根作为植物吸收养分和水分的重要器官[8],是根系中最活跃和最敏感的部分[9],对气候变化更敏感,细根动态在生态系统C和养分循环中起着重要作用[10]。
C、N和磷(P)作为植物生长发育所必需的元素[11],对植物生长和各种生理机能的调节起着非常重要的作用[12];且C、N和P等主要元素之间的化学计量比是影响生态系统中植物生长的主要因素[13]。细根组织C、N、P浓度对N沉降的动态响应将显著影响森林生态系统的生产力和C源汇变化。系统研究不同径级根系养分特征,对认识植物对养分资源的分配和利用,了解森林生态系统C和养分循环具有重要的意义[14]。有研究表明,N是大多数北方森林、温带和部分热带生态系统中C和养分循环动态的限制性资源[15],模拟N沉降增加了植物根系的硝酸盐可用性,导致细根吸收和存储的N增加[16],在N沉降强度较高的样地,细根中N浓度和酸溶性有机质含量增加[15]。Krasowski 等发现,N添加后白云杉(Piceaglauca)细根直径增加、木质部直径增粗,细根C浓度升高[8]。Li等通过Meta分析发现模拟N沉降降低了细根C浓度,显著增加了细根N浓度,细根C∶N比降低[17],细根分解速率降低[18],增加土壤C存储[17,19];王延平通过对杨树不同季节细根CN浓度变化研究发现,细根C浓度呈现出生长季较高,非生长季降低的特点,细根N浓度呈相反趋势[20]。
植物在生长过程中对N、P元素需求量很大,因此,N和P通常是生态系统初级生产力的限制性因素[21]。N沉降水平的提高改变了养分有效性,可能使生态系统从N限制转变为P限制或N和P共同限制[22],樊后保通过对一年生杉木幼苗不同梯度的N添加研究发现,N添加显著增加了细根N浓度,对细根P浓度影响不显著,细根N∶P比增加。低水平的施N增加了苗木单株生物量,增加N贮存,但过量的N输入抑制了苗木的生长和生物量的积累,导致N与其他元素的比值失衡,影响苗木的正常生长[23]。目前,有关N沉降对细根元素化学计量学的影响主要集中在对细根C、N的影响上,而对细根P浓度的影响较少[24];而且大部分研究是短期的影响,而N沉降对细根元素化学计量学的长期动态影响研究很少,特别是林木生长本身在调节细根化学计量学特征对N沉降响应上的作用仍不清楚。
杉木(Cunninghamialanceolata)是中国南方重要的造林和用材树种,种植广泛,面积达1239.1×104hm2,蓄积量为47357.33×104m3,分别占全国人工林面积和蓄积量的26.55%和46.89%,在中国人工林中占据重要地位[25]。目前,N沉降对杉木地下特别是细根的影响还鲜有报道[24]。为此,本研究通过在亚热带地区模拟N沉降试验,研究N沉降对杉木幼苗细根C、N、P化学计量学两年的动态影响,以期为进一步揭示N沉降对杉木人工林生产力和C吸存的影响提供基础数据。
1 材料与方法
1.1 研究区概况
研究区位于福建三明森林生态系统与全球变化研究站陈大观测点(26°19′ N,117°36′ E)。该区域为中亚热带季风气候,多年平均气温19.1℃,年均降雨量1749 mm且多集中在每年3—8月,年均蒸发量1585 mm,相对湿度81%。土壤以黑云母花岗岩发育的红壤和黄壤为主,平均海拔300 m。
1.2 实验设计
根据本试验区N沉降水平的背景值为36 kg N hm-2a-1[26],本试验设置了3个处理:(1)未施N的对照(CK)、(2)低N添加(LN,40 kg N hm-2a-1)、(3)高N添加(HN, 80 kg N hm-2a-1),每个处理5个重复,共15个实验小区。小区面积2 m×2 m,小区土壤取自附近杉木林,取土时按0—10、10—20、20—70 cm分层去除杂物后充分混拌均匀,以消除土壤异质性,然后分层填至各小区,并调整土壤容重,与取土杉木林基本相同。小区四周采用4块PVC板(200 cm×70 cm)焊接而成,与周围土壤隔开,防止小区之间相互干扰。2013年11月在每个小区种植4棵1年生杉木幼苗。并于2014年3月份开始施N肥(NH4NO3,分析纯),每月月初以溶液的形式对小区喷洒,全年共12次。按照处理水平要求,将每个小区每次所需要喷洒的NH4NO3溶解在800 mL(相当年降雨量增加约2 mm)去离子水中,用手提式喷雾器在小区四周从幼苗林冠上方对小区均匀喷洒。对照小区喷洒等量的去离子水,全年共12次。
1.3 土壤样品的采集和分析
2015年1月,采用土钻法在每个小区随机取4个土样,土钻直径3.5 cm,测定0—10 cm和10—20 cm土壤的基本理化性质(表1)。
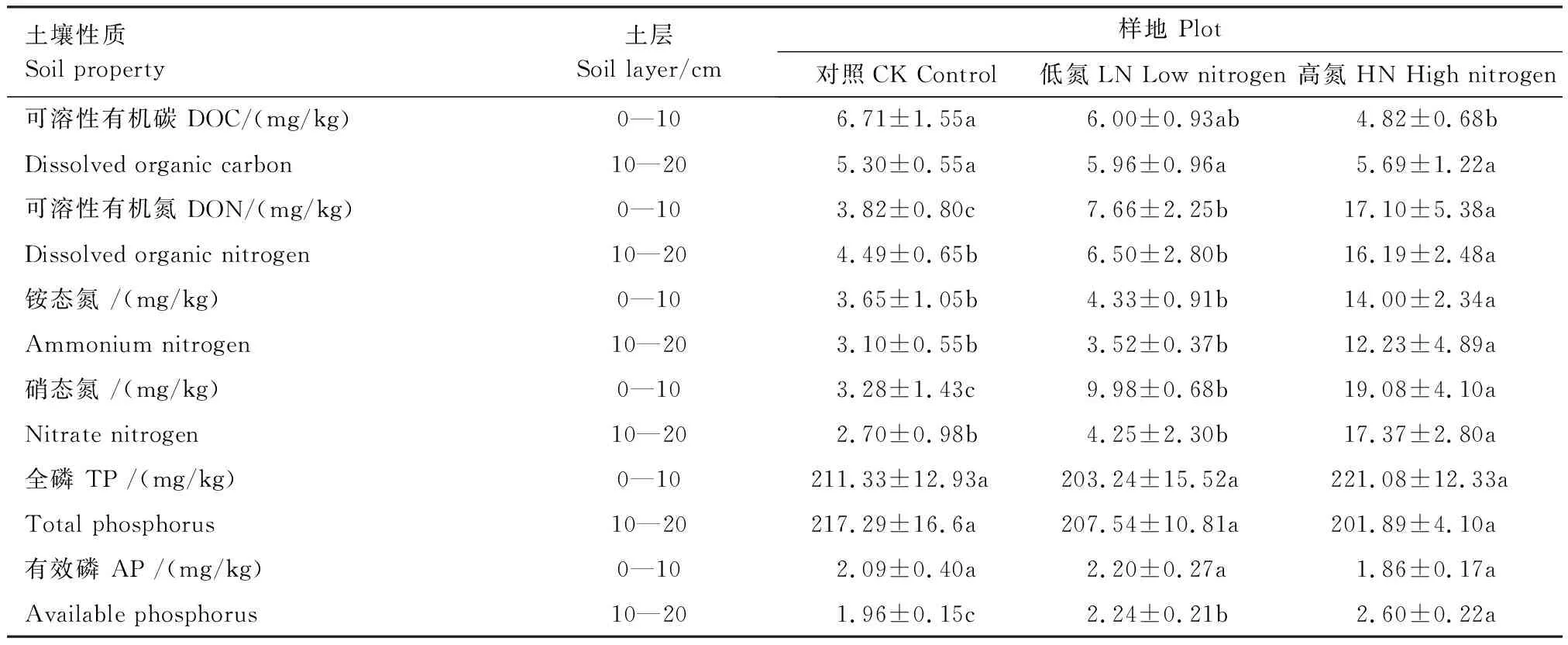
表1 氮沉降试验小区土壤理化性质
同行不同字母表示不同处理差异达到0.05显著水平,图中数据为平均值±标准差

1.4 内生长环布设取样分析

图1 内生长环法Fig.1 Root in-growth donut
2014年7月,在每个小区的中心位置布设内径20 cm、高20 cm的内生长环,外环为2 mm×2 mm正方形孔径的环网,中间放置一内径10 cm的PVC管并用沙袋充填,内环PVC管主要目的是便于取样(图1)。取样时,取走沙袋后,可以较轻易地取出PVC管,然后用小刀对内生长环内的土壤进行取样,分0—10、10—20 cm取出内生长环的土壤,挑出所有根系后将土分层回填至内生长环。并于2015年1月(2014年7月布设)、2015年7月(2015年1月布设)、2016年1月(2015年7月布设)和2016年7月(2016年1月布设)从内生长环中取出细根,并立即在野外把细根挑出,然后带回实验室清洗干净。每次取样两个土层细根混合到一起后根据细根的颜色、外形等区分出活死根,再按0—1、1—2 mm分出径级。样品100℃杀青3 min后,于65℃下烘干。
直接杀青烘干的细根在获取重量后使用球磨仪磨碎,称取10 mg用元素分析仪(vario EL III Element Analyzer, 德国)测定杉木细根中C、N浓度;称取250 mg细根样品用HClO4-H2SO4消煮法脱硅定容到100 mL,静置24 h,获取上清液,用连续流动分析仪(skalar san++,Skalar, 荷兰)测定杉木细根P浓度。
1.5 杉木幼树树高、地径
2015年1月、7月,2016年1月、7月分别测量了CK、LN、HN 3个处理杉木幼树的树高、地径,见图2。
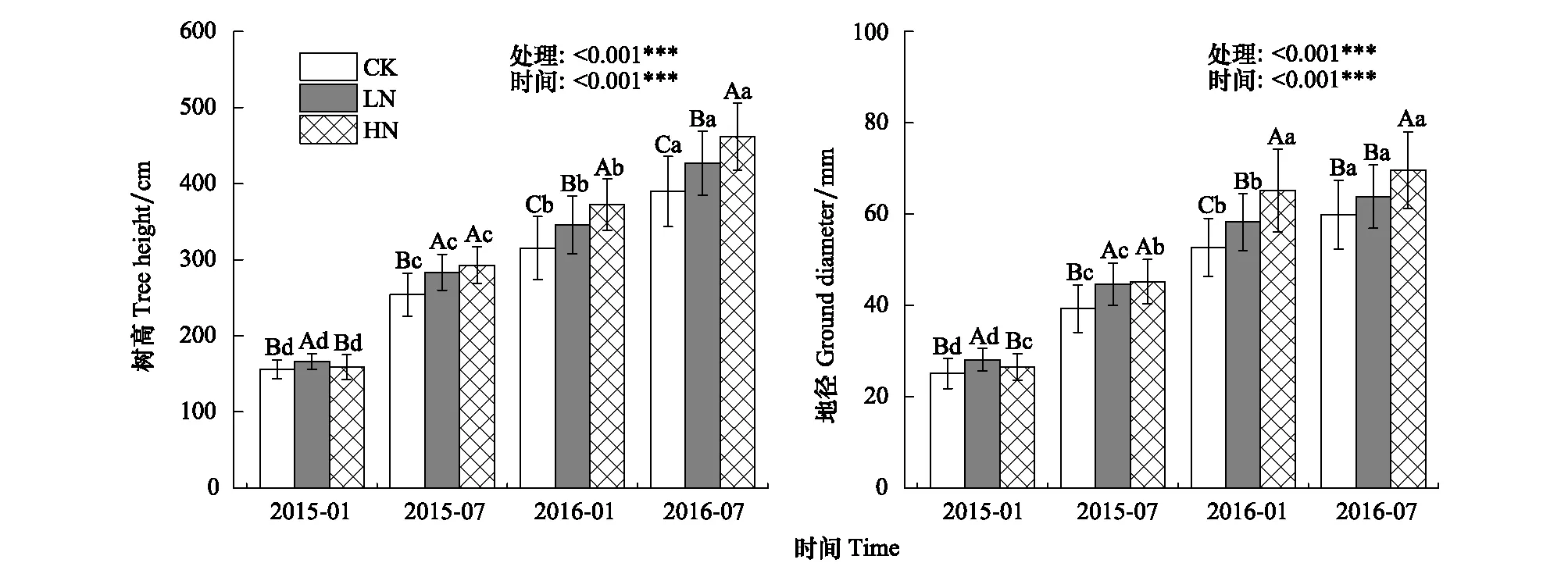
图2 不同时间不同处理杉木幼树的树高、地径Fig.2 The tree height and ground diameter of Chinese fir seedlings under different times CK,对照处理 control; LN,低氮添加low nitrogen treatment; HN,高氮添加high nitrogen treatment;不同大写字母表示同一取样时间不同处理间差异显著,小写字母表示同一处理不同取样时间间差异显著(P<0.05),图中数据为平均值±标准差
1.6 数据分析
利用SPSS 20.0软件对数据进行统计分析,显著性水平设定为P=0.05。采用重复测量方差分析探讨氮添加、径级和取样时间对细根C、N、P浓度及C∶N比、N∶P比的影响;采用单因素方差分析加多重比较Tukey HSD检验同一取样时间不同处理间,以及同一处理不同取样时间细根C、N、P浓度及C∶N比、N∶P比、树高和地径的差异。利用Origin 9.0软件作图。
2 结果
2.1 N添加对细根C、N、P浓度的影响
N添加对细根C浓度的影响达到了极显著水平(N∶P<0.001),且其影响因不同取样时间(T×N∶P<0.001)和不同径级(N×D:P<0.05)而异(表2)。LN处理在2015年1月、7月显著降低0—1 mm细根C浓度,在2015年7月显著降低1—2 mm细根C浓度;HN处理在2015年1月、7月显著降低0—1、1—2 mm细根C浓度,但在2016年1月、7月显著增加0—1、1—2 mm细根C浓度;随着杉木幼树的生长细根C浓度逐渐增加(图3)。
N添加对细根N浓度的影响达到了极显著水平(N∶P<0.01),且不因取样时间(T×N∶P=0.137)和径级(N×D∶P=0.629)而异(表2)。LN处理在2016年7月显著降低0—1 mm细根N浓度,在2016年1月显著降低1—2 mm细根N浓度;HN处理在2015年1月,2016年1月、7月显著增加0—1 mm细根的N浓度,在2015年1月显著增加1—2 mm细根N浓度(图3)。
N添加对细根P浓度的影响因不同取样时间(T×N∶P<0.01)而异(表2)。LN处理在2016年1月、7月显著降低0—1 mm细根P浓度,在2016年1月降低1—2 mm细根P浓度;HN处理在2016年1月、7月显著降低0—1 mm细根P浓度,对1—2 mm细根P浓度无影响(图3)。

图3 不同时间不同处理各径级的细根C、N、P浓度Fig.3 C、N、P concentrations in fine roots of different diameter classes under different times
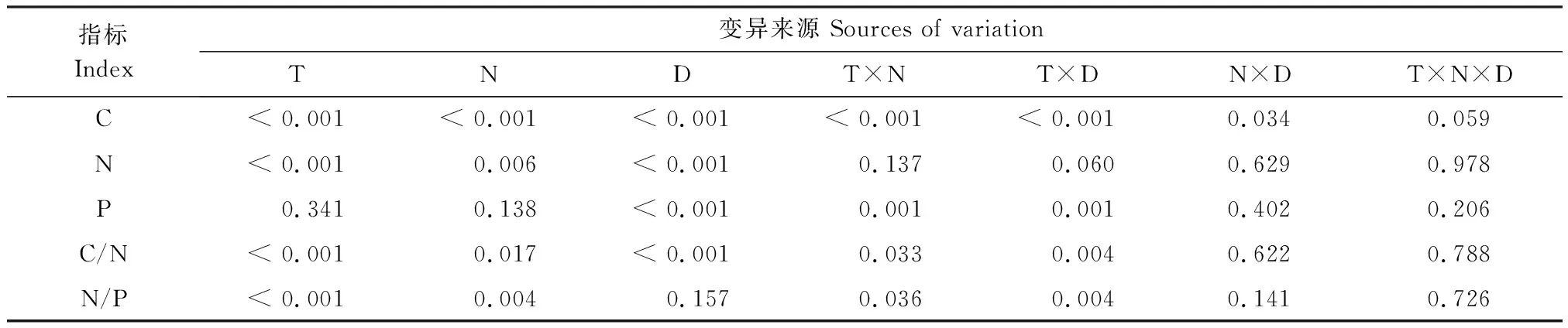
指标Index变异来源 Sources of variationTNDT×NT×DN×DT×N×DC< 0.001< 0.001< 0.001< 0.001< 0.0010.0340.059N< 0.0010.006< 0.0010.1370.0600.6290.978P0.3410.138< 0.0010.0010.0010.4020.206C/N< 0.0010.017< 0.0010.0330.0040.6220.788N/P< 0.0010.0040.1570.0360.0040.1410.726
T: 取样时间, Time; N∶ 氮添加处理, Nitrogen addition; D: 径级, Diameter class
2.2 N添加对细根C∶N比、N∶P比的影响
N添加对细根C∶N比的影响达到了显著水平(N∶P<0.05),且因不同取样时间(T×N∶P<0.05)而异,但不因径级(N×D∶P=0.622)而异(表2)。LN处理在2016年7月显著增加0—1 mm细根C∶N比,在2016年1月、7月显著增加1—2 mm细根C∶N比;HN处理在2015年1月、2016年1月显著降低0—1 mm细根C∶N比,在2015年1月显著降低1—2 mm细根C∶N比(图4)。
N添加对细根N∶P比的影响达到了显著水平(N∶P<0.01),且其影响因不同取样时间(T×N∶P<0.05)而异,但不因径级(N×D:P=0.141)而异(表2)。4次取样LN处理对0—1、1—2 mm细根N∶P比均无显著影响;HN处理在2015年7月,2016年1月、7月显著增加0—1 mm细根N∶P比,在2015年1月、2016年1月显著增加1—2 mm细根N∶P比。
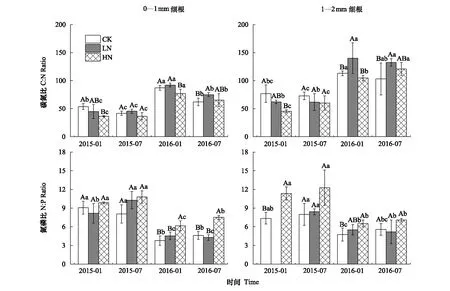
图4 不同时间不同处理各径级的细根C∶N比、N∶P比Fig.4 C∶N ratios, N∶P ratios in fine roots of different diameter classes under different times
3 讨论
3.1 N添加对细根C、N、P浓度的影响
本研究结果显示,N添加在2015年降低了细根的C浓度,增加了细根N浓度(特别是HN处理),这与Ostertag和Zhu等研究结果一致[27-28]。可能是因为N添加增加了土壤N有效性,导致细根吸收N浓度增加[9,29],由于细根N浓度提高从而相对地降低了细根组织的C浓度;另外,细根组织N浓度与细根呼吸速率呈高度正相关[30],研究表明分配到根系中的C有75%用于(包括菌根在内的)细根呼吸[31],所以细根N浓度提高了细根呼吸作用,消耗了根中大量非结构性碳水化合物(NSC)[32],从而导致细根C浓度降低,这在HN处理中表现的更突出;或者是因为N添加后C分配格局发生改变,更多的C用于维持地上部分的生长[33],导致林木生长加快(图2),但使地下C分配比例相对降低,从而导致细根C浓度降低。
本研究还发现,HN处理后期显著提高细根C浓度,这与之前的研究结果不一致[34]。可能是因为HN增加常引起土壤酸化[35],会导致根外皮层细胞中大量的酚类物质沉淀,加速外层细胞的木质化或栓质化[36],导致细根C浓度升高。与HN相比,2016年1月和7月LN处理对细根C浓度的影响不显著,可能是因为LN处理对土壤中的铵态N没有显著影响,而显著增加了土壤中硝态N(表1)。植物在利用硝态N时需要消耗更多的C[37-38],导致细根中C浓度没有显著增加。同时本研究结果表明,2016年细根N浓度较2015年低,可能是因为2016年杉木生长较快、苗木个体较大、细根吸收的N更多用于植物地上的生长以及杉木生长的稀释作用引起的[39]。而3个处理细根C浓度均随着时间的增加而呈增加趋势,这可能与随着杉木幼树的成长,细根N浓度降低、且含C量较高的单宁酸、木质素、纤维素在细根中积累有关[40]。
N添加对细根元素化学计量学的影响研究主要集中在对细根C、N的影响上,而对细根P 浓度的影响研究较少。本研究中,2016年两次取样中N添加显著降低了0—1 mm细根P浓度,这与Sardans等人的研究结果一致[41],即高水平的N添加增加了细根对N的吸收,但降低了细根对P的吸收。N添加促进杉木的生长而产生的稀释作用使细根中P浓度相对降低[38]。此外,细根对P元素的吸收更多的需要菌根的帮助[42],但随着土壤有效N含量的增加,植物吸收N素的成本降低,对AM真菌的依赖性就会减弱,使菌根侵染降低[43-44],本研究中LN、HN处理表层土壤硝态N分别增加了3倍、5.8倍,HN处理表层土壤铵态N增加了3.8倍,N添加后土壤N有效性水平提高,可能使细根菌根菌侵染率降低[45],这也间接导致细根对P元素的吸收相对降低。
3.2 N添加对细根C∶N比、N∶P比的影响
有研究表明,细根C∶N比过大,微生物分解利用减慢,需要消耗土壤中的有效N,而细根C∶N比降低则有利于在细根死亡后被微生物分解,促进养分循环[42]。本研究结果表明,LN处理2016年7月增加了0—1 mm细根C∶N比,2016年1月和7月增加了1—2 mm细根的C∶N比;这主要与LN处理中杉木生长的稀释效应导致细根N浓度值低于对照有关。HN处理只在2015年1月和2016年1月降低0—1 mm细根C∶N比、2015年1月降低1—2 mm细根C∶N比,这主要与HN处理导致细根N的积累有关。这些结果说明LN和HN处理对细根的C∶N比的影响存在一定的相反趋势,从而可能对细根的分解及其在生态系统养分循环中的作用产生不同的影响。本研究还发现随着杉木幼树的生长,细根C∶N比有增加的趋势,这可能也与生长的稀释效应导致细根N浓度降低有关。
4次取样LN对细根N∶P比均无显著影响,但HN在多数取样时间中显著增加了0—1 mm和1—2 mm细根N∶P比,这主要是因为HN处理细根N浓度的升高和P浓度的降低导致,表明了HN可能导致植物体营养元素失衡,特别是受P营养的限制可能更为强烈[34]。Yuan等[46]对全球细根进行研究发现细根N∶P比值在13—18之间;马玉珠等[47]通过对中国植物细根C、N、P化学计量学的研究得出细根N∶P比平均为14.3,粗根N∶P比平均为11.7。通常认为N∶P比低于14说明受N限制,N∶P比高于16受P限制,大于14小于16说明受N、P共同限制[48]。本研究中,0—1 mm细根N∶P比在3.8—10.8之间;1—2 mm细根N∶P比在4.8—12.3之间,低于全球及中国平均细根N∶P比,说明在N沉降比较严重的中国亚热带地区,N元素可能仍是处于幼龄杉木的限制性因素,因为幼龄杉木处于快速生长中,特别是构建树冠需要大量的N素,这从N添加处理显著促进杉木生长中可以反映出来(图2)。本研究中,2016年3个处理0—1、1—2 mm细根N∶P比显著低于2015年,可能是由于苗木生长对N的稀释效应大于对P的稀释效应所致。
4 结论
在两年四次取样中,N添加在2015年降低细根C浓度,此后低N添加处理无影响,但高N添加则在2016年增加了细根C浓度,说明N添加后植物可能调整了地下C的分配。高N添加提高了细根(特别是0—1 mm细根)N浓度,但低N添加则无显著影响,甚至在2016年7月由于生长稀释效应而显著降低细根N浓度。N添加在2015年对细根P浓度没有显著影响,但在2016年导致细根(特别是0—1 mm细根)P浓度降低,这可能与苗木生长对P的稀释效应有关。低N处理在2016年显著提高细根的C∶N比,而高N处理则在2015年显著降低细根的C∶N比,说明不同水平N添加对生态系统C和养分循环产生的影响不尽相同,甚至产生相反影响。低N处理对细根N∶P比没有显著影响,而高N处理则在大部分取样时间里显著增加了细根N∶P比,高N添加可能导致植物体营养元素失衡。同时,不同处理细根C浓度、C∶N比均随着时间的增加呈增加趋势,而细根N浓度和N∶P比呈降低趋势,这可能亦与苗木生长对细根N浓度的稀释效应有关。本研究表明,N添加处理对杉木幼树细根化学计量学特征的影响因不同N添加水平而异,并受幼树生长的稀释效应的调节。
本文的研究结论是基于苗木两年4次取样的测定结果,由于苗木个体发育对细根化学计量学具有一定影响,因而本研究中N沉降对杉木幼苗细根化学计量学的影响是否能够外推至成年林木还有待于进一步的验证,未来的研究亦需要在更长的时间尺度上进一步揭示N沉降对杉木细根化学计量学的影响。

