奶牛乳房炎源金黄色葡萄球菌耐药性研究进展
赵艳坤 刘慧敏 王帅 蔡建星 王成 陈贺
(1. 新疆农业科学院农业质量标准与检测技术研究所 农业农村部农产品质量安全风险评估实验室 新疆农产品质量安全实验室,乌鲁木齐830091;2. 农业农村部农产品质量安全风险评估实验室,北京 100193)
金黄色葡萄球菌(Staphylococcusaureus,S.aureus)是一种革兰氏阳性菌,在世界范围内被称为侵袭性病原菌,是引起奶牛乳房炎的重要致病菌之一,感染率达50%以上[1]。S.aureus性乳房炎主要致病机理是侵入奶牛乳腺组织后,定殖和黏附于乳腺上皮 细 胞(Mammary epithelial cells,MECs)[2], 损害MECs和腺泡功能[3],还可出现乳腺脓肿、硬化或瘘管,严重者会出现乳腺的坏死和脱落,一旦感染很难治愈[4],不仅影响产奶量和乳品质,造成巨大经济损失,甚至危及人类健康。近年来,随着抗菌药物在临床和畜牧业的滥用,S.aureus耐药性问题日趋严重,出现了多重耐药(Multidrug-resistant,MDR)菌株及超级细菌-耐甲氧西林金黄色葡萄球 菌(Methicillin-resistantStaphylococcus aureus,MRSA),其MDR和泛耐药(Pan-drug resisitance,PDR)引起了国内外专家学者广泛关注[5]。据报道,全球MRSA的检出率为18.4%-82.9%,我国MRSA平均检出率为47.9%[6],MRSA 90%以上是MDR菌株[7]。目前,细菌耐药性问题已成为全世界共同关注的焦点,中国政府也十分重视抗菌药物临床合理使用和细菌耐药问题。2018年,为贯彻十九大精神,全国坚持实施优质乳工程,而在十三届全国人大一次会议中,农业部表示将狠抓细菌耐药性问题。现阶段,在抗菌药物选择的压力下,新的S.aureus耐药机制不断出现,且伴随着耐药基因在菌体间的转移,使得S.aureus性奶牛乳房炎难以使用1种抗菌药物或不同化学成分的抗菌药物联合治疗。目前,乳制品和兽医业对奶牛临床治疗的现状要求限制S.aureus耐药性传播,并迫切需要开发不被现有耐药机制覆盖的新抗菌药物。因此,本文分析S.aureus耐药性现状,并结合S.aureus耐药基因以阐明其耐药机制,旨为S.aureus性奶牛乳房炎临床治疗用药及新型药物研发提供理论参考,同时响应十九大精神对整个奶牛养殖业的绿色健康发展具有重大意义。
1 奶牛乳房炎金黄色葡萄球菌耐药现状
S.aureus产生耐药的根本原因是抗菌药物的大量使用,且抗菌药物使用时间越长,其越容易产生耐药性,两者呈正相关[8]。丹麦于1963年最早发现了人类耐甲氧西林且mec基因阳性的金黄色葡萄球菌菌株(Methicillin-resistantStaphylococcus aureus,MRSA)[9]。1975年,比利时首次从奶牛乳房炎中分离出MRSA[10]。近年来,随着S.aureus和MRSA的流行传播,其泛耐药性给奶牛养殖业带来严重的威胁,因此在全球备受关注。
1.1 国外奶牛乳房炎源S.aureus耐药现状
S.aureus具有广谱耐药和多种耐药特性(表1)。2011-2018年近10年的统计数据可以看出,国外对奶牛乳房炎中S.aureus、MRSA的分离率因地域性差异浮动较大,2011-2014年MRSA的分离率不是很高,但近几年有增加的趋势;S.aureus对β-内酰胺类、氨基糖苷类、喹诺酮类及大环内酯类等常见类型抗菌药物表现不同程度的耐药,耐药性变化趋势为:β-内酰胺类、磺胺类、四环素类及氨基糖苷类耐药性明显上升;大环内酯类略有上升;喹诺酮类耐药性没有明显变化。值得一提的是,2015年南非西北部发现S.aureus对万古霉素的耐药率高达68.79%;2018年,阿拉伯北部发现S.aureus对氯霉素耐药率达13.7%,而在此之前对其均表现敏感,说明S.aureus耐药菌株逐渐增多,但其区域性差异巨大。同时,奶牛乳房炎S.aureus的MDR(30.9%-100%)现象严重,近两年分离的S.aureus均为MDR(100%)。
1.2 国内奶牛乳房炎源S.aureus耐药现状
查阅近年来我国奶牛主要养殖区域或乳房炎高发地区的S.aureus耐药性相关资料并进行整理,总结我国各地区耐药率高低如下:新疆:PG>AMP>ERY> 克林霉素(Clindamycin,CLI)>TET>SXT;内蒙古:ATM>氧氟沙星(Ofloxacin,OFX)>AMP>SXT>ERY;宁夏:PG>AMP>ERY>SXT;天津:PG>CEF>ERY>TET> 甲氧西林(Methoxicillin,MET)>CLI>林可霉素(Lincomycin,LNY);河北:磺胺异恶唑(Sulfonazo isoxazole,SIZ)>AMP>甲氧胺嘧啶(Methoxamine pyrimidine,TMP)>SXT>阿 莫 西 林(Amoxicillin,AMC)>强力霉素(Doxycycline,DO)>ERY>克拉霉素(Clarithromycin,CLR)>LNY>阿奇霉素(Azithromycin,AZM);山东:PEN>诺氟沙星(Norfloxacin,NOR)>恩诺沙星(Enrofloxacin,ENR)>卡那霉素(Kanamycin,K)>链霉素(Streptomycin,SM)>GM>ERY;黑龙江:PG>AMP>SXT;江苏:PG>AMP>SXT>SM>K>ERY>TET>CLI;上海 :PG>AMP>SXT>ERY ; 安 徽 :PG>AMP>SXT>ERY>CLI;浙江:PEN>AMP>SXT;河南:PG>AM0>AMP>SXT;陕西:PG>AM0>AMP>SM。假设同一地区大于70%的S.aureus分离株对某种药物敏感度认定为该区S.aureus菌株对此药敏感,我国新疆[20]、内蒙古[21]、黑龙江[22]、宁夏[23]、陕西[24]、四川[25]、天津[26]、河北[5]、安徽[27]、上海[28]等 14 个地区分离的牛源S.aureus对PG、AMP和SXT均表现出极强的耐药性;大部分省区分离株对ERY耐药;新疆、天津、江苏地区的S.aureus分离株对TET耐药,其他省区对其表现介于耐药与敏感之间;新疆、天津、安徽、四川和江苏分离株对CLI耐药;河南和陕西分离株对AMO耐药性较强;其中河北地区S.aureus耐药菌株最多,对10种抗菌药物表现不同程度耐药,说明我国奶牛乳房炎分离的S.aureus菌株耐药性种类较多,多耐性较广泛。结合表1,世界范围内奶牛乳房炎S.aureus耐药及MDR普遍存在。我国与世界其他地区研究结果一样,不同地区分离的S.aureus菌株对各类常见抗菌药物表现不同程度的耐药性,但地区与地区之间S.aureus耐药菌株差异较大,进一步说明S.aureus耐药性可能具有一定区域性。S.aureus对β-内酰胺类抗菌药物耐药性最严重,这也与国外研究结果一致,说明β-内酰胺类仍然是治疗奶牛乳房炎使用最广泛的一类抗菌药物,导致S.aureus菌株在世界范围内对其高度耐药,符合世界性观察到的S.aureus耐药性普遍趋势。
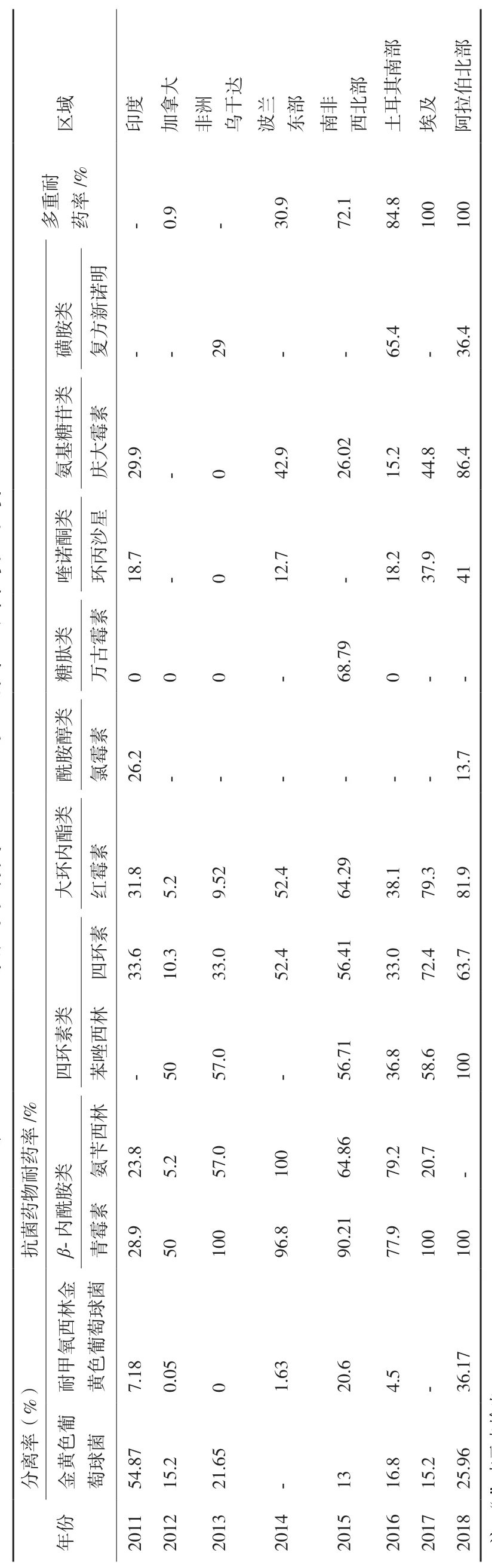
表1 2011-2018 年奶牛乳房炎S.aureus 对10 种常见抗菌药物耐药性[11-19]
事实上,S.aureus菌株的耐药性越来越强,已经发展出广谱的抗菌药物抗性机制,这意味着随着耐药性的不断发展,新的耐药机制将会不断地出现,且变得更为复杂,必定导致S.aureus对临床所用抗菌药物的耐药程度日渐严重,加剧临床治疗难度。
2 奶牛乳房炎金S. aureus耐药机制
S.aureus的耐药性机理复杂,总结主要有以下几种:(1)酶失活;(2)主动外排系统;(3)保护、改变、更换抗菌药物靶位点;(4)基于质粒或染色体上的耐药基因介导的S.aureus耐药机制。现阶段,由基因编码介导的S.aureus分子耐药机制成为各国相关学者研究热点。
2.1 S.aureus对β-内酰胺类抗菌药物的耐药机制
S.aureus对β-内酰胺类抗菌药物的耐药机制主要有以下两种:(1)质粒介导的获得性耐药。S.aureus菌株由耐药因子生成了β-内酰胺酶,此酶附着在细菌表面,经质粒介导,通过胞外β-内酰胺类药物的水解,致使产酶株与非产酶株相比抗菌药物的活性降低或消失,导致S.aureus对β-内酰胺类药物产生耐药;(2)药物结合位点的改变或形成新的青霉素结合蛋白(Penicillin binding protein,PBP)介导的固有耐药。PBPs是构成S.aureus细胞壁形成的重要蛋白酶系统,也是β-内酰胺类抗菌药物与S.aureus菌体的结合靶位点,与其具有较高亲和力。当环境药物浓度达到最小抑菌浓度(Minimum inhibitory concentration,MIC)时,β-内酰胺类药物与PBPs结合,使其乙酰化,导致转肽酶(Transpeptidase,TPase)失活,便会让细菌难以形成细胞壁,从而导致敏感菌死亡[29]。
PBPs的改变是S.aureus对β-内酰胺类药物耐药的重要机制[30]。PBPs在MRSA对苯唑西林的耐药程度中发挥至关重要的作用。β-内酰胺酶、PBPs的过量表达可导致MRSA的低水平耐药,PBPs与苯唑西林的亲和力也是MRSA低水平耐药的原因之一;而PBP2a的存在则导致MRSA高水平耐药,与其他PBPs不同,PBP2a与β-内酰胺类药物亲和力极低甚至不与其结合,致使MRSA高水平耐药。而mecA是PBP2a的编码基因,MRSA的分子耐药机制与mecA基因密切相关。总结有以下两种。
mecA是MRSA的耐药决定子,MRSA的mecA基因通过转座子的移动得到外来基因,该基因大量表达使S.aureus对甲氧西林耐药的产物PBP2a合成。另有资料表明,作为MRSA耐药辅助基因的fem型基因在细菌细胞壁生成环节至关重要,其中femA、femB这两种基因在S.aureus对β-内酰胺类药物耐药方面具有重大影响[31]。据报道,β-内酰胺类抗菌药物针对MRSA的抗药性或可由femA、femB的失活导致,以此同时也造成了其他多种类抗菌药对MRSA的敏感性大幅提升[32]。2014年,万艳红[33]在51株MRSA菌株中发现mecA、femA基因检出率均为100%;另有研究对河南地区180株MRSA菌株进行PCR检测,发现有168株mecA基因阳性(符合率为93.3%),且多为MDR菌株[34]。MSRA产生的高耐药性,实质上是由fem基因协同mecA基因产生的表型,但当mecA与fem其中一方失活后,这一效果便大打折扣。在fem基因失活的前提下,尽管PBP2a可由mecA单独编码产生,但偶见细菌仍出现高度耐药现象[35]。由于mecA和femA基因在MRSA对苯唑西林等β-内酰胺类抗菌药物耐药的重要地位,且其主要存在于耐药菌中,因此,国际上通常检测mecA和femA两个基因以判定S.aureus对甲氧西林抗菌药物是否耐药。
S.aureus的耐药性可能与其细胞壁的形成相关,而PBP2a可能会加速该现象出现,即使相关PBPs活性在β-内酰胺类药物干预结合下而降低,这一现象仍会发生。实验表明,PBP2a不会单方面促成β-内酰胺类抗菌药物对MRSA的耐药性,若沉默PBP2基因,可降低对甲氧西林的耐药程度[36];另外,阻断PBP2的TGase活性时,抗菌药物的存在致使PBP2抑制TPase活性,PBP2a则可恢复TPase活性,实现细菌肽聚糖合成与细胞壁骨架搭建[37]。由此可知,MRSA的耐药性是其细胞壁上合成了相关肽聚糖,而PBP2a则协同PBP催化了该过程。
2.2 S.aureus对四环素类抗菌药物的耐药机制
在对S.aureus测序后发现,其基因序列中包含了灭活酶基因、排外基因、核糖体保护基因及未明机制的基因等。共40多种耐药性基因,而这些耐药性基因均指向四环素类药物,这就揭示了S.aureus对四环素类抗菌药物耐药的本质[38]。在系列针对耐四环素类药物的研究中发现,多数研究主要着力在主动排外基因和核糖体保护基因等基因,TetK、TetO、TetL、TetA及TetC等基因均包含于此。其中在奶牛源葡萄球菌中介导四环素耐药的基因主要为TetL和TetK,TetM和最为罕见的TetO也在牛源葡萄球菌中被检出。国外有学者利用PCR技术检测对S.aureus中可能存在的耐四环素抗菌药物基因片段发现:在分离的90株S.aureus中,TetK基因的检出率为84%,TetL基因为9%,TetM为2%,TetO仅为1%[39]。这些耐药基因能够产生介导四环素耐药的保护蛋白,以质粒或转座子为媒介在各个菌体间快速地产生、扩散着对此类抗菌药物的耐药性。
2.3 S.aureus对氨基糖苷类抗菌药物的耐药机制
S.aureus对氨基糖苷类抗菌药物的耐药机制主要有以下3种:(1)药物结合位点的改变。发生基因突变现象,致使药物无法发挥抑菌或杀菌作用而形成耐药;(2)膜屏障的改变或主动外排作用。减少此类抗菌药物的吸收或阻止药物进入细菌内而产生耐药;(3)氨基糖苷修饰酶(Aminoglycosides modifying enzyme,AMEs)的修饰钝化作用。AMEs通过修饰此类抗菌药物的特定基团,使其降低或失去对靶位核糖体的亲和力而丧失生物活性,从而产生耐药性。这是S.aureus对该类药物产生耐药的主要机制。研究发现,氨基糖苷类抗菌药物耐药的基因中,氨基糖苷乙酰转移酶(Aminoglycoside acetyltransferases,AAC)6′和氨基糖苷磷酸转移酶(Aminoglycosidephosphotransferases,APH)2′′基 因分别编码双功能酶AAC6′和APH2″,这两种编码基因可使S.aureus对GM、K、丁胺卡那(Amikacin,AMK)、妥布霉素(Tobramycin,TM)和奈替米星(Netilmicin,NET)等产生耐药性[40-41];Turutoglu 等[42]从奶牛乳房炎分离出了18株MRSA菌株,进行PCR耐药基因检测及序列分析发现,有3株mecA阳性基因编码耐甲氧西林,并证明了这3株菌株存在AAC6′、APH2″、APH3′等基因编码的氨基糖苷类耐药,表明携带氨基糖苷类修饰酶基因的3株菌株对庆大霉素、卡那霉素和新霉素耐药;徐佳[43]对奶牛乳房炎葡萄球菌种类及耐药性研究表明,32.1%的S.aureus为AACA、APHD基因检测阳性,证实了表达AAC6′、APH2″是S.aureus对氨基糖苷类抗菌药物耐药的主要原因;Crossman等[44]学者在对S.aureus全基因组的研究中发现,S.aureus带有多种拟多重耐药转运蛋白基因。目前,国内外相关报道罕见,其功能和具体作用机制尚未明确,尚需进一步研究。
2.4 S.aureus对大环内酯、林可胺类(Macrolides lincosamides,MLs)抗菌药物的耐药机制
S.aureus对MLs抗菌药物的耐药机制主要有3种:(1)药物活性被钝化;(2)药物与菌体的作用位点突变;(3)菌体内形成了主动转运药物系统。
多项研究表明,红霉素核糖体甲基化酶(Erythromycin ribosome methylase,erm)基因、msr基因是介导MLs抗菌药物耐药的两个主要基因。S.aureus染色体或质粒上携带erm、msr基因,分别编码核糖体甲基化酶和转运蛋白[45],这两种编码基因通过修改抗菌药物与菌体的结合位点,抑制MLs类抗菌药物,从而使得S.aureus对MLs抗菌药物耐药[46]。其中erm基因是介导S.aureus对MLs抗菌药物产生广泛耐药的主要原因,erm基因表达及其上游启动子出现突变均可致使MLs产生耐药,当核糖体蛋白L4和大亚基的23S rRNA碱基突变而抑制该类药物与核糖体靶位点结合,也可导致MLs抗菌药物耐药[47];而msrA和msrC基因编码的主动泵出系统可将MLs抗菌药物从细胞中排出,以保持细胞内低浓度MLs药物水平。报道称,msrC基因在介导S.aureus对红霉素高水平耐药中发挥重要作用[48]。
erm、msr基因已被证实在牛源S.aureus中检出。Kot等[49]研究表明,奶牛乳房炎中S.aureus检出率16.4%,其中15.6%对MLs抗菌药物产生了耐药性,对其抗性基因检测得出,ermA、ermB和ermC的检出率分别是14.8%、11.1%和55.5%;2018年,最新研究表明,牛源奶酪被认为是抗菌药物耐药基因的储存库,S.aureus分离率为4.3%,16S rRNA基因的DNA序列鉴定结果显示,耐药基因msrA携带率为60.9%,msrB携带率为46.6%[50]。说明S.aureus及MLs耐药基因分离率因地域性不同差异较大。
2.5 S.aureus对喹诺酮抗菌药物的耐药机制
S.aureus对喹诺酮类抗菌药物(Quinolone antibiotics)耐药的机制主要有3种:(1)药物靶酶及编码基因的突变。DNA促旋酶和拓扑异构酶IV是喹诺酮类药物对S.aureus发挥抗菌作用的靶酶,grlA和grlB基因编码DNA促旋酶,grlA、grlB和parC基因编码拓扑异构酶IV[51]。李晓娜等[52]报道220株奶牛乳房炎S.aureus菌株中grlA基因、gyrA基因和norA基因的检出率分别为80%、78.64%和78.18%,说明奶牛乳房炎S.aureus携带喹诺酮类药物耐药基因,这些基因位点的突变可引起喹诺酮类药物作用的靶位改变,从而导致S.aureus对喹诺酮类药物耐药。但不同结构的喹诺酮类药物对S.aureus的作用位点不同。苗贝贝等[53]通过研究左氧氟沙星、莫西沙星和奈诺沙星3种喹诺酮类药物对S.aureus耐药突变体的体外抗菌活性发现,左氧氟沙星优先作用于S.aureus拓扑异构酶Ⅳ靶位parC基因,而莫西沙星和奈诺沙星则几乎同时作用于S.aureusDNA促旋酶靶位grlA基因和拓扑异构酶Ⅳ靶位parC基因。该类药物耐药性与这些靶位酶基因密不可分,统称为喹诺酮类药物耐药决定区(Quinolone resistance-determining regions,QRDR)基因 ;(2)主动外排系统。主要为norA、norB、norC基因介导的主动外排系统[56],使药物在菌体内蓄积量减少,从而介导喹诺酮类药物低水平耐药;(3)质粒介导的耐药机制。质粒介导的喹诺酮类药物耐药(Plamidmediated quinolone resisitence,PMQR) 机 制 通 过PMQR基因实现。目前,qnr、Aac6’-Ib-cr、qepA和oqxA/B基因的作用机制已较为成熟,主要通过以下5种方式介导S.aureus产生耐药:①与喹诺酮作用靶酶结合,降低药物对细菌的抑制作用;②提高细菌MIC,增加细菌耐药率;③促进细菌染色体基因自身突变,增加高水平耐药菌株;④将药物排出菌体外,降低药物在菌体内的蓄积量;⑤使gyrA、parC功能区发生突变,细菌趋于高水平耐药。而Cfr和fexA两种基因在牛源S.aureu中报道较少,是今后挖掘S.aureus对喹诺酮类分子耐药机制的新元素。

表2 S.aureus常见的基因突变位点[51-55]
3 结语
奶牛乳房炎S.aureus面临着严峻的耐药及其耐药基因流行传播形势,出现了多重耐药现象,但细菌耐药性的产生是一种天然抗生现象,现代畜牧业中抗菌药物的使用不可避免,随着细菌耐药性的快速发展,S.aureus耐药机制日渐复杂。因此,应重点关注S.aureus耐药现状及其变迁情况,从分子水平深层探索S.aureus耐药机制,发现新的耐药基因,找出削减S.aureus及MRSA耐药机理,避免抗菌药物的恶循环滥用,为奶牛乳房炎设计合理的临床治疗方案。奶牛乳房炎源病菌耐药性监测试剂盒和相应新型抗菌药物的研发是相关研究领域发展趋势。

