乙二醛和丁二酮抑制PhIP形成的作用机制研究
韩中惠,王晓敏,吴士莹,张燕,王硕
(1.天津科技大学食品工程与生物技术学院,食品营养与安全国家重点实验室,天津300457;2.南开大学医学院,天津市食品科学与健康重点实验室,天津300071)
热加工可提高食品营养品质,改善食品营养消化率和延长食品保质期等[1],但在热加工过程中也会伴随产生一些健康危害物,如杂环胺[2]、亚硝胺、丙烯酰胺[3]、呋喃[4]等。杂环胺是富含蛋白质的食物在热加工过程中形成的具有多环芳香族结构的致癌致突变物的一类化合物。动物实验证明这些杂环胺具有增加罹患结肠癌、胰腺癌、胃癌和食道癌等疾病的风险[5]。国际癌症研究机构(International Agency for Research on Cancer,IARC)把八种杂环胺(包括2-氨基-1-甲基-6-苯基-咪唑 [4,5-b]吡啶(2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine,PhIP))列为 2 类致癌物[6]。针对肉制品中杂环胺的相关研究具有重要意义。到目前为止,已经从热加工的肉类中分离鉴定了30多种的杂环胺[1],其中2-氨基-1-甲基-6-苯基咪唑并[4,5-b]吡啶(PhIP)是含量较高的一种[7],所以 PhIP 经常作为研究杂环胺的代表物。
相关机制研究阐明,苯丙氨酸和肌酐是形成PhIP的必需前体物;苯乙醛是形成PhIP的关键中间体,由苯丙氨酸通过Strecker(斯特雷克)降解产生[1,8-9]。目前研究表明多酚类化合物[10-11],酰胺化合物[10]和金属阳离子[12]等物质都能显著减少食品中PhIP的含量,其相关的抑制PhIP形成的机理也被阐明。研究人员证实不同种类的糖能够抑制食品中杂环胺PhIP的产生,然而对于抑制机制鲜有报道[13-14]。我们的研究工作发现糖的降解产物α-二羰基化合物能够显著抑制PhIP的形成,并揭示了糖通过其降解产物丙酮醛抑制PhIP形成的作用机制[15]。乙二醛和丁二酮与丙酮醛同属于α-二羰基化合物,均为糖降解产物,并对杂环胺PhIP的产生具有显著的抑制作用,但并没有研究揭示其抑制机制。因此,本文将系统分析在模拟体系中乙二醛和丁二酮抑制杂环胺PhIP形成的作用机制,为真实食品中杂环胺的形成控制提供理论基础。
1 材料与方法
1.1 试剂与材料
PhIP标准品(98%):加拿大 Toronto Research Chemicals公司;肌酐和苯丙氨酸标准品:美国Sigma-Aldrich公司;苯乙醛标准品:上海阿拉丁生化科技有限公司;乙二醛(40%水溶液)、丁二酮、肌酐和苯丙氨酸(均为分析纯):美国Sigma-Aldrich公司;甲酸铵和乙酸铵(均为分析纯):国药集团化学试剂有限公司;AccQ-Tag试剂包:美国Waters公司。固相萃取柱HyperSep C18(200 mg/5 mL):美国 Thermo Scientific 公司;固相萃取柱 Si-SCX-2(200 mg/5 mL):美国 SILICYCLE公司。
1.2 仪器与设备
Agilent 6410型高效液相色谱-三重四级杆质谱联用仪(high performance liquid chromatography-triple quadrupole mass spectrometer,HPLC-MS/MS)和 Agilent 7890B/977A型气相-质谱联用仪(gas chromatographymass spectrometer,GC-MS):美国 Agilent公司;LC-20A型高效液相色谱仪(high performance liquid chromatography,HPLC):日本 Shimadzu公司;12通道固相萃取仪:美国Sigma-Aldrich公司;RCT BS 25型磁力搅拌器和MS 3型涡旋混合器:德国IKA公司;FE20K型PH计:瑞士梅特勒-托利多公司;5804R型离心机:美国Beckman公司;MGS-2200型氮吹仪:日本东京理化公司;SBH200D/3型干浴加热器:英国BIBBY公司。
1.3 模拟体系的建立
1.3.1 苯丙氨酸/肌酐/乙二醛(或丁二酮)模拟体系
分别取 0.01、0.05、0.1、0.5 mmol的乙二醛或丁二酮。将不同摩尔量的乙二醛(或丁二酮)、0.1 mmol的肌酐和0.1 mmol的苯丙氨酸分别置于螺口管中,加入3 mL二甘醇(86%)/水(14%)溶液中,然后在涡旋振荡器上使其充分混匀溶解后放入干浴加热器中。干浴加热器温度为130℃,加热时间为120 min[15]。加热反应结束后,取出样品,放在冰水中冷却至室温待用。每组试验重复进行3次。
1.3.2 苯丙氨酸/乙二醛(或丁二酮)和肌酐/乙二醛(或丁二酮)模拟体系
分别取 5、10、20、50、100 μmol的乙二醛或丁二酮。将不同摩尔量的乙二醛(或丁二酮)和0.1 mmol的苯丙氨酸或0.1 mmol的肌酐置于螺口管中,加入3 mL二甘醇(86%)/水(14%)溶液中,以下处理方式同1.3.1。
1.3.3 PhIP/乙二醛(或丁二酮)模拟体系
分别取 0.01、0.025、0.05 、0.1、0.25 μmol的乙二醛或丁二酮。将不同摩尔量的乙二醛(或丁二酮)和10 nmol的PhIP置于螺口管中,加入3mL二甘醇(86%)/水(14%)溶液中,以下处理方式同1.3.1。
1.4 试验方法
1.4.1 标准溶液的配制
配制不同浓度的苯丙氨酸、苯乙醛、肌酐和PhIP标准溶液,将它们至于4℃的冰箱中避光保存备用。
1.4.2 苯丙氨酸的检测
苯丙氨酸的测定使用的是AccQ·Tag方法[16]。首先使用配制Waters AccQ·Fluor衍生试剂对检测样品进行衍生,然后将衍生好的样品待HPLC测定。
HPLC的色谱条件:色谱柱为Waters AccQ·Tag氨基酸分析柱 Nova-PakC18(3.9 mm×150 mm,4 μm);柱温为35℃;流速为0.8 mL/min;流动相:A为AccQ·Tag/水洗脱液(1/10,体积比),B为乙腈/水混合液(60/40,体积比);检测器为荧光检测器,其激发波长为250 nm,发射波长为395 nm;进样体积为1 μL。洗脱梯度如表1。
1.4.3 苯乙醛的检测
将样品使用适量的乙酸乙酯/己烷(3/1,体积比)提取3次。低温下进行除有机溶剂,然后使用10 mL的乙酸乙酯定容,将制得的样品过有机滤膜(0.22 μm),待GC-MS分析。
GC-MS分析方法是根据之前描述的方法进行一些修改[17]。气质是由气相色谱Agilent 7890B和质谱选择检测器(mass selective detector,MSD)5977A组成。样品分离色谱柱 HP5-MS(30 m×0.25 nm×0.25 μm);进样的体积是1 μL。气体为氦气,载气流速为1 mL/min,进样口温度为280℃,传输线到MSD的温度为280℃。离子源温度为230℃,质量范围为50 amu~550 amu。色谱柱升温程序:40℃保持1 min,然后以5℃/min到240℃,再以10℃/min升温至280℃。
1.4.4 肌酐的检测
将样品进行50倍的稀释,在将稀释后的样品进行水相滤膜过滤(0.22 μm),滤液待HPLC进行分析。
分析方法如前所述进行适当修改[18]。HPLC的色谱条件:色谱柱为 Kromasil C18(250 mm×4.6 mm×5 μm),流动相:A相为 25 mmol/L KH2PO4缓冲液(pH=6.9),B相为乙腈;10%B相等度洗脱;流速为0.8 mL/min;检测器为紫外检测器,检测波长为215 nm;进样体积为20 μL。
1.4.5 PhIP的检测
样品净化参考实验室已建立方法,试验步骤如下[6,19]:采用丙磺酸阳离子(Si-SCX-2)交换柱和 C18 固相萃取柱串联萃取,将样品洗脱液用氮气吹干然后用1 mL 色谱纯甲醇复溶、稀释,再离心(15 min,1 000 g)、过0.22 μm有机微孔过滤膜,待测。
HPLC-MS/MS的条件:色谱柱为Zorbax Eclipse Plus C18(2.1×150 nm,3.5 μm);柱温为 25 ℃;流速为0.2 mL/min;流动相:A 为甲酸铵(10 mol/L,pH=3.5),B为乙腈;洗脱梯度为:0~12 min,10%~60%(B相);12 min~14 min,60%~10%(B 相);进样的体积为 1 μL;质谱使用电喷雾离子源(electron spray ionization,ESI);雾化和碰撞的气为氮气;雾化气压力为0.28 MPa;毛细管电压为4 000 V;干燥器流量为10 L/min;干燥器温度为350℃;PhIP的质谱跃迁模式为m/z 225.3→m/z 210。
1.5 统计分析
试验所得到的数据以平均值标准偏差(mean±SD)表示。其相关数据通过方差分析(analysis of variance,ANOVA)和邓肯测试(Duncan test)。数据统计分析软件为IBM SPSS 19.0。作图软件为OriginPro 2016。
2 结果与分析
2.1 检测方法验证
为确定测定结果的准确性,对苯丙氨酸、苯乙醛、肌酐和PhIP的方法进行了详细的方法学考察。其中考察的指标包括线性回归方程、检出限(limit of detection,LOD)、定量限(limit of quantilty,LOQ)回收率以及相对标准偏差。苯丙氨酸、苯乙醛、肌酐和PhIP标品的浓度为横坐标,峰面积为纵坐标绘制标准曲线,其线性回归方程、线性相关系数r2、检出限LOD和定量限LOQ如表2。

表2 苯丙氨酸、苯乙醛、肌酐和PhIP的线性回归方程、相关系数及检测限Table 2 Regression equations,correlation coefficients and detection limits for phenylalanine,phenylacetaldehyde,creatintine,and PhIP respectively
苯丙氨酸、苯乙醛、肌酐和PhIP在样品中的回收率分别为85.9%~90.1%,75.6%~81.6%,70.5%~86.9%和75.1%~81.3%,相对标准偏差分别为1.8%~4.3%,2.3%~4.7%,4.3%~5.1%和3.7%~5.2%。试验数据表明,测定苯丙氨酸、苯乙醛、肌酐和PhIP的方法具有较高的准确性和可靠性。
2.2 乙二醛和丁二酮对苯丙氨酸的影响
图1显示了乙二醛和丁二酮分别与苯丙氨酸反应后苯丙氨酸量的变化。

图1 模拟体系中乙二醛和丁二酮对苯丙氨酸的影响Fig.1 Effects of glyoxal and diacety on phenylalanine(Phe)in model system
随着乙二醛的逐渐添加,苯丙氨酸的量也逐渐降低,乙二醛添加量为100 μmol时,苯丙氨酸的浓度降低了(93.52±1.45)%。丁二酮对苯丙氨酸的影响与乙二醛一样,也能使模拟体系中的苯丙氨酸浓度降低,当丁二酮的添加量为100 μmol时,苯丙氨酸的浓度降低了(99.71±0.72)%。以上结果表明乙二醛和丁二酮与苯丙氨酸发生了反应,消耗了苯丙氨酸的量。
苯丙氨酸是PhIP的关键前体物,乙二醛或丁二酮消耗苯丙氨酸的直接结果是导致PhIP形成的减少。但是有研究表明,将苯丙氨酸通过Strecker降解形成苯乙醛是形成PhIP的重要途径,苯乙醛是形成PhIP的重要中间物[1,20]。因此,分析苯乙醛的变化是准确阐明乙二醛或丁二酮和苯丙氨酸的反应在PhIP形成中的作用的关键。
通过GC-MS分析,图2显示了乙二醛和丁二酮分别与苯丙氨酸反应后苯乙醛量的变化。

图2 模拟体系中乙二醛和丁二酮对苯乙醛的影响Fig.2 Effects of glyoxal and diacety on phenylacetaldehyde(PEA)in model system
由图2可知,当添加0~100 μmol的乙二醛后,苯乙醛的浓度增加至(0.026±0.002)μmol/mL,说明乙二醛可与苯丙氨酸反应形成苯乙醛。丁二酮与苯丙氨酸反应形成苯乙醛的量比乙二醛的量低(p<0.05),但也能够显著促进苯乙醛的形成,且随浓度变化而增加。
以上结果证实,苯丙氨酸可以通过乙二醛或丁二酮发生Strecker降解反应降解为苯乙醛[21],而苯乙醛是形成PhIP关键的中间物,由此可见苯乙醛的增多可以促进PhIP的形成。因此,分析认为苯丙氨酸和乙二醛或丁二酮之间的反应不会有助于PhIP的减少,反而促进PhIP的形成。
2.3 乙二醛和丁二酮对肌酐的影响
图3显示了乙二醛和丁二酮分别与肌酐反应后肌酐量的变化。
由图3可知,在肌酐/乙二醛(丁二酮)模型系统中,随着乙二醛浓度从0~100 μmol增加,肌酐的浓度从(0.036±0.002)mmol/mL降至(0.021±0.001)mmol/mL。相同情况,随着丁二酮加入量逐渐增加,肌酐的浓度也逐渐降低。以上结果表明,乙二醛和丁二酮都可以与形成PhIP的关键前体物肌酐发生反应,进而可使PhIP的形成水平降低。
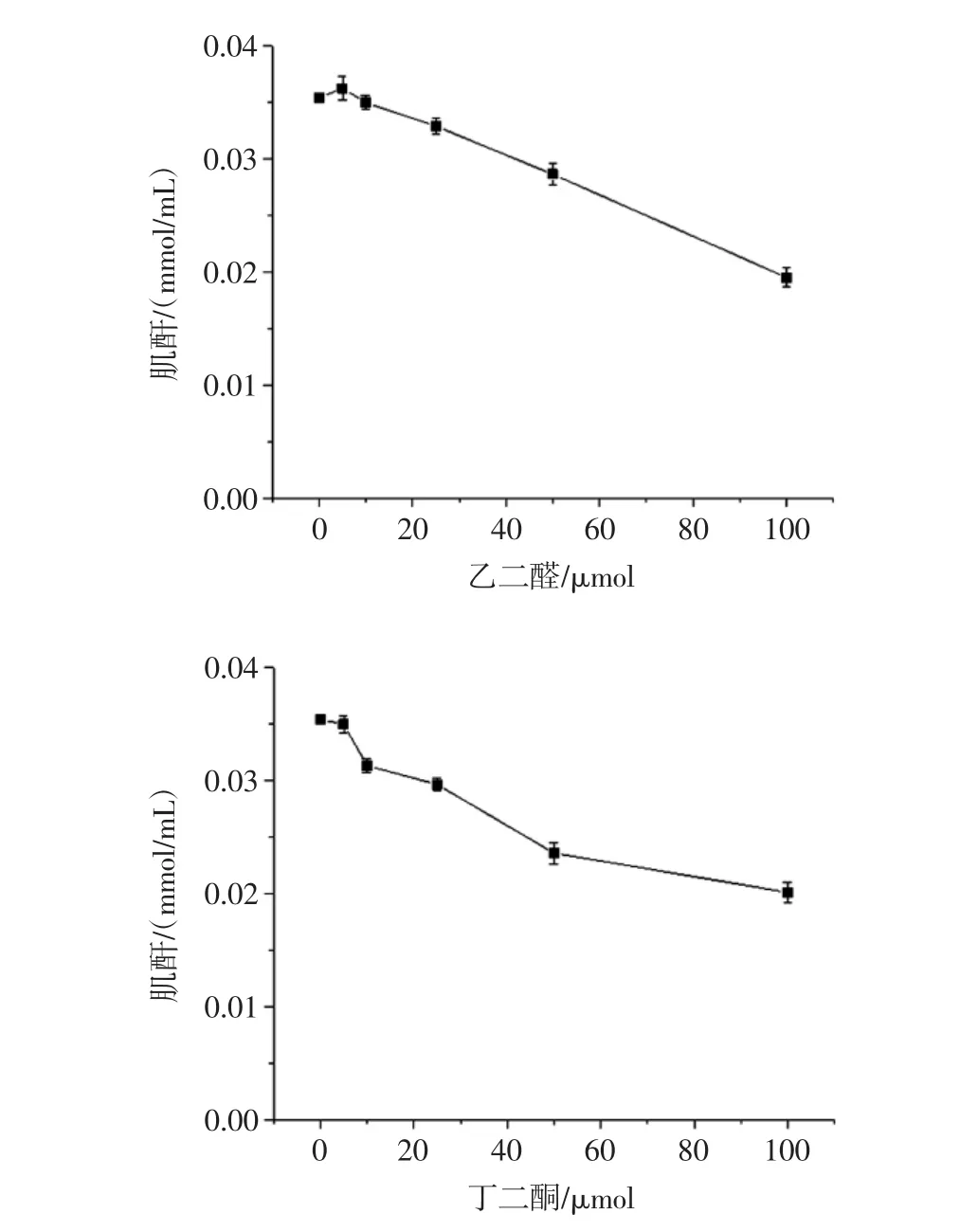
图3 模拟体系中乙二醛和丁二酮对肌酐的影响Fig.3 Effects of glyoxal and diacety on creatitine(Crn)in model system
2.4 乙二醛和丁二酮对PhIP的影响
图4显示了乙二醛和丁二酮分别与PhIP反应后PhIP量的变化。
由图4可知,在模拟体系中,PhIP的量随着乙二醛浓度的增加(从0~0.25 μmol)而显著降低(p<0.05),当在 0.05 μmol时 PhIP 降低(77.27±3.91)%,但是在 0.05 μmol~0.25 μmol之间 PhIP 的降低没有显著的变化(p<0.05)。丁二酮与PhIP反应的变化趋势与以上的情况相似,PhIP随乙二醛添加量的增加而逐渐减少;但是减少量显著低于乙二醛(p<0.05)。通过以上乙二醛和丁二酮对PhIP的影响可以得出,此二种α-二羰基化合物能够与PhIP发生化学反应,可促使PhIP减少。


图4 模拟体系中乙二醛和丁二酮对PhIP的影响Fig.4 Effects of glyoxal and diacety on PhIP in model system
2.5 乙二醛和丁二酮对PhIP形成的抑制
以苯丙氨酸/肌酐/乙二醛和苯丙氨酸/肌酐/丁二酮模型系统来研究乙二醛和丁二酮对PhIP形成的影响。PhIP的量随着乙二醛和丁二酮的浓度增加而下降[15]。这意味着乙二醛和丁二酮显著减少了模型体系中PhIP的形成(p<0.05)。这些结果证实,乙二醛和丁二酮在减少PhIP形成中起重要作用,这可能是由于乙二醛和丁二酮消耗PhIP或其前体物所致。
3 结论与讨论
通过对不同模拟体系中前体物,中间体及产物的系统分析,初步推测了乙二醛和丁二酮抑制PhIP形成的作用机制。乙二醛和丁二酮可分别与苯丙氨酸、肌酐和PhIP发生化学反应,乙二醛、丁二酮与肌酐的反应,以及乙二醛、丁二酮与PhIP的反应可减少PhIP形成;相反,乙二醛、丁二酮与苯丙氨酸反应可促进PhIP前体物苯乙醛的形成进而促进PhIP形成,因此反应体系中PhIP的总体减少是这些化学反应的综合作用结果。这与丙酮醛抑制PhIP的作用机制相同[15]。结合前期相关研究结果分析,进一步证明糖可通过热降解形成α-二羰基化合物来实现对杂环胺PhIP的抑制作用。研究结论为建立食品加工中杂环胺的有效减控技术奠定了理论基础。

